RKIP在人乳腺癌组织及细胞中的表达及其通过NF- κ B信号通路对乳腺癌细胞迁移和侵袭作用的研究
2018-12-17刘学飞张俊梅徐龙
刘学飞,张俊梅,徐龙
解放军第202医院1肿瘤介入科,2皮肤科,沈阳110812
3沈阳军区总医院肿瘤科,沈阳110812
乳腺癌是一种在女性人群中常见的恶性肿瘤, 严重威胁女性健康。在西方发达国家,乳腺癌的发病率居女性恶性肿瘤首位,其致死率仅次于肺癌[1-2]。近年来随着经济的发展、人们生活节奏和生活习惯的改变,乳腺癌在中国女性人群中的发病率逐年升高[3]。目前临床上对于乳腺癌的治疗主要以手术和化疗相结合为主,但乳腺癌细胞具有强大的转移和扩散能力,预后效果并不理想[4-5]。因此,从分子水平研究乳腺癌细胞的迁移和侵袭机制,从而寻找有效的治疗方法具有重要意义。Raf激酶抑制蛋白(Raf kinase inhibitor protein,RKIP)是磷脂酰乙醇胺家族成员之一,在肿瘤细胞内多组激酶信号通路中发挥重要作用[6-7]。核因子(nuclear factor-κB,NF-κB)是一类转录因子,在多种细胞中均有表达,能参与多种基因的表达调控[8]。研究表明,RKIP能够抑制肿瘤细胞中NF-κB信号转导通路的活性,从而调控肿瘤细胞的生长、转移和凋亡,但两者在乳腺癌细胞中的关系尚未清楚[9]。本研究分析了良性和恶性乳腺肿瘤组织中RKIP的表达水平,探讨了人乳腺癌细胞中RKIP对乳腺癌细胞迁移、侵袭能力的影响及与NF-κB可能存在的关系,旨在为乳腺癌的临床治疗及预后评估提供新的靶点,现报道如下。
1 材料
1.1 标本收集
收集2015年4月至2016年12月于解放军第202医院就诊的63例乳腺肿瘤患者的肿瘤组织标本。所有患者均为女性,在手术前均未接受过任何放疗、化疗、内分泌治疗。63例乳腺肿瘤组织中,良性乳腺肿瘤组织28例,患者年龄为18~58岁,平均(33.28±3.57)岁;恶性乳腺肿瘤组织35例,患者年龄为21~60岁,平均(36.43±3.82)岁。
1.2 细胞及载体
高转移性乳腺癌细胞系MDA-MB-435和GV141载体均购自上海博谷生物科技有限公司。
1.3 实验试剂
DMEM培养基和胎牛血清(fatal bovine serm,FBS)均购自美国Sigma公司,兔抗人RKIP抗体购自北京美天晴生物技术有限公司,Lipofectamine 2000购自美国Life Technology公司,SP免疫组化检测试剂盒购自北京中杉金桥生物技术有限公司,Trizol和逆转录聚合酶链反应(reverse transcription-polymerase chain reaction,RT-PCR)试剂盒均购自美国Sigma公司,NF-κB引物购自上海生工生物工程有限公司,Transwell小室和Matrigel液均购自美国Corning Life Sciences公司;甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体均购自上海艾博抗贸易有限公司。
1.4 实验仪器
恒温培养箱、高速离心机均购自美国Thermo Fisher Scientific公司,高压灭菌锅购自上海巴玖实业有限公司,BioTek Synergy HT酶标仪、DYC-p32型电泳槽均购自美国Bio-Rad公司,Leica DC300F显微照像系统购自日本奥林巴斯公司。
2 方法
2.1 免疫组织化学法检测良性和恶性乳腺肿瘤组织中RKIP的表达水平
所有肿瘤组织标本均由本院病理科医师经10%福尔马林固定,石蜡包埋后保存。分别从良性和恶性乳腺肿瘤组织中随机选取10个标本,每个标本取3张切片,按照说明书中的操作步骤,应用免疫组织化学法检测肿瘤组织中RKIP蛋白的表达水平,每张切片随机选取3个视野,在光学显微镜下观察其染色情况,用光学显微镜测定观察区域阳性细胞的积分光密度值(integrated optical density,IOD)。
2.2 MDA-MB-435细胞转染
2.2.1 细胞培养 将乳腺癌MDA-MB-435细胞复苏后,转移至DMEM培养基中,置于37℃、5%CO2培养箱中培养并进行传代,取2~3次传代后的细胞用于实验。将处于对数生长期的细胞转移至6孔板中,密度为8×105/孔,保证在转染时细胞密度为80%~90%。
2.2.2 细胞转染及转染复合物的制备 将含有RKIP基因的cDNA插入GV141载体中构建RKIP质粒,作为RKIP过表达组的转染质粒;以空白GV141载体构建空白质粒,作为对照组的转染质粒。将 2 μg 上述配制好的质粒和 5 μl的 Lipofectamine 2000分别加入250 μl DMEM选择培养基中,充分混匀后用移液枪轻轻吹打,室温下孵育20 min形成转染复合物。
将传代的MDA-MB-435细胞转移至不含抗生素的DMEM培养基中,密度为8×105/孔,将上述配制好的转染复合物加入到6孔板中,与MDA-MB-435细胞共培养12 h,然后更换完全培养基,继续培养48 h,构建RKIP过表达的细胞系和RKIP正常表达的细胞系。
2.3 Transwell小室检测细胞的迁移能力
2.3.1 MDA-MB-435单细胞悬液制备 将转染后的两组细胞离心,弃上清液,用预冷的磷酸盐缓冲液(phosphate buffer saline,PBS)洗涤3次,加入含1%FBS的DMEM培养基,重悬细胞,用移液枪将细胞悬液转移至6孔板内,调整细胞浓度为2×105/孔。
2.3.2 接种及培养细胞 将200 μl细胞悬液加入Transwell小室的上室中,同时向其中加入含1%FBS的DMEM培养基,下室中加入等量的不含FBS的DMEM培养基,在细胞培养箱中培养24 h。
2.3.3 细胞计数Transwell小室培养24 h后取出,擦去上室内细胞,用0.1%结晶紫染色,转用33%醋酸溶液洗脱,在Leica DC300F显微镜下随机选取3个视野观察并拍照,计算细胞数目。实验重复3次。
2.4 Transwell小室检测细胞的侵袭能力
将50 mg/L的Matrigel液按1∶8稀释后,包被在Transwell小室底部膜的上室面,37℃环境下风干,使Matrigel聚合为凝胶,形成人工基底膜。后续步骤同2.3.1、2.3.2和2.3.3。
2.5 蛋白质印迹法(Western blot)检测RKIP蛋白的表达情况
将细胞用RIPA细胞裂解液裂解后提取蛋白质,用10%分离胶溶液、5%浓缩胶溶液灌注后进行电泳,电泳结束后将蛋白质转移至硝酸纤维素膜(nitrocellulose membrane,NC膜),将NC膜置于含5%脱脂奶粉的TBST中封闭2 h,先后加入稀释后的一抗、二抗,TBST洗涤NC膜;增强化学发光法(enhanced chemiluminescence,ECL)显色;胶片扫描后应用Bandscan 5.0软件进行灰度分析。RKIP蛋白灰度值/GAPDH灰度值表示RKIP蛋白的表达水平。
2.6 RT-PCR检测NF-κB基因的表达情况
应用Trizol试剂盒提取总RNA后进行逆转录。取2µl RNA进行RT-PCR扩增,以GAPDH基因为内参。GAPDH正向引物为5'-GCATAATAATGAGCCAAGGACT-3',反 向引物为 5'-AGAACGTCTCTCACTT-3';NF-κBmRNA的正向引物为5'-GTCTTCCTGCTACACTCTTA-3',反向引物为5'-ACACACTCCTGTGAACGCC-3'。NF-κBmRNA及GAPDH的扩增条件:94℃ 2 min(预变性);94 ℃ 30 s(变性),55 ℃ 30 s(退火),72 ℃ 2 min(延伸),共35个循环;72℃总延伸6 min。取5µl RT-PCR扩增产物进行琼脂糖凝胶电泳,紫外线投射仪下观察电泳条带,分析目的基因NF-κBmRNA和内参基因GAPDH条带的灰度值,计算NF-κBmRNA的相对表达量。
2.7 统计学方法
采用SPSS 19.0软件对数据进行统计分析,计量资料以均数±标准差(±s)表示,组间比较采用配对t检验。以P<0.05为差异有统计学意义。
3 结果
3.1 RKIP表达水平的比较
良性乳腺肿瘤组织中RKIP的表达水平较高,IOD值为(0.527±0.057),高于恶性乳腺肿瘤组织的(0.217±0.048),差异有统计学意义(t=14.64,P=0.03)。
3.2 RKIP过表达对细胞迁移和侵袭的影响
RKIP过表达组迁移细胞数目和侵袭细胞数目均明显少于对照组,差异均有统计学意义(P<0.01)。(表1)
表1 RKIP过表达组和对照组MDA-MB-435细胞迁移与侵袭数目的比较(±s)
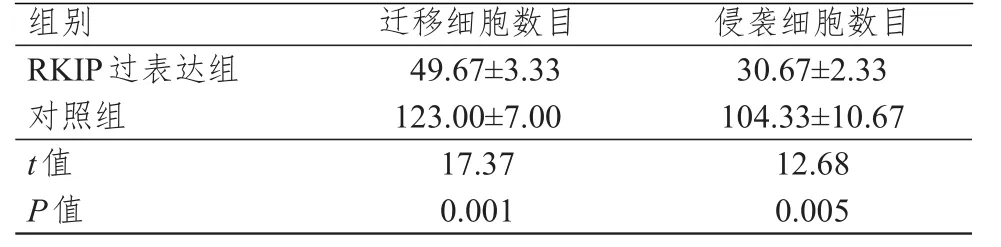
表1 RKIP过表达组和对照组MDA-MB-435细胞迁移与侵袭数目的比较(±s)
组别R KIP过表达组对照组t值P值4 9.6 7±3.3 3 1 2 3.0 0±7.0 0 1 7.3 7 0.0 0 1 3 0.6 7±2.3 3 1 0 4.3 3±1 0.6 7 1 2.6 8 0.0 0 5迁移细胞数目侵袭细胞数目
3.3 Western blot检测RKIP蛋白表达水平
Western blot检测结果显示,RKIP过表达组的RKIP表达水平为(0.059±0.005),明显高于对照组的(0.009±0.002),差异有统计学意义(t=13.89,P<0.01)。
3.4 RT-PCR检测NF-κB mRNA表达水平
RT-PCR检测结果显示,RKIP过表达组中NF-κBmRNA的相对表达量为(0.120±0.016),明显低于对照组的(0.380±0.025),差异有统计学意义(t=7.767,P=0.001)。
4 讨论
乳腺癌是世界范围内威胁女性身心健康的一种致死性恶性肿瘤,在中国女性人群中的发病率呈增长趋势[1-2]。目前对于乳腺癌的治疗主要以手术和化疗为主,但这些手段只能控制原发肿瘤,一旦肿瘤出现转移,会极大地影响预后,致使患者的病死率大大增加[4-5,10]。因此,研究乳腺癌细胞迁移、侵袭的分子机制,从而找到抑制乳腺癌转移、扩散和恶化的治疗途径,提高早期诊断率,降低病死率,是目前临床上迫切需要解决的问题。
肿瘤转移被视为肿瘤发展至晚期的标志[11]。研究表明,RKIP与结肠癌、乳腺癌的转移密切相关[12-13]。姚志强等[14]研究结果显示,乳腺癌组织中RKIP的阳性表达率为51.9%,低于癌旁乳腺组织和乳腺增生症组织的81.8%、100%,差异均有统计学意义(P<0.05),提示RKIP在乳腺肿瘤组织中表达下调,而这种现象可能与乳腺癌的发展有关。本研究检测了良性与恶性乳腺肿瘤组织中RKIP的表达水平,结果显示,良性乳腺肿瘤组织中RKIP的表达水平高于恶性乳腺肿瘤组织,差异有统计学意义(P<0.05),与上述研究结果一致。本研究结果还显示,RKIP过表达组迁移细胞数目为(49.67±3.33),明显少于对照组的(123.00±7.00),差异有统计学意义(P<0.01);RKIP过表达组侵袭细胞数目为(30.67±2.33),明显少于对照组的(104.33±10.67),差异有统计学意义(P<0.01)。提示RKIP高表达可使乳腺癌细胞的迁移和侵袭能力受到显著抑制,表明RKIP基因可能与乳腺癌细胞的迁移和侵袭有关。
NF-κB是一类重要的转录因子,其在肿瘤细胞的发生、发展、迁移、侵袭等过程中发挥重要的调控作用,在卵巢上皮性肿瘤和乳腺癌组织中均发现了NF-κB的高表达[9,14]。研究证实,NF-κB对肿瘤细胞的调控作用受上游RKIP的直接影响,RKIP能够抑制NF-κB的表达及其作用的发挥[9]。本研究结果显示,RKIP过表达组中RKIP的表达水平为(0.059±0.005),明显高于对照组的(0.009±0.002),差异有统计学意义(P<0.01)。RKIP过表达组中NF-κBmRNA的相对表达量为(0.120±0.016),明显低于对照组的(0.380±0.025),差异有统计学意义(P<0.01)。提示 RKIP过表达能够抑制NF-κBmRNA的表达,RKIP对乳腺癌细胞迁移和侵袭的调控可能与其对NF-κB的抑制作用有关。
综上所述,RKIP与乳腺癌的恶化程度有关,RKIP能够抑制乳腺癌细胞的迁移和侵袭,这种抑制作用可能是通过对NF-κB的负调控而实现。
