电视胸腔镜外科手术治疗对纵隔肿瘤患者致痛因子及并发症的影响研究
2018-12-17吕建发李学刚陈灯杰陈智杰宋艾红
吕建发,李学刚,陈灯杰,陈智杰,宋艾红
汉川市人民医院胸外科,湖北 汉川431600
纵隔肿瘤(mediastinal tumor,MT)是下至膈肌,上达颈部的胸腔常见肿瘤,常易压迫邻近器官,甚至继发感染或恶变[1]。手术是治疗MT的主要治疗方法。临床资料显示,除恶性MT及手术禁忌证患者外,其他原发性MT均可行手术治疗[2]。传统术式创伤大,术后疼痛严重,影响患者的生活质量[3]。作为微创技术,电视胸腔镜外科手术(video-assisted thoracic surgery,VATS)创伤小,术后疼痛轻,有利于术后转归[4]。本研究分析了86例接受VATS治疗的MT患者的疗效及VATS治疗对致痛因子的影响。现报道如下。
1 对象与方法
1.1 研究对象
选取2013年11月至2016年10月汉川市人民医院收治的86例MT患者。纳入标准:①经胸部增强CT诊断为MT;②病灶边界清晰,包膜完整,未侵犯周围脏器;③心、肺、肝等功能正常;④无放化疗史;⑤对本研究知情同意。排除标准:①哑铃型椎管内病灶;②有胸腔手术史;③有麻醉及手术禁忌证;④有免疫系统疾病病史。纳入的86例MT患者中,男55例,女31例;年龄为46~72岁,平均年龄为(55.44±5.68)岁;病程为1~6年,平均病程为(2.52±0.31)年;体重指数(body mass index,BMI)为21.45~25.86 kg/m2,平均BMI为(22.65±2.33)kg/m2;病变位置:前纵隔58例,中纵隔16例,后纵隔12例;病灶直径为4.40~7.80 cm,平均直径为(4.57±0.45)cm;病理类型:囊肿41例,神经源性肿瘤32例,胸腺瘤9例,畸胎瘤4例;合并症:高血压30例,糖尿病28例,高脂血症19例。依据随机数字表法将86例MT患者分为VATS组43例与开胸组43例。两组患者的性别、年龄等基线资料比较,差异均无统计学意义(P>0.05)(表1)。本研究经汉川市人民医院伦理委员会批准。
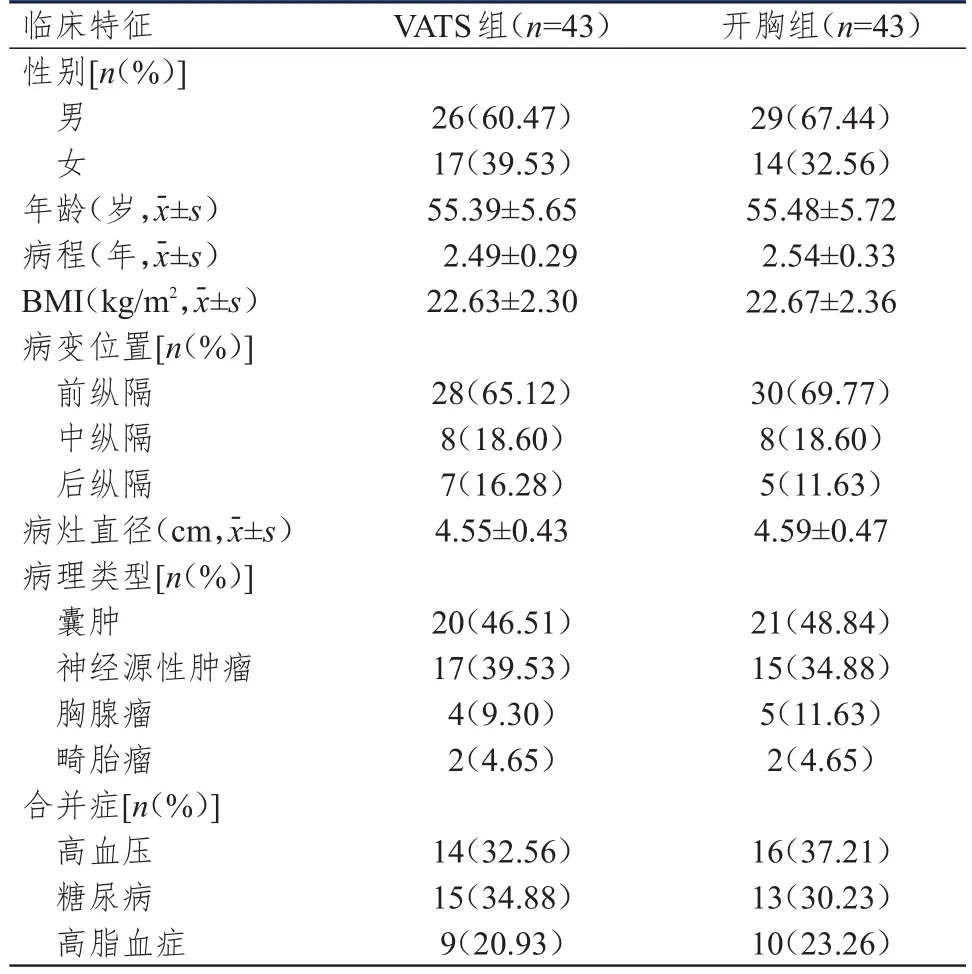
表1 两组患者的基线资料
1.2 手术方法
VATS组患者行VATS。患者取健侧卧位,全麻,前纵隔MT患者适当抬高患侧上肢30°~45°。取患侧腋前线第5肋间做一长约1.0 cm的切口作为观察孔,置入电视胸腔镜,详细观察病灶及其与周围组织的关系,然后按照病灶情况做主、副操作孔。依次打开病灶表面的纵隔胸膜及病灶包膜,以抓取钳牵拉病灶,从包膜内剥离病灶,游离并切除囊壁,用丝线结扎主要供血血管、病灶蒂部及相连神经节,并以钛夹钳封闭,然后将其切断。如病灶严重粘连周围组织或病灶体积较大,镜下难以操作,则在电视胸腔镜下小切口切除:选择距病灶近的套管口,延长切口,然后在电视胸腔镜下切除病灶,并留置引流管。
开胸组患者行开胸手术。于胸椎棘突与肩胛骨内侧缘中点位置切开长约25 cm的切口,逐层切开后经肋间入胸,将病灶切除后留置引流管。
1.3 观察指标
观察两组患者术前及术后第1天外周血脑内神经肽 Y(neuropeptide Y,NPY)、前列腺素 E2(prostaglandin E2,PGE2)、缓 激 肽(bradykinin,BK)、5-羟色胺(5-hydroxytryptamine,5-HT)等致痛因子水平,外周血一氧化氮(nitric oxide,NO)、白细胞介素-6(interleukin-6,IL-6)、白细胞介素-β(interleukin-β,IL-β)等疼痛应激指标水平;术后第1、2天疼痛评分;术后并发症的发生情况等。采用酶联免疫吸附试验(enzyme-linked immunoadsordent assay,ELISA)检测 NPY、PGE2、BK、5-HT、IL-6、IL-β水平,采用硝酸还原酶法检测NO水平,采用视觉模拟评分法[5]评估术后疼痛。
1.4 统计学方法
采用SPSS 19.0统计软件分析数据。计量资料以均数±标准差(±s)表示,组内比较采用配对t检验,组间比较采用独立样本t检验;计数资料以例数和率(%)表示,采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 致痛因子水平的比较
术前,两组患者的NPY、PGE2、BK、5-HT水平比较,差异均无统计学意义(P>0.05)。术后第1天,两组患者的NPY、PGE2、BK、5-HT水平均高于本组术前,差异均有统计学意义(P<0.05);术后第1天,VATS组患者的NPY、PGE2、BK、5-HT水平均明显低于开胸组,差异均有统计学意义(P<0.01)。(表 2)
2.2 疼痛应激指标水平的比较
术前,两组患者的NO、IL-6、IL-β水平比较,差异均无统计学意义(P>0.05)。术后第1天,两组患者的NO、IL-6、IL-β水平均高于本组术前,差异均有统计学意义(P<0.05);术后第1天,VATS组患者的NO、IL-6、IL-β水平均明显低于开胸组,差异均有统计学意义(P<0.01)。(表3)
表2 两组患者手术前后的致痛因子水平比较(±s)
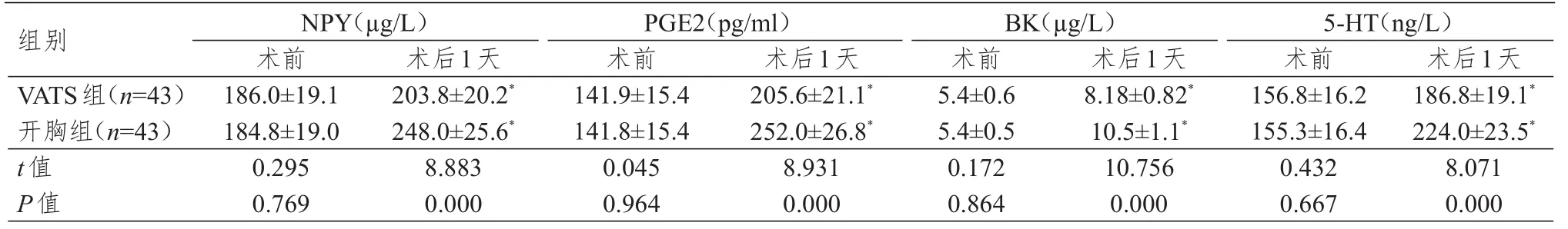
表2 两组患者手术前后的致痛因子水平比较(±s)
注:*与本组术前比较,P<0.05
组别V A T S组(n=4 3)开胸组(n=4 3)t值P值1 8 6.0±1 9.1 1 8 4.8±1 9.0 0.2 9 5 0.7 6 9 2 0 3.8±2 0.2*2 4 8.0±2 5.6*8.8 8 3 0.0 0 0 1 4 1.9±1 5.4 1 4 1.8±1 5.4 0.0 4 5 0.9 6 4 2 0 5.6±2 1.1*2 5 2.0±2 6.8*8.9 3 1 0.0 0 0 5.4±0.6 5.4±0.5 0.1 7 2 0.8 6 4 8.1 8±0.8 2*1 0.5±1.1*1 0.7 5 6 0.0 0 0 1 5 6.8±1 6.2 1 5 5.3±1 6.4 0.4 3 2 0.6 6 7 1 8 6.8±1 9.1*2 2 4.0±2 3.5*8.0 7 1 0.0 0 0 N P Y(µg/L)术前术后1天P G E 2(p g/m l)术前术后1天B K(µg/L)术前术后1天5-H T(n g/L)术前术后1天
表3 两组患者手术前后的疼痛应激指标水平比较(±s)
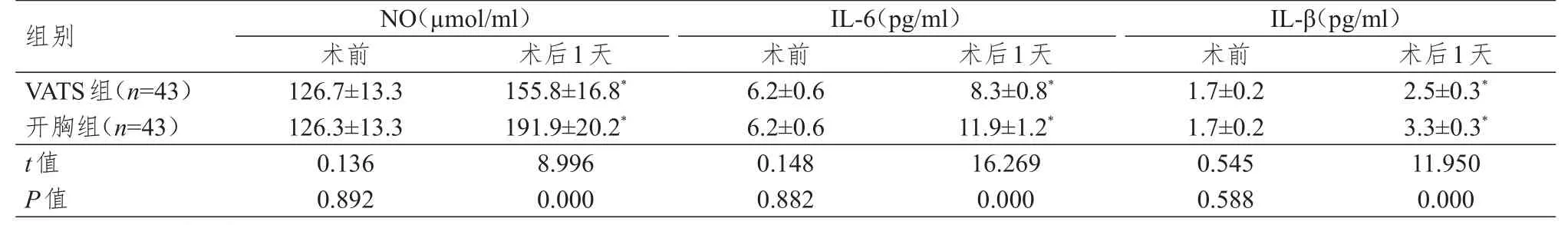
表3 两组患者手术前后的疼痛应激指标水平比较(±s)
注:*与本组术前比较,P<0.05
组别V A T S组(n=4 3)开胸组(n=4 3)t值P值1 2 6.7±1 3.3 1 2 6.3±1 3.3 0.1 3 6 0.8 9 2 1 5 5.8±1 6.8*1 9 1.9±2 0.2*8.9 9 6 0.0 0 0 6.2±0.6 6.2±0.6 0.1 4 8 0.8 8 2 8.3±0.8*1 1.9±1.2*1 6.2 6 9 0.0 0 0 1.7±0.2 1.7±0.2 0.5 4 5 0.5 8 8 2.5±0.3*3.3±0.3*1 1.9 5 0 0.0 0 0 N O(µm o l/m l)术前术后1天IL-6(p g/m l)术前术后1天IL-β(p g/m l)术前术后1天
2.3 术后第 1、2天疼痛评分的比较
VATS组患者术后第1、2天疼痛评分均明显低于开胸组,差异均有统计学意义(P<0.01);两组患者术后第2天疼痛评分均低于本组术后第1天,差异均有统计学意义(P<0.05)。(表4)
表4 两组患者术后第 1、2天疼痛评分比较(±s)
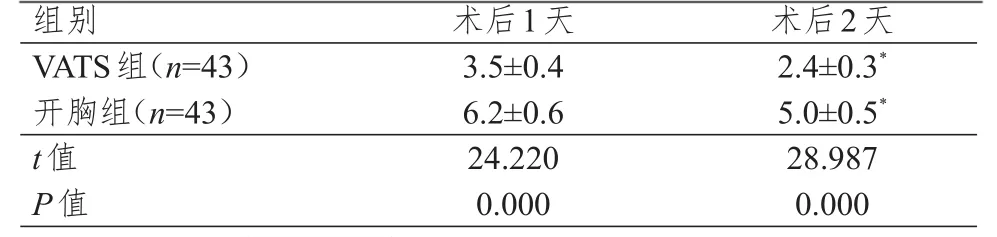
表4 两组患者术后第 1、2天疼痛评分比较(±s)
注:*与本组术后第1天比较,P<0.05
组别V A T S组(n=4 3)开胸组(n=4 3)t值P值3.5±0.4 6.2±0.6 2 4.2 2 0 0.0 0 0 2.4±0.3*5.0±0.5*2 8.9 8 7 0.0 0 0术后1天术后2天
2.4 术后并发症的发生情况的比较
VATS组患者术后并发症的发生率为4.7%(2/43),明显低于开胸组的25.6%(11/43),差异有统计学意义(t=7.255,P=0.007)。(表5)

表5 两组患者术后并发症的发生情况[ n(%)]
3 讨论
纵隔不但解剖结构比较复杂,涉及多种组织及器官,且来源不一,肿瘤类型非常多[6]。既往MT患者的治疗常根据病灶位置选择开胸手术治疗,尽管该术式暴露良好,便于操作,但创伤大,疼痛严重,术后并发症多,尤其是胸骨正中切开,不但使胸骨及胸廓的完整性遭到破坏,还易导致胸骨畸形,且术后康复缓慢[7]。随着微创技术的快速发展,VATS已成为治疗原发性MT主流术式。资料显示,VATS治疗原发性MT,可以获得与开胸手术治疗相同的疗效,且疼痛轻,恢复快,较少发生并发症,有利于患者术后康复[8]。
手术创伤可以促进炎性因子生成,IL-6、IL-β等炎性因子可以经G蛋白偶联受体提高磷脂酶A2的活性,促进生成前列腺素和花生四烯酸等物质[9]。PGE2是手术创伤产生的重要的致痛因子,PGE2不仅可以直接对周围伤害性感受器发生作用,还可以促进痛觉在脊髓中的传递[10]。研究证明,PGE2生理活性极强,可以诱发炎性反应,增加局部毛细血管的通透性,导致局部肿胀疼痛[11];可以直接引发疼痛或者提高神经根的敏感性,降低神经根痛阈,增加痛感[12];可以导致组织水肿、血管痉挛和血小板释放,促进生成并释放5-HT[13]。在疼痛调节上,5-HT具有双重性,在中枢内5-HT具有镇痛作用,在外周则具有致痛作用。在外周,5-HT可以经过激活肾上腺素β受体,促进释放前列腺素,兴奋交感神经感受器,提高胺类物质水平,导致疼痛[14];可以与儿茶酚氧位甲基转移酶活性位点竞争性结合,抑制其活性,并经肾上腺素β受体提高疼痛的敏感性[15];可以导致组织水肿、血管痉挛和血小板释放,对伤害性感受器产生直接或间接刺激,产生疼痛或者痛觉过敏[16]。BK包括两个受体亚型,其中B1受体亚型可以直接参与炎性痛觉过敏,并促进产生持续性疼痛;B2受体亚型可以直接提高伤害性感受器的兴奋性,产生疼痛[17]。BK可以提高神经细胞周围非神经细胞内β2受体活性,并通过二酰甘油途径促进花生四烯酸生成前列腺素,从而提高初级感觉神经兴奋性,促进伤害性神经冲动传导[18]。NPY可以通过影响突触后膜的Ca2+,促进细胞膜去极化或者通过肾素-血管紧张素系统促进血管收缩,特别是对小血管具有较强的作用,可以引发小血管强烈痉挛,导致疼痛[19];可以促进肥大细胞生成5-HT,导致疼痛及痛觉过敏[20]。NO可以直接作用于伤害性感受器,推动高阈值痛觉向低阈值痛觉转化,导致痛觉过敏[21]。在本研究中,VATS组患者术后第1天致痛因子等观察指标水平均优于开胸组,提示与开胸手术比较,VATS治疗MT更具优势。
综上所述,VATS可以有效地切除MT,减小创伤,避免生成大量的炎性因子及致痛因子,有效地避免了强烈、刺激性疼痛的发生,可以减少患者痛苦,促进患者康复。
