鲜活细点圆趾蟹中组胺菌的分离鉴定与生长特性
2018-12-12辉陈洁何志勇张爽曾茂茂
余 辉陈 洁何志勇张 爽曾茂茂
YU Hui1,2 CHEN Jie1 HE Zhi-yong1 ZHANG Shuang1 ZENG Mao-mao1
(1. 江南大学食品科学与技术国家重点实验室,江苏 无锡 214122;2. 浙江海洋大学食品与医药学院,浙江 舟山 316022)
(1. State Key Laboratory of Food Science and Technology, Jiangnan University, Wuxi, Jiangsu 214122, China; 2. School of Food and Pharmacy, Zhejiang Ocean University, Zhoushan, Zhejiang 316022, China)
组胺是一种低分子量的碱性杂环伯胺,可天然存在于一些海产鱼类中,是导致食物中毒的致病物。国内外由鱼类中的组胺导致的中毒事件时有发生,如鲭科鱼类的金枪鱼、鲭鱼、鲣鱼和秋刀鱼中毒事件以及非鲭科鱼类的鯕鳅、青鱼、鲱鱼和沙丁鱼中毒事件[1-2]。另外,发酵肉制品、豆豉、酒等发酵食品组胺中毒也偶有发生[3-4]。组胺中毒症状严重程度与摄入组胺的量有关,当摄入8~40,40~100,100 mg/kg以上组胺时,可分别出现轻度、中度和重度中毒症状[5]。因此,组胺作为海产鱼类的重要质量指标已被广泛认同[6-7]。
食品中的组胺主要是由组胺菌(主要为细菌)分泌的胞外组胺酸脱羧酶催化鱼体中的游离组氨酸发生脱羧反应所产生。目前已从鱼及其制品中筛选出大量的组胺菌,主要为肠杆菌科细菌,其中Enterobacteriaaerogenes、Kelbsiellapneumoniae、Morganellamorganii和Hafniaalvei经常出现于组胺中毒的海产鱼中[1-2]。另外,从腌制虾和贝类[8-9]、奶酪[10]、豆豉[11]、香肠[12]以及酒[13]中也筛选出许多组胺菌。研究[14]显示,冻藏/冷藏可有效控制食品的组胺超标,但由于组胺酸脱羧酶具有较强的稳定性,一旦解冻其活性可快速恢复而催化产生组胺。因此,避免组胺菌的污染以及控制其产胺是防止食品中组胺生成与超标的主要途径。
细点园趾蟹(Ovalipespunctatus)俗称沙蟹、牛脚蹄,分布于中国的黄海、东海和南海,盛产于东海与黄海。随着渔业资源的衰退,低值细点圆趾蟹成为了主要渔获物,年捕捞量高达2.0×105t以上。细点圆趾蟹被加工成蟹肉罐头、冷冻蟹肉糜等,产品远销日本、韩国、东南亚、美国和欧盟。目前,关于蟹类中组胺的研究相对较少,仅有远海梭子蟹(Portunuspelagicus)和中华绒螯蟹(Eriocheirsinensis)低温保藏中产生组胺的报道[15-16]。迄今为止,尽管很少有蟹及其产品的组胺中毒事件的报道,但关于蟹类过敏的报道却有很多,而轻度组胺中毒与IgE介导的过敏症状很相似,因此可能被误诊为蟹类过敏[17]。由于细点园趾蟹捕捞后不易存活,且具有高蛋白以及高游离组氨酸含量等特性[18],使得其更易受到微生物污染,一旦被组胺菌污染,现有生产加工与储运条件下极有可能会导致组胺超标。然而,有关蟹类中组胺菌的研究迄今未见报道。因此,本试验拟从活细点圆趾蟹的腮条和肠中分离鉴定出组胺菌,并进一步探讨培养条件对其生长与产组胺能力的影响,同时考察壳低聚糖对细点圆趾蟹中组胺菌的抑菌效果,以期为细点圆趾蟹的生产加工与贮藏提供参考。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
活细点圆趾蟹:购于沈家门水产码头,装于有碎冰的泡沫箱中,2 h内完成试验;
组胺标准品(≥99.5%)、丹磺酰氯(≥98%)、乙腈:HPLC纯,美国Sigma-Aldrich公司;
壳低聚糖(Chitosan oligosaccharides,COS):GPC测其分子量<10 kDa,实验室自制;
其他试剂:分析纯,国药集团化学试剂有限公司;
胰酪胨大豆琼脂培养基(TSA)、胰酪胨大豆肉汤培养基(TSB):杭州微生物试剂有限公司;
TSBH培养基:3%胰酪胨大豆肉汤培养基、1%L-组氨酸磷酸盐和 0.005%磷酸吡哆醛,用于组胺菌的富集和疑似组胺菌的确认与产组胺能力分析;
HBI(Histamine-forming bacteria isolation agar)培养基:5 g胰蛋白胨、5 g酵母提取物、2 gL-组氨酸磷酸盐、1 g碳酸钙、5 g氯化钠、0.06 g溴甲酚紫、20 g琼脂,溶于1 L去离子水,调pH至5.2~5.3,用于组胺菌的初筛与纯化。
1.1.2 主要仪器设备
生化培养箱:SPX-250B-Z型,上海博讯实业有限公司医疗设备厂;
高效液相色谱仪:Alliance e2695型,美国Waters公司;
扫描电子显微镜:HITACH S-3400N型,日本Hitachi公司;
PCR热循环仪:Applied Biosystems®VeritiTM96-Well型,美国Thermo Fisher公司。
1.2 方法
1.2.1 组胺菌的初步筛选 对鲜活细点圆趾蟹的腮条和肠进行无菌取样、研磨。15 g样品装入盛有100 mL TSBH的三角瓶中。30 ℃富集培养72 h后,用无菌生理盐水依次稀释成10-1,10-2,10-3,取1 mL TSBH培养基或稀释液,采用稀释混合平板法制成含菌HBI培养基平板,30 ℃培养72 h,培养期间根据菌落形态特征挑取蓝色或紫色菌落或有紫色晕环的菌落,于HBI培养基上传代培养,直至分离出单菌落,取单菌落于TSA斜面中保存,此为疑似组胺菌。
1.2.2 组胺菌的确认与产组胺能力分析 挑取活化的疑似组胺菌,用无菌生理盐水稀释成5.0 lg CFU/mL菌悬液,吸1 mL菌悬液于9 mL TSBH培养基中,30 ℃培养24 h后,再吸1 mL 上述24 h培养液于9 mL 新鲜TSBH培养基中,30 ℃ 培养48 h后,TSBH培养基于12 000×g离心10 min,对上清液中的组胺进行分析。按照Lieberd等[19]的TLC方法分析上清液中的组胺,确认疑似菌株是否为组胺菌;按照Yu等[20]的HPLC方法测定上清液中的组胺含量,确定组胺菌的产组胺能力。
1.2.3 菌株鉴定
(1) 形态观察:组胺菌在TSA平板培养12 h,参照Tholozan等[21]方法对其细胞形态进行观察;培养18 h,挑取菌落,进行革兰氏染色,油镜下观察其染色情况;培养48 h后,采用低倍镜对其菌落形态进行观察。
(2) 分子鉴定:参照Kim等[22]的方法进行鉴定。
1.2.4 培养条件对组胺菌的生长与组胺生成量的影响 吸1.2.2中5.0 lg CFU/mL菌悬液1 mL,接种于9 mL 新鲜TSBH培养基中,培养条件为:温度30 ℃、NaCl含量0.5%、初始pH 7.0,其中单因素温度设定为4,15,25,30,35 ℃、初始pH值设定为4,5,6,7,8,9,10,NaCl含量设定为0.5%,1.0%,3.0%,5.0%,10.0%,15.0%,静置培养48 h。待培养结束后,菌落总数采用平板涂布法制成含菌TSA平板,30 ℃培养48 h后进行菌落计数;组胺含量按1.2.2中HPLC方法测定。
1.2.5 抑菌试验 取7.0 lg CFU/mL组胺菌悬液1 mL,采用稀释混合平板法制成含菌TSA平板(培养基pH为6.0和7.0)。用无菌打孔器在平板上打孔,挑出培养基圆饼以做成圆孔。以无菌生理盐水为阴性对照,0.5 mg/mL头孢克肟生理盐水溶液为阳性对照,0.1,0.5,1.0 g/100 mL壳低聚糖生理盐水溶液为抑菌剂。分别向孔中加入80 μL上述5种溶液,做3个平行平板,30 ℃培养48 h。采用十字交叉法,用游标卡尺测量抑菌圈直径,取平均值。按式(1)计算壳低聚糖对组胺菌生长的抑菌率。
(1)
式中:
c——抑菌率,%;
d1——阳性对照抑菌圈直径,mm;
d2——壳低聚糖抑菌圈直径,mm。
1.2.6 统计分析 结果以(平均值±标准偏差)表示,采用SPSS 19.0软件对其进行独立样本T-test检验,显著水平为P<0.05。
2 结果与分析
2.1 组胺菌的筛选
根据组胺呈碱性的原理利用HBI培养基对组胺菌进行初步筛选,但由于一些微生物可利用HBI选择性培养基中的酵母提取物和蛋白胨代谢产生其他碱性物质[23],因而本方法所筛选的菌株为疑似组胺菌。从腮条和肠中各获得3株不同菌落形态的疑似组胺菌株(表1),其在HBI培养基上呈现蓝色菌落或蓝紫色晕环(图1)。疑似组胺菌均为富集培养基直接涂布于HBI培养基所出现的菌株,而稀释液在HBI培养基却未出现疑似组胺菌,表明鲜活细点圆趾蟹中疑似组胺菌较少。另外,疑似组胺菌均为培养12~24 h就产生蓝紫色晕环,在培养36 h后整个平板变成紫色[图1(c)],而Niven等[24]报道35 ℃培养36~72 h才有蓝紫色晕环出现,但并未对组胺进行定量;Rodriguez-Jerez等[25]报道芽孢杆菌属组胺菌(Bacillusspp.)在37 ℃培养48 h才能被检测出,其组胺生成量为10.54 mg/L。本研究结果与文献的差异可能是筛选出的疑似组胺菌的产组胺或其他碱性物质的能力较高,产生的组胺或碱性物质较多。

表1 6株疑似组胺菌的菌落与细胞形态

图1 部分初筛与纯化HBI平板
对获得的6株疑似组胺菌TSBH培养基中的组胺进行TLC分析,结果见图2。从图2中可以看出,仅OP-G2菌株培养基与标样有红色迁移斑点出现,而其他菌株培养基均无红色迁移斑点出现,而且OP-G2菌株的Rf值为0.795,组胺标样的Rf值为0.796,因此OP-G2菌株可被确认为组胺菌。

1. OP-G1 2. OP-G2 3. OP-G3 C. 空白对照 S. 组胺标样4. OP-I1 5. OP-I2 6. OP-I3
2.2 OP-G2菌株鉴定
2.2.1 形态观察 OP-G2菌株在营养琼脂固体培养基上培养48 h后,菌落为乳黄色圆形、边缘整齐,外部菌落透明、表面湿润有光泽,直径为1.1 mm左右[图3(a)],菌体黏稠不易挑起,后期菌落边缘不整齐,表面有皱褶。OP-G2菌株革兰氏染色呈阴性,单个细胞呈杆状,两端钝圆,单个或成堆排列[图3(b)],扫描电镜显示单个菌体呈短杆状,大小为0.8~1.0 μm×1.2~1.8 μm,见图3(c),其特征与肠杆菌属的形态特征基本相似。
2.2.2 OP-G2菌株分子鉴定 OP-G2菌株16S rDNA PCR扩增结果见图4,得到序列总长1 393 bp。将上述序列在EzBioCloud网站上(http://eztaxon-e.ezbiocloud.net/)进行序列相似性比对,选择相似度最高的10株菌株的16S rDNA序列,利用Mega 6.0软件进行多序列比对并采用邻接法(Neighbor-joining)构建系统发育进化树(图5),OP-G2菌株与EnterobacteraerogenesKCTC 2190(T)菌株在同一分支上,且16S rDNA序列相似性达到95%。因此,该菌株被定名为EnterobacteraerogenesOP-G2(简称E.aerogenesOP-G2)。

图4 OP-G2菌株16S rDNA PCR扩增产物电泳图

图5 基于16S rDNA序列同源性的OP-G2菌株系统发育树
2.3 产组胺能力分析
为确定E.aerogenesOP-G2菌株产组胺能力,利用HPLC对其TSBH培养基中组胺含量进行测定,结果见图6。从图6可以看出,该菌株培养基的HPLC色谱图在18.095 min出峰,与组胺标准品的出峰时间相吻合,进一步表明E.aerogenesOP-G2菌株为组胺菌,定量结果表明组胺含量为(46.96±1.94) mg/L。肠杆菌科组胺菌可分为两类[26],一类在15 ℃以上培养24 h,可产生1 000 mg/L以上组胺的细菌为高产组胺菌;一类在30 ℃及以上培养48 h,可产生250 mg/L 以下组胺含量的细菌为低产组胺菌。因此,本试验所筛选的菌株为低产组胺菌。目前,从组胺中毒的食品中分离出的产气肠杆菌属组胺菌,既有高产E.aerogenes组胺菌[27],也有低产E.aerogenes组胺菌[28-29]。因此,需要进一步对E.aerogenesOP-G2菌株的生长与产组胺特性进行研究。
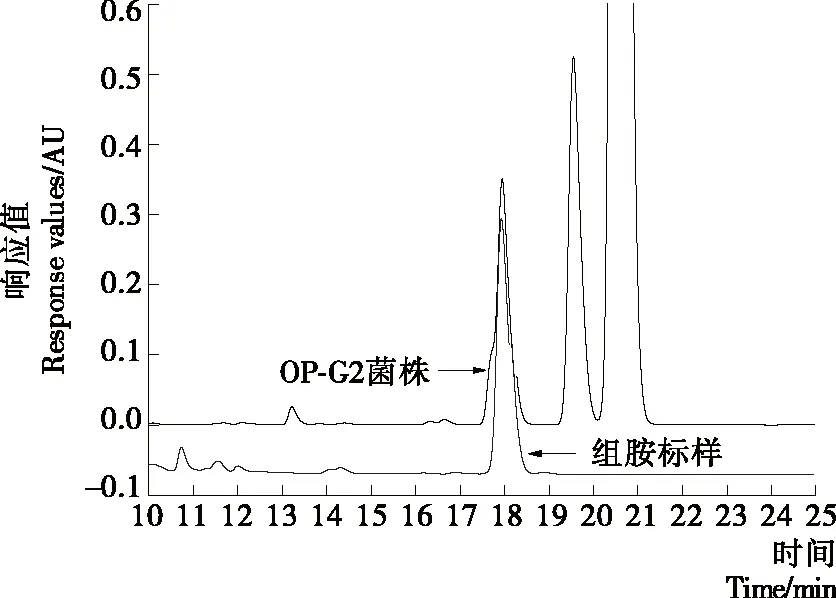
图6 E. aerogenes OP-G2菌株TSBH培养基中组胺的HPLC色谱图
Figure 6 HPLC chromatogram of histamine in TSBH medium inoculated withE.aerogenesOP-G2 strain
2.4 培养条件的影响
考察了不同培养温度、初始pH值和NaCl含量对E.aerogenesOP-G2菌株的生物量与组胺生成量的影响,结果见图7。由图7(a)可知,该菌株30 ℃时菌落总数和组胺生成量均达到最高,分别为(9.55±0.45) lg CFU/mL和(46.78±2.13) mg/L。在4~30 ℃时,随着温度的升高,菌落总数和组胺生成量均增大,与Rodtong等[30]的结果相一致。尽管4 ℃下该菌株生长繁殖被抑制[(3.95±0.48) lg CFU/mL],但其培养基中仍有少量组胺生成(3.46 mg/L),可能是E.aerogenes组氨酸脱羧酶在4 ℃下仍能保持活性[31],即细菌代谢所分泌的少量胞外组氨酸脱羧酶仍能催化游离组氨酸转化为组胺。另外,相比于30 ℃,4 ℃对菌株组胺生成量的抑制率高达92.60%。
由图7(b)可看出,初始pH 7.0时菌落总数最大,即(9.55±0.58) lg CFU/mL。当初始pH≤5.0或≥9.0时菌落总数均显著降低(P<0.05)。与菌落总数不同,菌株的组胺生成量却在初始pH 6.0时最大,即(53.28±1.79) mg/L。当初始pH≤5.0或≥8.0时其组胺生成量均显著降低(P<0.05),而pH 9.0和10.0比pH 4.0更能显著降低菌株的组胺生成量(P<0.05),且相比于pH 6.0,pH 10.0对该菌株的组胺生成量的抑制率达到79.81%。可能是在微酸性条件下,组胺菌快速分泌组氨酸脱羧酶催化游离组氨酸脱羧生成组胺,促使培养基中pH值达到适宜生长条件[32];也可能是该菌株组氨酸脱羧酶最适pH值为弱酸性,如Rodtong等[30]报道的E.aerogenes组胺菌在pH 5.0时组胺生产量最高,而Zou等[31]报道E.aerogenesDL-1组胺菌组氨酸脱羧酶的最适pH为6.5,亦为弱酸性。
图7(c)显示,0.5%~3.0% NaCl对菌株的菌落总数和组胺生成量均无显著影响(P>0.05),且NaCl含量1.0%时,菌落总数和组胺生成量均最高,分别为(10.33±0.54) lg CFU/mL 和(50.68±1.63) mg/L,与Wendakoon等[32]报道的一致,表明低盐促进组胺菌的生长与产组胺能力[33]。当NaCl含量提高到5.0%时,菌株的菌落总数和组胺生成量均显著降低(P<0.05),NaCl含量≥10%时,菌株生长繁殖和组胺生成能力几乎被抑制;相比于NaCl含量1.0%,NaCl含量≥10%时对菌株组胺生成量的抑制率高达98.95%以上。综上所述,低温(<4℃)和/或高NaCl含量(≥10%)能有效控制E.aerogenesOP-G2的生长和组胺生成量。

不同小写字母表示差异性显著(P<0.05)
图7 温度、初始pH值和NaCl含量对E.aerogenesOP-G2菌株生长与组胺生成量的影响
Figure 7 Effect of the temperature, initial pH and NaCl content on growth and histamine production of strainE.aerogenesOP-G2
2.5 抑菌试验
以头孢克肟为对照,考察了不同浓度的壳低聚糖对E.aerogenesOP-G2组胺菌的抑菌效果,结果见图8。结果表明,随着COS浓度的增大,对E.aerogenesOP-G2菌株的抑菌效果显著增强(P<0.05)。当COS浓度≥0.5 g/100 mL时,对E.aerogenesOP-G2菌株抑制率均在30.58%以上,表明COS对该菌株有较好的抑制效果;pH值对COS的抑菌活性的影响具有显著性差异(P<0.05),且当pH 6.0时,1.0 g/100 mL 浓度COS对E.aerogenesOP-G2菌株抑菌率高达47.57%,可能是酸性条件下COS游离氨基带正电荷,更有利于与带负电荷的菌体结合,干扰菌体代谢通路,从而起到抑菌效果[34]。
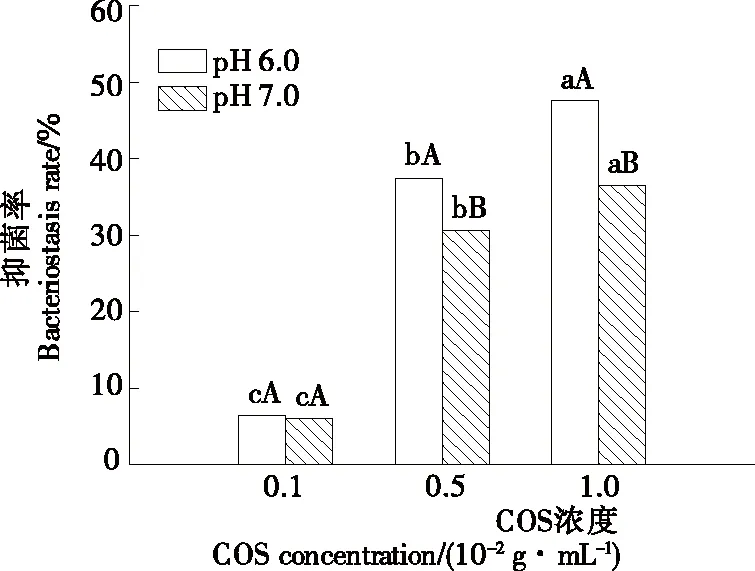
不同小写字母表示同一pH不同COS浓度之间的差异性显著(P<0.05);不同大写字母表示同一浓度不同pH之间的差异性显著(P<0.05)
图8 壳低聚糖对E.aerogenesOP-G2菌株的抑菌率
Figure 8 Bacteriostasis rates of chitosan oligosaccharides to strainE.aerogenesOP-G2
3 结论
本研究从鲜活细点园趾蟹的腮条中分离鉴定出1株组胺菌,经鉴定命名为EnterobacteraerogenesOP-G2,其组胺生成量为(46.96±1.94) mg/L(30 ℃培养48 h)。低温(<4 ℃)和/或高NaCl含量(≥10%)都能有效控制E.aerogenesOP-G2菌株的生长和组胺生成量,且对菌株的组胺生成量的抑制率高达92%以上。当COS浓度≥0.5 g/100 mL时,对E.aerogenesOP-G2菌株抑制率均在30.58%以上,且当pH 6.0时,1.0 g/100 mL浓度的COS对E.aerogenesOP-G2菌株的抑制率高达47.57%。本研究结果可为细点圆趾蟹的加工与保藏提供参考。
本试验采用HBI培养基从细点圆趾蟹中筛选获得1株肠杆菌属组胺菌,后续试验可采用TCBS和PI-CFC培养基联合HBI培养基对细点圆趾蟹中弧菌属和假单胞菌属中组胺菌进行筛选。另外,仅研究了组胺菌在TSBH培养基中的产组胺特性,后续试验可对组胺菌在细点圆趾蟹或蟹肉中的产组胺特性进行研究。
