枸杞提取物中糖的组成分析
2018-12-10周恒斌刘雪蕊张东星李赫宇於洪建晏仁义
周恒斌,刘雪蕊,张东星,李赫宇,於洪建,晏仁义,*
(1.浙江尖峰药业有限公司,浙江金华321000;2.天津益倍元天然产物技术有限公司,天津300457)
枸杞,又名枸杞子、红耳坠,是茄科植物枸杞的成熟果实,其味甘、性平、归肝、肾精,具有益精明目、养阴润肺、补虚益精等功效[1]。枸杞是一种药食同源的物质,营养较为丰富,主要含有枸杞多糖、类胡萝卜素、甜菜碱等功效成分[2-4]。现代研究表明,枸杞多糖具有重要的生理活性,已被证实由阿拉伯糖、半乳糖、甘露糖、葡萄糖、鼠李糖、木糖6种中性糖及半乳糖醛酸等酸性糖组成[5-7],具有免疫调节、神经保护、抗氧化、抗衰老、保肝护肝、调节血脂、降血糖等功效[8-10]。
随着现代人保健意识的增强,枸杞作为药食两用原料市场知名度高、消费量也大。据统计在已批准的15 000余个保健食品中含枸杞或者枸杞多糖的有1 400多个,出现频次位居第一位。以枸杞为核心原料的茶、膏滋、固体饮料类普通食品层出不穷。《中国药典》以枸杞多糖和甜菜碱含量作为指标控制枸杞的质量。关于枸杞多糖提取物没有统一的检测标准[11],目前,一般用苯酚-硫酸法测定多糖或者总糖的含量,由于枸杞本身糖含量较高,黏度较大,生产过程中不易干燥,商家可能会添加糊精类成分,而该方法不能区分是否添加糊精,导致添加糊精越多多糖含量越高,产品质量越差的逆循环。关于糖的定性定量分析,常采用比色法[12]、高效液相色谱法(high performance liquid chromatography,HPLC)[13-14]、气相色谱(gas chromatog raphy,GC)[15]等方法。本研究采用 1-苯基-3-甲基-5-吡唑啉酮(1-phenyl-3-methyl-2-pyrazolin-5-one,PMP)衍生HPLC分析法,比较实验室自制和市售枸杞提取物单糖组成,测定酸性糖含量等。为枸杞提取物的质量分析提供依据。同时,也为枸杞或者其提取物为核心原料的食品和保健食品的质量控制提供了参考。
1 材料与方法
1.1 材料与试剂
枸杞子:产地为宁夏、山东等地(7个样本,编号M1~M7,M7为青枸杞);枸杞提取物:市售;D-葡萄糖、D-半乳糖、L-鼠李糖、D-甘露糖、D-半乳糖醛酸、L-阿拉伯糖、D-木糖、乙腈(色谱纯):国药集团化学试剂有限公司;1-苯基-3-甲基-5-吡唑啉酮(PMP):上海市试剂一厂;浓硫酸、三氯甲烷、氢氧化钠、盐酸、苯酚:均为分析纯;水为天津益倍元天然产物技术有限公司自制超纯水。
1.2 仪器与设备
SHIMDAZU LC-2030 3D高效液相色谱仪(配备二极管阵列检测器):日本岛津公司;752N紫外可见分光光度计:上海仪电分析仪器有限公司;十万分之一分析天平:瑞士Mettler-Toledo公司;TD2 4-WS离心机:湖南湘仪仪器有限公司;DK-98-Ⅱ电热恒温水浴锅:天津特斯特仪器有限公司;DZF-6020真空干燥箱:上海博迅仪器有限公司;Milli-Q超纯水系统:密理博中国有限公司。
1.3 方法
1.3.1 枸杞单糖、多糖的提取
将枸杞子烘干,剪碎,称取10 g枸杞子加入80%的乙醇150 mL回流1 h,趁热过滤,提取3次,合并提取液减压浓缩,置于60℃真空干燥箱中干燥,得到枸杞中的单糖和寡糖部位。将上述滤渣加入150 mL水,加热回流2 h,趁热过滤,减压浓缩,加入4倍体积的乙醇(终浓度80%)醇沉,4℃静置过夜,离心取沉淀,置于60℃真空干燥箱内干燥,得枸杞粗多糖部位[16-18]。
1.3.2 糖组成分析
糖组成分析的步骤包括水解、PMP衍生化、HPLC分析等步骤,参照文献的方法进行试验[19-20]。
1.3.2.1 水解
准确称取烘干后的样品10 mg,加水溶解,配置成浓度为10 mg/mL的溶液(市售枸杞提取物配置成5 mg/mL),吸取 100 μL 溶液于试管中,加入 70 μL 的2.5 mol/L H2SO4,110℃烘箱中水解2 h,取出冷却后,加入 70 μL的5 mol/L的NaOH,漩涡混匀中和(未酸水解的样品不经硫酸处理,取溶液,直接进行衍生化处理)。
1.3.2.2 PMP衍生化
上述水解液加入200 μL 0.5 mol/L PMP甲醇溶液与100 μL 0.3 mol/L NaOH溶液,旋涡混匀,于70℃恒温水浴锅中反应60 min,取出放置10 min冷却置室温,加入 100 μL 0.3 mol/L HCl中和,加入纯水 1 mL,再加氯仿2 mL,重复萃取3次,取水相,过0.22 μm微孔过滤膜,得供试液。
1.3.2.3 HPLC分析
经PMP衍生化处理好的样品,过0.22 μm滤膜,按下述色谱条件进行分析:色谱柱为ODS-3(4.6 mm×250 mm,5 μm),流动相 A 为乙腈,流动相 B为 0.45 g KH2PO4、0.5 mL TEA、100 mL 乙腈、900 mL 高纯水混合液(pH 7.5),梯度洗脱程序为 0~4 min,94%B;4 min~5 min,94%~88%B;5 min~50 min,88%B;流速1 mL/min,柱温30℃,进样体积5μL,检测波长250nm。
1.3.3 多糖含量测定
精确称取干燥至恒重的葡萄糖100 mg于100 mL容量瓶中,配置成1 mg/mL溶液,准确吸取5 mL于50 mL容量瓶中,得0.1mg/mL的葡萄糖标准溶液。分别吸取 0、0.2、0.4、0.5、0.6、0.8 mL 的 0.1 mg/mL 的葡萄糖标准溶液于试管中,用蒸馏水补足1mL,各加入6%的苯酚1.0 mL,再迅速加入5 mL浓硫酸,旋涡混匀,40℃水浴加热30 min,冷却,用分光光度计于490 nm下测定吸光值。枸杞样品分别配置成0.1mg/mL溶液按此法测定糖含量。(市售枸杞提取物先用水溶解,80%乙醇沉淀过夜,收集沉淀,真空干燥后再测定糖含量)[21-22]。
1.3.4 酸性糖含量测定
精密称取100 mg半乳糖醛酸于100 mL容量瓶中,用少量蒸馏水溶解,加入0.5 mL 1 mol/L的NaOH溶液,蒸馏水定容至100 mL,摇匀,配置成浓度为1 mg/mL的半乳糖醛酸溶液。分别吸取1.0、2.0、3.0、4.0、5.0 mL的半乳糖醛酸标准溶液于50 mL容量瓶中,定容,分别配置成浓度为 20、40、60、80、100 mg/L的溶液。各吸取上述溶液1 mL,分别加入0.25 mL咔唑乙醇溶液,产生白色絮状物,不断摇动试管,快速加入浓硫酸5 mL,摇匀。立刻将试管放入85℃水浴锅中水浴20 min,取出后放入冷水中迅速冷却。1.5小时内用分光光度计在525 nm下测定吸光值,以半乳糖醛酸浓度为横坐标,吸光值为纵坐标,绘制标准曲线[23]。
2 结果与分析
2.1 枸杞多糖部位的糖组成分析
实验室自制枸杞多糖均含有L-阿拉伯糖、D-半乳糖、D-葡萄糖、L-鼠李糖、D-甘露糖、D-木糖和D-半乳糖醛酸,其中,成熟枸杞样本M1~M5中L-阿拉伯糖与D-半乳糖所占比例较大;而样本M6(与其他5种红枸杞相比果实较硬,推测成熟度低)和样本M7(青枸杞)中D-半乳糖醛酸所占比例较大,推测可能是未成熟枸杞中的果胶含量较高,随着果实的成熟度增加,果胶会不断分解,故青枸杞中半乳糖醛酸含量高于成熟后的红枸杞。结果见图1~图4。

图1 7种混合标准糖溶液的液相色谱图Fig.1 The HPLC chromatogram of 7 standard sugars

图2 成熟枸杞样本多糖组成液相色谱图Fig.2 The HPLC chromatogram of polysaccharide from mature wolfberry
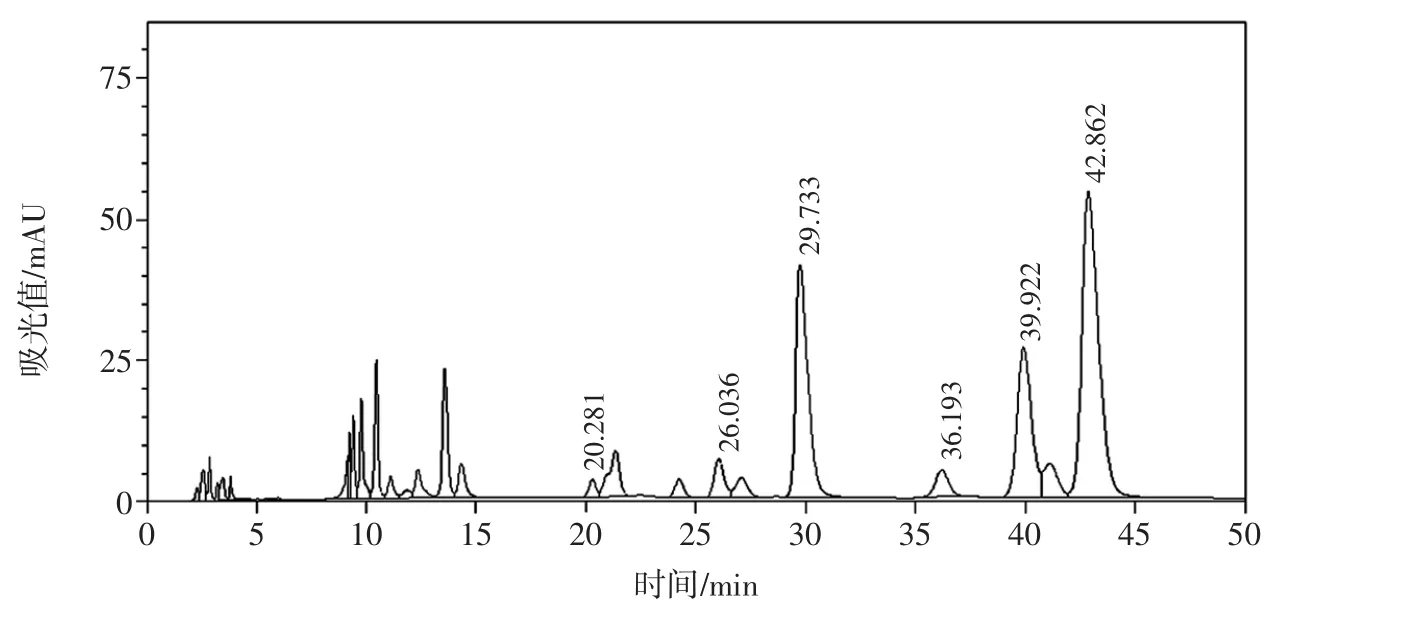
图3 样品M6多糖组成液相色谱图Fig.3 The HPLC chromatogram of polysaccharide from sample M6
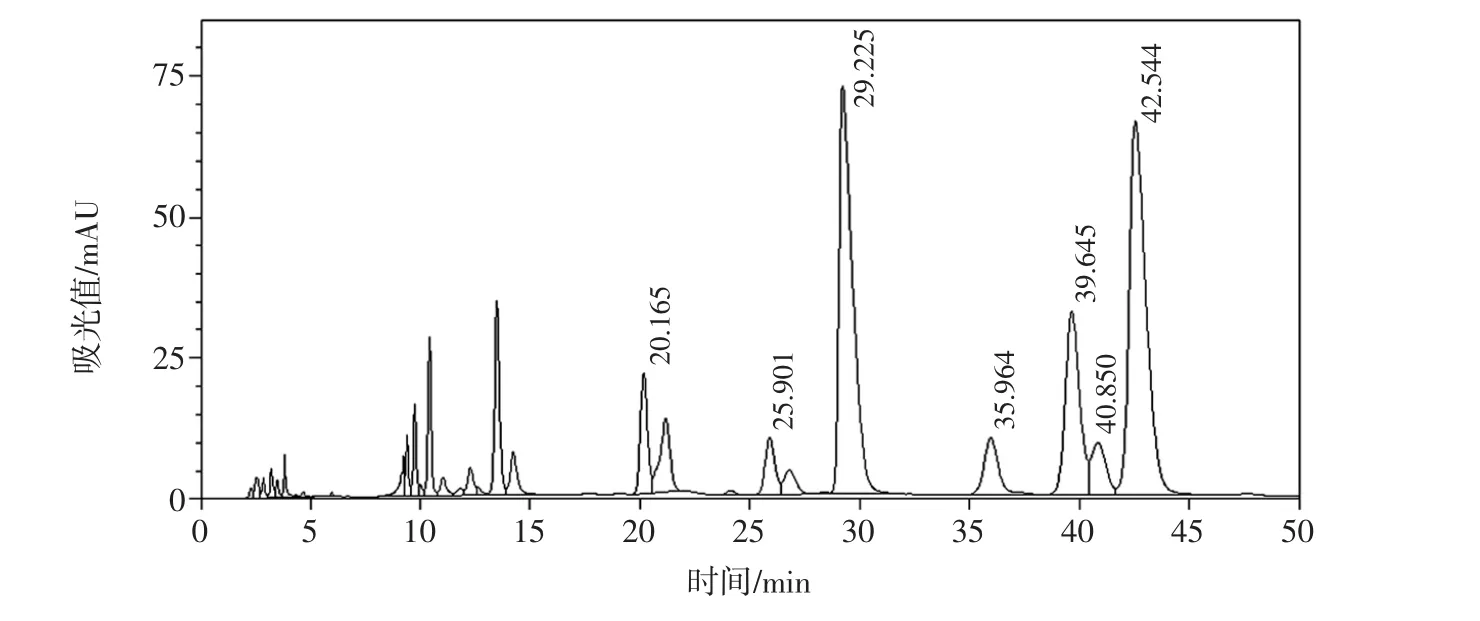
图4 样品M7多糖组成液相色谱图Fig.4 The HPLC chromatogram of polysaccharide from sample M7
2.2 单糖和寡糖部位的糖组成分析
处理方法按1.2.3,每个样品分别按照酸水解后再衍生和不进行酸水解直接衍生处理制作两个样本。成熟的枸杞(M1~M5)游离单糖主要为葡萄糖和甘露糖,两者的比例约为10∶1;水解和不水解相比葡萄糖和甘露糖比例关系基本没变化。未成熟样本(M6和M7)游离单糖主要也为葡萄糖和甘露糖,但是和成熟样本比峰面积小,并且葡萄糖和甘露糖的峰面积之间的比值也小;经酸水解后,葡萄糖的比例显著提高,推测未成熟枸杞中含有较多的寡糖,见图5~图8。
2.3 市售枸杞提取物的分析
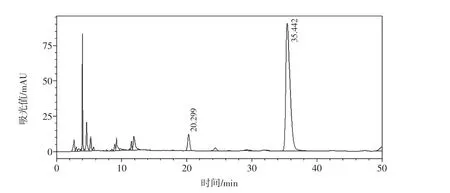
图5 成熟枸杞样品单糖和寡糖部位液相色谱图(未酸水解)Fig.5 The HPLC chromatogram of mono-and oligosaccharides from mature wolfberry(no acid hydrolysis)

图7 未成熟枸杞样品单糖和寡糖部位液相色谱图(未酸水解)Fig.7 The HPLC chromatogram of mono-and oligosaccharides from immature wolfberry(no acid hydrolysis)
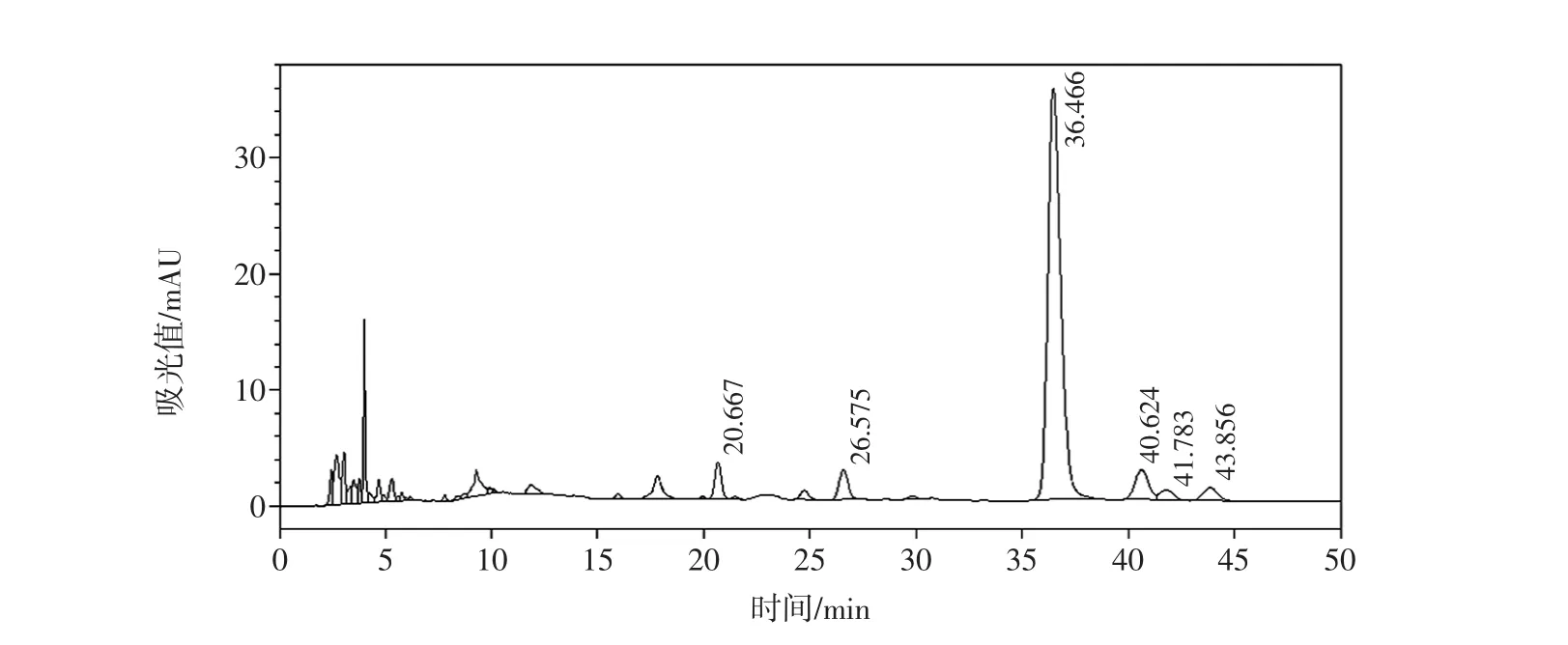
图8 未成熟枸杞样品单糖和寡糖部位液相色谱图(酸水解)Fig.8 The HPLC chromatogram of mono-and oligosaccharides from immature wolfberry(acid hydrolysis)
3份市售枸杞提取物(市售1~市售3)分别酸水解和未酸水解进行糖组成分析,发现两份枸杞提取物酸水解和未酸水解的色谱图和糊精相应图谱基本一致。判断枸杞提取物中添加了大量糊精。另外一份枸杞提取物在未酸水解条件下基没看到糖的色谱峰,而在水解条件下的糖色谱峰和实验室自制枸杞多糖的色谱峰基本一致,因此推测该样本为经过醇沉淀处理过的真枸杞多糖提取物。见图9~图11。
2.4 多糖含量测定结果
采用苯酚-硫酸法,分别测定了10份样本的多糖含量(实验室自制7份样本,市售3份样本),结果见表1。
实验室自制的枸杞多糖的含量(包括成熟枸杞与青枸杞)在32.09%~43.72%之间,而枸杞提取物的含量较高,在95%~98.04%。
2.5 枸杞多糖的酸性糖含量测定
采用咔唑-硫酸法分别测定了10个样本中酸性糖的含量,结果见表1,枸杞多糖中半乳糖醛酸的含量在47.31~57.38%,枸杞多糖是一种酸性杂多糖。M6和M7酸性多糖的含量稍微偏高,与HPLC分析中半乳糖醛酸峰面积较大结果一致。
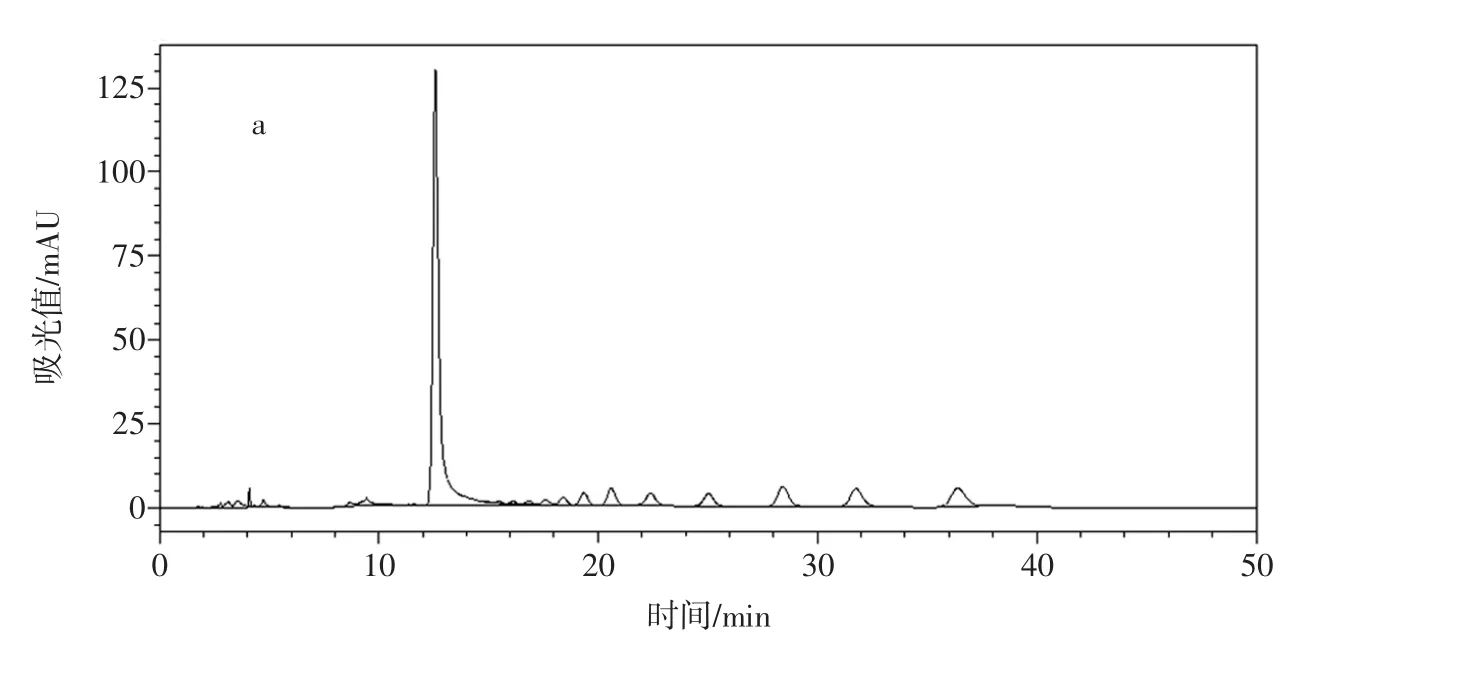
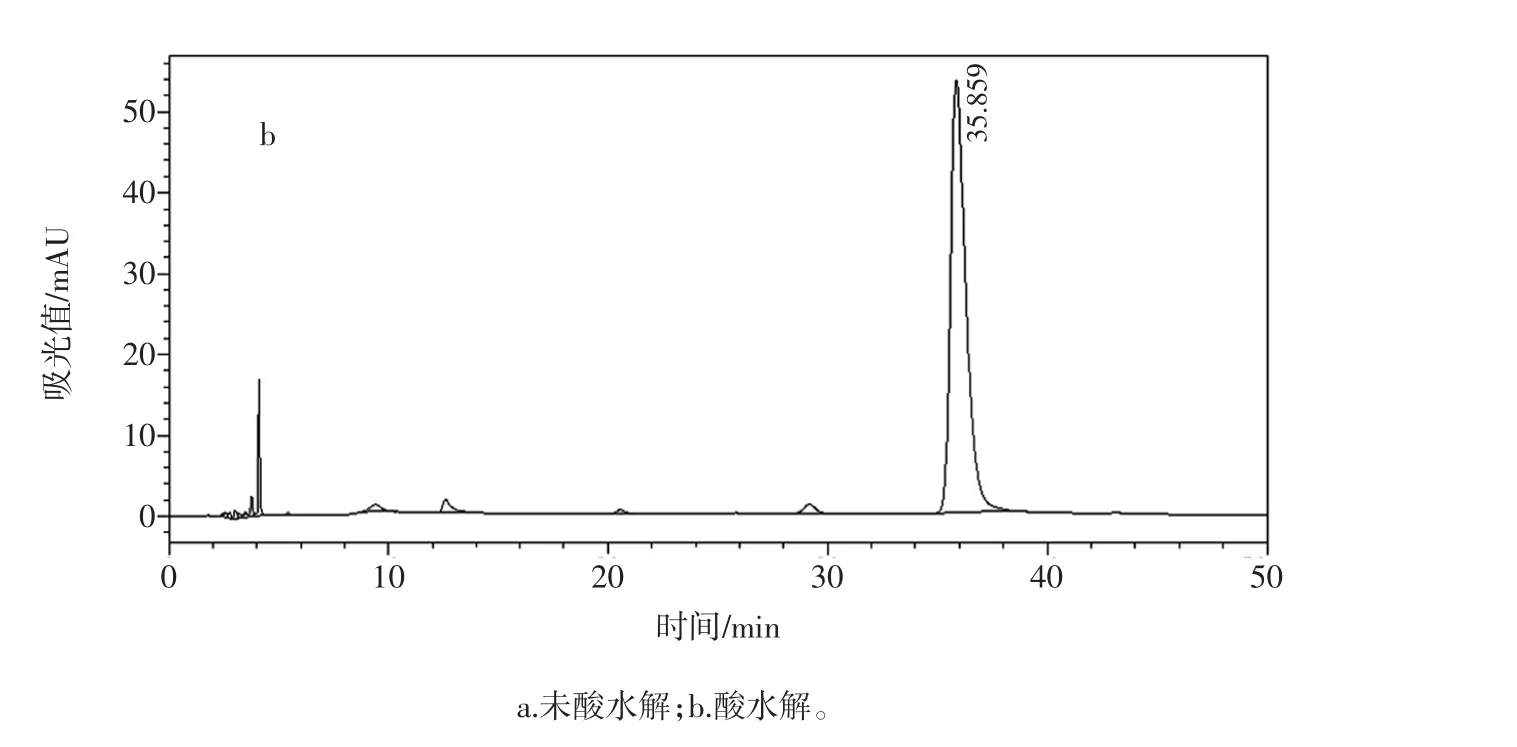
图9 枸杞提取物(市售1)的液相色谱图Fig.9 The HPLC chromatogram of wolfberry polysaccharide extract(commercial sample 1)
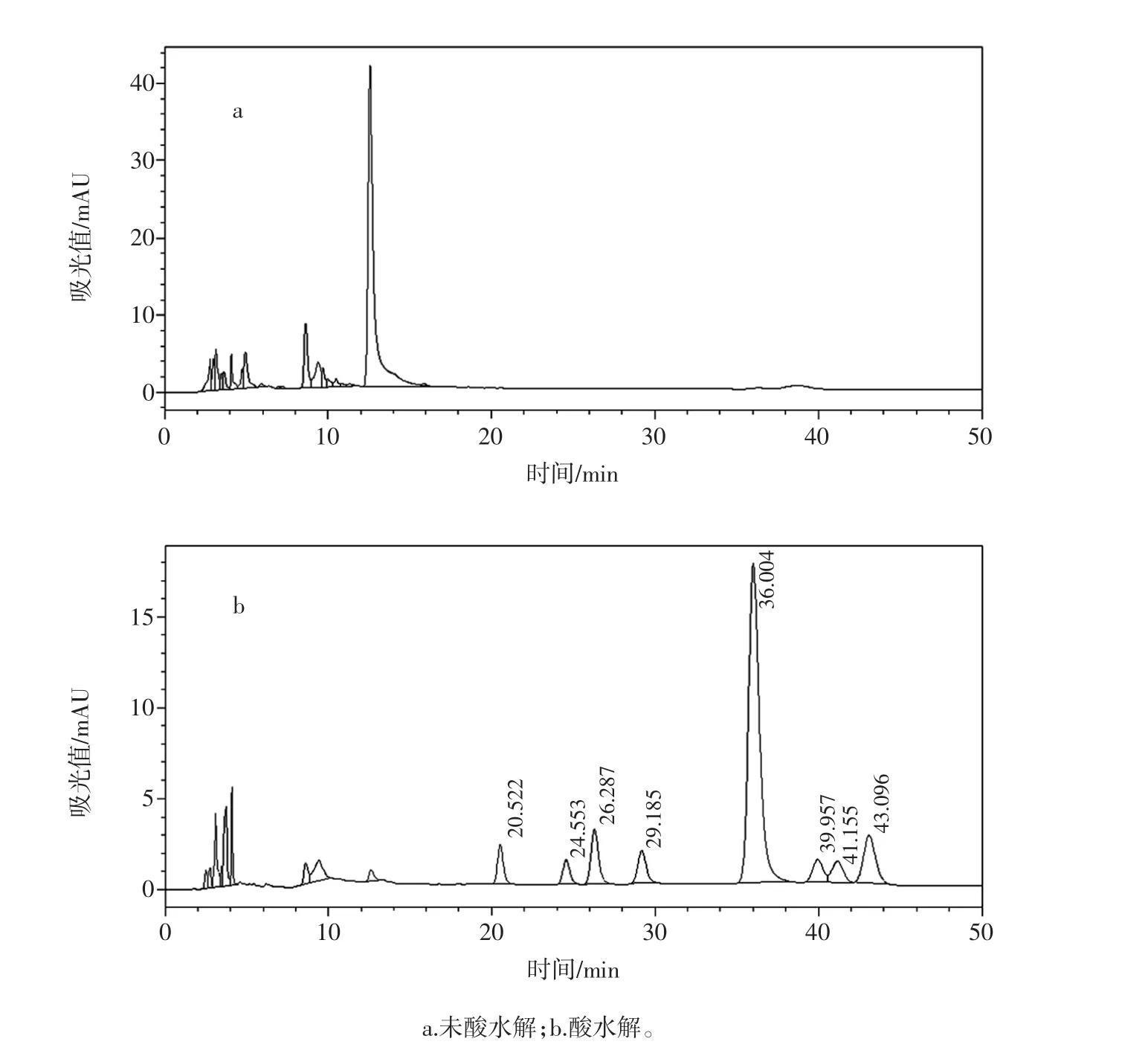
图10 枸杞提取物(市售3)的液相色谱图Fig.10 The HPLC chromatogram of wolfberry polysaccharide extract(commercial sample 3)
3 结论
本文采用PMP衍生化后经HPLC分析糖的组成,7种自制枸杞多糖中均含有L-阿拉伯糖、D-半乳糖、D-葡萄糖、L-鼠李糖、D-甘露糖、D-木糖6种中性单糖及酸性糖D-半乳糖醛酸,与文献报道一致[3]。未成熟枸杞多糖中D-半乳糖醛酸的占比增大,酸性糖含量增加。成熟枸杞中单糖和寡糖部位主要为游离的葡萄糖和甘露糖,寡糖含量很少。未成熟枸杞中游离糖也为葡萄糖和甘露糖;游离糖含量少,寡糖含量较多。
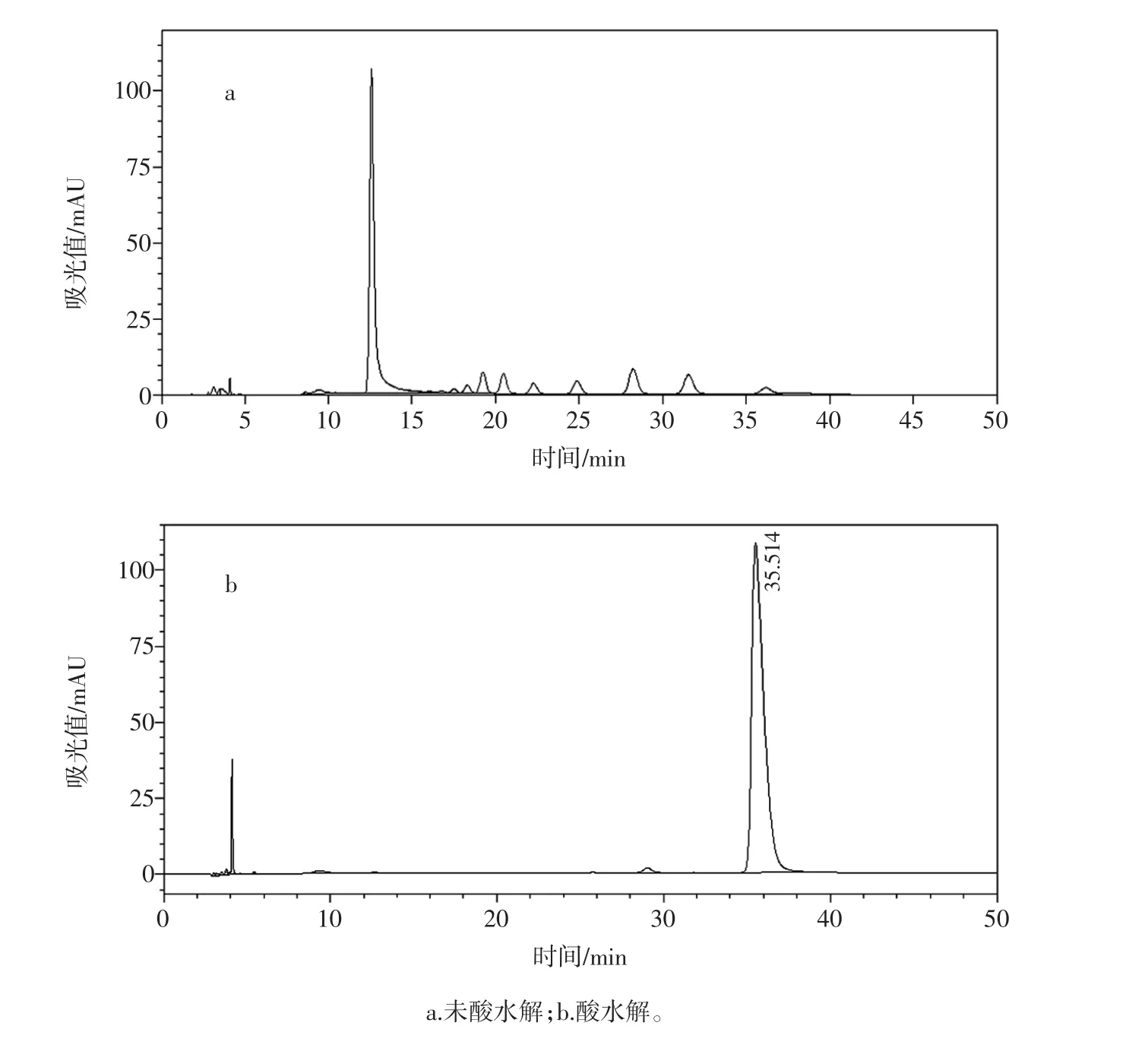
图11 糊精液相色谱图Fig.11 The HPLC chromatogram of dextrin
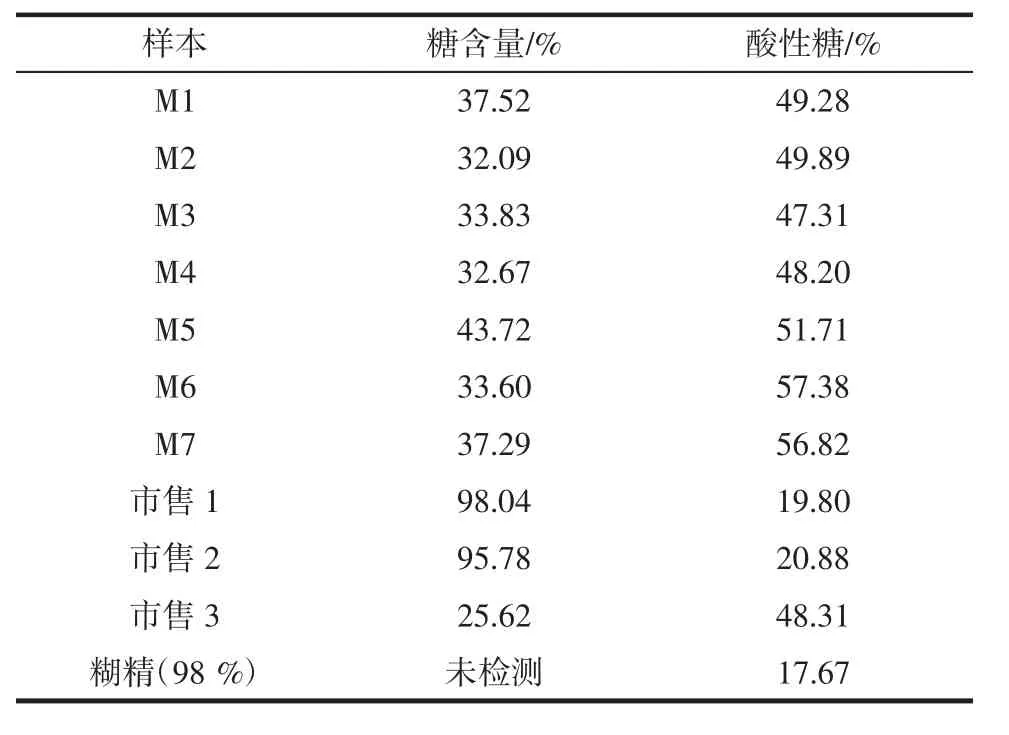
表1 多糖和酸性糖含量测定结果Table 1 Determination results of polysaccharide and acid polysaccharide
枸杞属于浆果类物质,提取液比较黏稠,不易干燥,吸湿性大。工业生产过程中会添加糊精类物质改善性能。3份样本中,从游离糖、单糖组成以及酸性糖含量和糊精是否一致3个角度分析,含枸杞的成分很少几乎全是糊精。只有一份与实验室制备枸杞多糖的成分较一致,并且未检测到游离糖的添加,推测是真正的枸杞多糖。多糖含量和酸性糖含量的角度也能反映出产品的品质,如两份疑似添加糊精的样品多糖含量都大于90%,而真正枸杞多糖含量在32%~43%;相反,酸性糖含量在添加糊精后显著降低。
目前市场上对枸杞多糖类产品的控制主要是测定多糖含量,甚至只测定总糖含量。这样会产生一种添加糊精越多多糖含量越高,品质越高的恶性循环。本结果为枸杞提取物的质量控制提供了思路。通过PMP分析单糖组成,通过制定合理的多糖含量以及酸性糖含量控制枸杞提取物产品的控制。
