出于自然 超越平凡——评析2018年化学命题新热点速率方程
2018-12-06卢国锋
卢国锋
黑龙江
2018年三套理综卷化学部分主观试题,都涉及速率方程这一大学无机化学内容,命题人传递给基础教育什么样的信息,对中学的化学教学会起到哪些指导作用呢?
一、正本清源,破除定势
教科书中定性总结了反应物浓度增大反应速率增大,但没有说明两者之间的定量关系,命题人选择速率方程作为靶点,恰恰考虑到了该知识点是教科书的自然生长点,符合问题研究遵循先定性后定量的原则。




其中可近似认为第二步反应不影响第一步的平衡。下列表述正确的是________(填标号)。
A.v(第一步的逆反应)>v(第二步反应)
B.反应的中间产物只有NO3
C.第二步中NO2与NO3的碰撞仅部分有效
D.第三步反应活化能较高
化学反应速率的快慢与反应的内在机理有关,其反应速率主要取决于速率最慢的基元反应,第二步慢反应是整个反应速率的控制步骤,第一步是可逆反应,快速平衡正逆反应速率相等,第一步快反应的逆反应速率大于第二步的慢反应速率,A正确。中间产物的特点是在反应过程中出现,反应后消失,根据此特点会找到NO在第二步出现第三步消失,这与NO3在第一步出现第二步消失是同出一辙,中间产物有NO3和NO,B错误。根据第二步反应生成物中仍有NO2,推知NO2与NO3的碰撞仅部分有效,C正确。第三步反应是快反应,所以第三步反应的活化能较低,D错误。答案AC。
二、感悟试题,改进教学
人教版、鲁科版、苏教版3种高中化学教材引入化学平衡常数的方法基本相同,表格和数据的呈现方式见下表:

人教版鲁科版苏教版体系温度457.6℃698.6K25℃反应体系H2(g)+I2(g)2HI(g)H2(g)+I2(g)2HI(g)2NO2(g)N2O4(g)起始时各物质的浓度反应物浓度3组反应物浓度3组反应物浓度2组生成物浓度3组生成物浓度3组生成物浓度2组平衡常数呈现方式各组c2(HI)c(H2)·c(I2)数值直接给出自己计算各组[HI]2[H2]·[I2]数值自己计算(1)c(N2O4)c(NO2)各组数值(2)c(N2O4)c2(NO2)各组数值
化学平衡常数引入的难点不在数据的代入计算,而在于表达式本身,仿佛神来之笔从天而降,成为老师和学生的一个痛点,如何解决此问题是教师教学过程中值得思考的问题。
受2016年海南高考16题的启发,试题节选如下:顺-1,2-二甲基环丙烷和反-1,2-二甲基环丙烷可发生如下转化:

该反应的速率方程可表示为:v(正)=k(正)·c(顺)和v(逆)=k(逆)·c(反),k(正)和k(逆)在一定温度时为常数,分别称作正、逆反应速率常数。
回答下列问题:
已知:t1温度下,k(正)=0.006 s-1,k(逆)=0.002 s-1,该温度下反应的平衡常数值K1=________。





起始物质的量(mol) 1 0 0
变化物质的量(mol) 0.2 0.1 0.1
终态物质的量(mol) 0.8 0.1 0.1
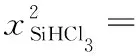

起始浓度(mol·L-1)c0 0
变化浓度(mol·L-1) 0.22c0.11c0.11c
平衡浓度(mol·L-1) 0.78c0.11c0.11c
三、公平竞争,优选人才
高考素材的选择遵循公平性和选拔性两大原则,速率方程这一知识点处于学生最近发展区,能体现考试的公平性,有些教师通过高考试题的研究,发现2015年高考全国Ⅰ卷28题考查过速率方程,如果教师有目的选择该题,或是教师在复习中加入此部分内容,是否会造成高考的不公平性呢?其实大可不必担心,命题人刻意回避了普通教辅材料用浓度进行计算的传统考查方式,另辟蹊径采用分压计算模式,或放弃计算考查方式,转而利用速率方程进行定性推理,达成高考试题既是意料之中又是意料之外的选拔效果。
例如2018年高考全国Ⅰ卷28题(2)节选,F.Daniels等曾利用测压法在刚性反应器中研究了25℃时N2O5(g)分解反应:


2N2O4(g)
其中NO2二聚为N2O4的反应可以迅速达到平衡。体系的总压强p随时间t的变化如下表所示(t=∞时,N2O5(g)完全分解):
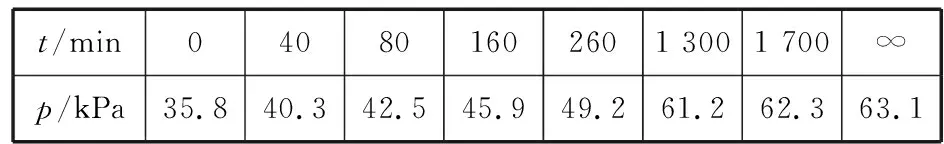
t/min040801602601 3001 700∞p/kPa35.840.342.545.949.261.262.363.1
研究表明,N2O5(g)分解的反应速率v=2×10-3×pN2O5(kPa·min-1)。t=62min时,测得体系中pO2=2.9 kPa,则此时的pN2O5= kPa,v= kPa·min-1。
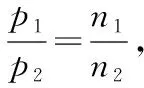

起始压强(kPa) 35.8 0
变化压强(kPa) 5.8 2.9
t时压强(kPa) 30.0 2.9
将pN2O5=30.0 kPa代入分解的反应速率方程得v=6.0×10-2kPa·min-1。


化学反应和性能关联图形,考查获取信息、理解信息、应用信息的能力,依据沉积碳的生成速率方程分析,p(CH4)一定时p(CO2)与积碳量的关系成反比,在一定温度下,相同时间内,沉积的碳越多,沉积碳生成速率越快,则p(CO2)越小,据图知,积碳量a>b>c,则pc(CO2)>pb(CO2)>pa(CO2)。
丘吉尔说:“你能看到多远的过去,就能看到多远的未来。”通过2018年试题分析对今后教学复习有哪些启示呢?通过同一素材出现不同试卷中,考查角度各有不同这一信息,教师要做到“少而精”,精选素材,所选素材有如下特点:出现频次要高,命题角度要新,能力考查要到位,涉及学生必备的基础知识,还有可挖掘的地方。学生层面要做到:有无学会或掌握,回归到基本反应原理和物质结构知识中去,是否形成了必备能力,通过延伸基本知识,在培养学生自学和探究精神方面形成必备品格。

