棘胸蛙白内障病原鉴定及病理组织观察
2018-12-04刘子明胡则辉戴庆敏李巧玲吕耀平
刘子明,金 晶,胡则辉,戴庆敏,李巧玲,施 倩,吕耀平,,*
(1.丽水学院生态学院,浙江 丽水323000;2.宁波大学 海洋学院,浙江 宁波315211;3.浙江省海洋水产研究所,浙江 舟山316021;4.丽水市中心医院,浙江 丽水323000)
棘胸蛙(Quasipaa spinosa),俗称石蛙、石鸡等,隶属于两栖纲、无尾目、蛙科、蛙属,主要分布于我国浙江、江西、福建和湖南等省,因其肉质鲜美,具有较高的食用与药用价值,是近几年蛙类养殖的主要品种之一[1]。棘胸蛙人工养殖技术已经成熟[2-3],但是随着养殖规模的扩大,疫病特别是细菌感染性疾病问题尤为突出[4]。已有报道表明,蜡样芽孢杆菌(Bacillus cereus)[5]、鲍曼不动杆菌(Acinetobacter baumannii)[6]、嗜水气单胞菌(Aeromonas hydrophila)[7]、脑膜炎败血金黄杆菌(Chryseobacterium meningosepticum)[8]、奇异变形杆菌(Proteus vulgaris)[9]和布氏柠檬酸杆菌(Citrobacter braakii)[10]等会引发棘胸蛙疾病。白内障是棘胸蛙常见疫病之一,病蛙眼睑灰白,食欲减退,易死亡,给生产养殖带来了极大的损失[10]。蛙白内障病可能存在多种致病菌,程晓云等[10]从患白内障病棘胸蛙中分离得到布氏柠檬酸杆菌,纪荣兴等[11]、陈晓凤等[12]从患病牛蛙中分离得到气单胞菌(Aeromonas sp.)和醋酸钙不动杆菌(Acinetobacter calcoaceticus),周永灿等[13]从患病虎纹蛙(Rana tigrinarugulosa)中分离得到脑膜炎败血黄杆菌(Flavobacteriu mmeningitidis),廖冰洁等[14]从患病棘腹蛙(Paa boulengeri)中分离得到金黄色葡萄球菌(Staphylococcus aureus)。棘胸蛙作为新兴养殖蛙类,目前对其病害的研究较少。本研究从患白内障病棘胸蛙中分离筛选到病原菌,进行革兰氏染色、生化和分子鉴定确定菌种,并通过人工回归感染确定病原菌对棘胸蛙的致病性,并进行了组织病理观察,最后对病原菌进行了药敏试验,旨在为棘胸蛙养殖与病害的防治提供理论依据。
1 材料与方法
1.1 材料
患白内障病棘胸蛙和健康棘胸蛙由浙江省丽水市鼎鑫生物工程有限公司提供。病蛙5只,体质量为(175±25)g;健康成蛙200只,体质量为(150±16)g。
1.2 病原菌分离
取患白内障病棘胸蛙腹水观察,排除寄生虫和霉菌感染后,在无菌环境下取病蛙眼球、肝脏和肾脏等组织,无菌生理盐水冲洗后,在无菌玻璃匀浆器中研磨,经稀释后涂布于营养琼脂固体培养基,28℃培养24 h后,挑取不同形态单个优势菌落分别接种于绵羊血琼脂固体培养基,28℃培养24 h后,观察菌落生长及溶血情况,将具有溶血性的单菌落进一步在胰酪大豆胨琼脂固体培养基进行纯化培养。将分离纯化得到的2个菌株分别命名为Mm1和Mm2,进行革兰氏染色并观察。
1.3 分离菌生理生化鉴定
将Mm1和Mm2菌株分别划线于胰酪大豆胨琼脂固体培养基,28℃培养24 h,随后接种于细菌微量生化管,对其进行生化鉴定,主要包括糖发酵、醇发酵、乙酰甲基甲醇试验、氧化酶和明胶水解等26项,根据反应结果参照《伯杰细菌鉴定手册》进行判定[15]。
1.4 16S rDNA 鉴定
将Mm1和Mm2菌株分别接种于胰酪大豆胨液体培养基,28℃振荡培养24 h,2种菌分别取1 mL菌液,用天根生化科技有限公司细菌基因组DNA提取试剂盒提取基因组DNA。以基因组DNA为PCR扩增模板,细菌16S rDNA通用引物(F:5'-AGAGTTTGATCCTGGCTCAG-3';R:5'-GGTTACCTTGTTACGACTT-3')扩增16S rDNA基因片段,引物由生工生物工程(上海)有限公司合成。PCR反应体系:超纯水9.5 μL,2×Taq PCR MasterMix 12.5 μL,上、下游引物各 1 μL,模板 1 μL。PCR扩增程序:94℃预变性5 min;94℃变性30 s,55 ℃复性 30 s,72 ℃延伸 90 s,共 33 个循环;72℃再延伸10 min。PCR扩增后产物经1%琼脂糖凝胶电泳检测,用AXYGEN琼脂糖凝胶DNA回收试剂盒回收纯化PCR产物。所得产物连接至pGEM-T载体后转化到大肠埃希菌感受态细胞Top10,阳性克隆送生工生物工程(上海)有限公司测序。
1.5 人工回归感染
分别挑取Mm1和Mm2单菌落到胰酪大豆胨液体培养基中,28℃振荡培养24 h,得到浓度为7.1×108cfu·mL-1的细菌悬液,用无菌生理盐水稀释成菌液浓度为7.1×107、7.1×106、7.1×105、7.1 ×104cfu·mL-1的菌悬液。用制备的不同浓度菌悬液对健康棘胸蛙采用大腿肌肉注射方式进行感染,每只注射剂量为0.2 mL,同时设注射生理盐水的对照组。每组健康棘胸蛙15只。
1.6 组织病理观察
取人工回归感染棘胸蛙和健康棘胸蛙的眼球、肝脏、肾脏和肠组织,用10%中性福尔马林固定,石蜡包埋,切片,苏木精-伊红(HE)染色,中性树胶封片,于光学显微镜下观察并记录。
1.7 抗生素敏感性检测
采用药敏纸片琼脂平板扩散法对Mm1和Mm2进行药敏试验,选用妥布霉素、卡那霉素、头孢他啶、链霉素、氨苄西林、四环素和庆大霉素7种药敏纸片进行试验,测定其抑菌圈直径(平行重复3次),直径小于10 mm为不敏感或低度敏感,10~15 mm为中度敏感,大于15 mm为高度敏感。
2 结果与分析
2.1 剖检变化
患病棘胸蛙眼球突出,眼睑灰白,解剖后可见腹部有大量脓血水流出,肝脏膨大呈黑紫色,肾脏充血呈鲜红色等症状(图1)。
2.2 病原菌的分离与纯化
病原菌在绵羊血琼脂培养基上均呈β-溶血。革兰氏染色镜检为阴性,呈短直杆状(图2)。
2.3 分离菌生理生化特性
分离菌生理生化特性见表1。由表可知,2种菌均能利用葡萄糖产酸产气,H2S阴性,MR试验、触酶、鸟氨酸、吲哚试验和硝酸盐还原试验均为阳性,符合摩根菌属特征。
2.4 分离菌16S rDNA基因测序与系统发育树分析

图1 患病棘胸蛙临床特征Fig.1 Clinical symptoms in infected Q.spinose

图2 致病菌的革兰氏染色Fig.2 Gram staining of pathogenic bacteria
以Mm1和Mm2 DNA为模板,扩增的16S rDNA基因条带测序后,在GenBank进行BLAST分析,结果显示分离菌与GenBank中摩氏摩根菌(Morganella morganii)的同源性最高,达97%。基于分离菌的16S rDNA基因序列及GenBank中摩氏摩根菌属其他细菌的16S rDNA序列构建系统发育树,结果表明,分离菌与摩氏摩根菌(Morganella morganii)聚为一支(图3)。
2.5 人工回归感染实验
如表2所示,Mm1和Mm2分别以浓度7.1×104、7.1 ×105、7.1 ×106、7.1 ×107和 7.1 × 108cfu·mL-1感染健康棘胸蛙,感染3 d后,两个感染组棘胸蛙均出现白内障病症,表现为眼球凸出,眼睑灰白,与自然发病个体症状基本相同(图1)。用SPSS 13.0软件进行统计分析,计算得到Mm1和Mm2两个株菌对棘胸蛙的半数致死量(LD50)分别为3.92×106和4.95 ×106cfu·mL-1。

表1 菌株的生化指标Table 1 Biochemical indicators of the bacterial strains
2.6 眼球及主要脏器病理观察
观察人工感染摩氏摩根菌棘胸蛙的眼球病理组织切片(图4)。比较健康蛙和患病蛙巩膜,可见健康蛙和病蛙巩膜上皮细胞均呈单层有序排列,细胞核排列规则,细胞间排列紧密,下层纤维排列整齐紧密。比较健康蛙和患病蛙晶状体,可见健康蛙晶状体外膜完整,内侧排列整齐的立方状上皮细胞,晶状体基质呈分层排列,纤维排列规则,粗细一致;患病蛙晶状体上皮细胞消解,无细胞结构,晶状体基质排列结构紊乱,纤维多处断裂、崩解、变性。
观察人工感染摩氏摩根菌棘胸蛙的主要脏器病理组织切片,结果如图5所示,与健康棘胸蛙肠、肝和肾相比,患病棘胸蛙肠组织肠壁坏死,且有包涵体出现;肝组织严重坏死,肝细胞无具体形态,大面积核溶解;肾脏肾小管一侧凝固性坏死。
2.7 抗生素敏感性试验
Mm1和Mm2二种菌培养24 h后对其进行抗生素敏感性试验,其抑菌圈直径如表3所示。抑菌圈直径小于10 mm为不敏感或低度敏感,10~15 mm为中度敏感,大于15 mm为高度敏感[16],可见2种菌对氨苄西林和头孢他啶均不敏感,对妥布霉素、四环素和卡那霉素表现出中度敏感。
此外,Mm1对链霉素高度敏感,Mm2对庆大霉素高度敏感。

图3 Mm1和Mm2菌株根据16S rDNA基因序列构建的系统进化树Fig.3 Phylogenetic tree of Mm1 and Mm2 strain based on 16S rDNA gene sequence
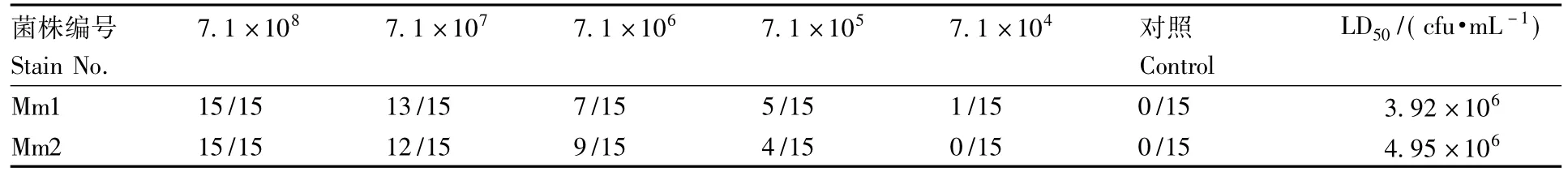
表2 分离菌株对棘胸蛙的致病性(死亡数/试验数)Table 2 Pathogenic results of isolated bacteria strains on Q.spinose(deaths/number of test)

图4 患病棘胸眼球病理组织学特征Fig.4 Pathological and histological features of eyeball in diseased Q.spinose
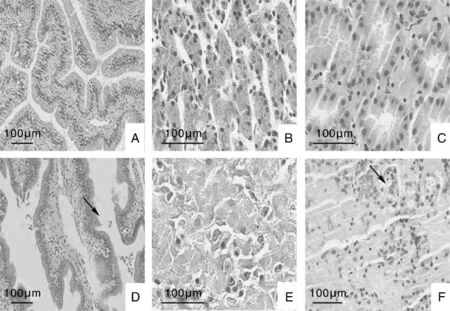
图5 患病棘胸蛙内脏病理组织学特征Fig.5 Histological features of visceral pathology in diseased Q.spinose
3 讨论
在水生生物中,引起眼球表面出现白内障的原因有寄生虫性的和细菌性的。寄生虫性的如复口吸虫(Diplostomulum)的尾蚴和囊蚴等在养殖鱼类过程中常常会引起鱼类白内障病[17]。但在蛙类中,引起蛙类白内障病的主要原因是细菌性感染,程晓云等[10]从患白内障病棘胸蛙中筛选得到病原菌布氏柠檬酸杆菌。如纪荣兴等[11]和陈晓凤等[12]分别从患白内障病牛蛙中筛选得到气单胞菌和醋酸钙不动杆菌。周永灿等[13]发现脑膜炎败血黄杆菌会引起虎纹蛙白内障病。本试验在排除寄生虫感染后,从白内障病蛙中分离筛选得到2种病原菌,经过生化鉴定,发现2种菌均能利用葡萄糖产酸产气,MR试验、触酶、鸟氨酸、吲哚试验、硝酸盐还原试验均为阳性,符合《伯杰细菌鉴定手册》描述的摩根菌属(Morganella)特征。为进一步鉴定到种,PCR扩增了2种菌株的16S rDNA基因序列,BLAST分析确定2个菌株均与摩氏摩根菌16S rDNA具有较高的同源性。综上所述,确定了病原菌为摩氏摩根菌。
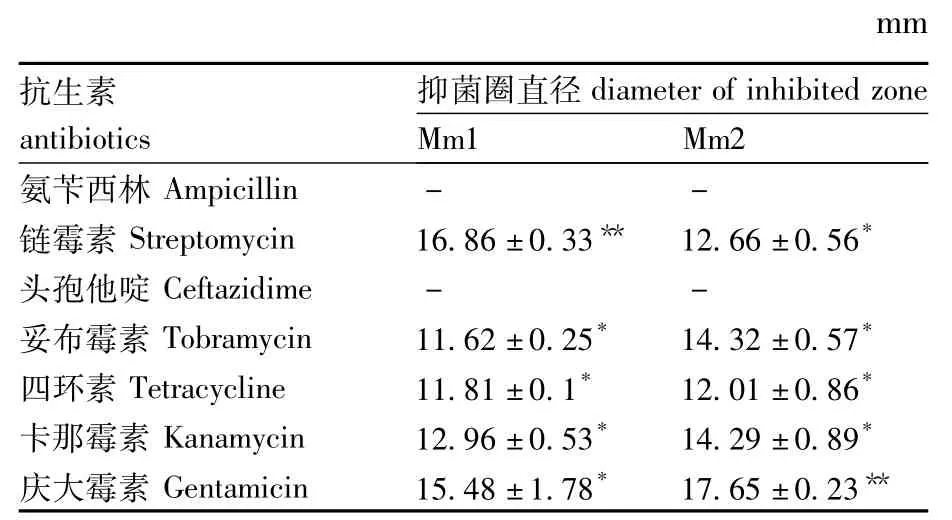
表3 抗生素对菌株的抑制作用Table 3 Inhibitory effect of antibiotics to bacterial strains
已知摩氏摩根菌属于摩根菌属,为革兰氏阴性肠杆菌科(Enterobacteriaceae)细菌,广泛分布于水、土壤及人和动物粪便中[18]。近年来,研究发现摩氏摩根菌可感染多种养殖水生动物,在鲈鱼(Lateolabrax japonicus)[19]、黄喉拟水龟(Mauremys mutica)[20]、大鲵(Andrias davidianus)[21]和胡子鲶(Clarias fuscus)[22]等中均有发现,成为了水生动物重要致病菌之一。而关于其对水生动物的致病机理鲜有相关文献报道。本试验对患白内障棘胸蛙进行了组织病理观察,发现病蛙眼球巩膜正常并未发生病变,而晶状体发生明显的病变,主要表现为上皮细胞消解,基质排列结构紊乱,纤维多处断裂、崩解、变性,这与哺乳动物白内障病病理观察结果是一致的,白内障主要是晶状体病变导致的[23-24]。另外,自然发病和人工感染的患白内障病棘胸蛙解剖后都可见肝脏膨大呈黑紫色,肾脏充血呈鲜红色等症状,这与患白内障牛蛙的解剖观察到的结果是一致的[11-12]。我们更进一步观察了肝、肾和肠的病理组织切片,发现病蛙肠壁坏死,且有包涵体出现;肝组织严重坏死,肝细胞无具体形态,大面积核溶解;肾脏肾小管一侧凝固性坏死。由此可见,患白内障的棘胸蛙其病灶并不仅仅局限于眼部,其他内脏器官也不同程度受到感染且更加严重。多器官坏死、衰竭最终导致了病蛙的死亡。
抗生素药物用于水生生物的病害防治一直都有较好的效果,但近几年,由于抗生素药物的滥用,细菌耐药性现象屡见不鲜,且不同来源的同个菌种的抗药性之间也存在差异。王磊等[25]发现黑格尔七彩神仙鱼(Symphysodon discus)源摩氏摩根菌对青霉素G、头孢氨苄、四环素、多西环素和呋喃唑酮等抗生素已产生耐药性。孔蕾等[26]进行中华鳖(Pelodiscus sinensis)源摩氏摩根菌药敏试验证实对四环素类、林可酰胺类、多肽类、喹诺酮类和磺胺类等耐药。兰云等[20]从黄喉拟水龟中分离筛选出的摩氏摩根菌对氨苄西林、头孢噻吩、替考拉宁、复方新诺明和制菌霉素等14种抗生素耐药,对庆大霉素、卡那霉素和诺氟沙星等7种抗生素敏感。本试验研究发现摩氏摩根菌Mm1和Mm2均对氨苄西林和头孢他啶产生了抗药性,Mm1对链霉素高度敏感,Mm2对庆大霉素高度敏感。
本研究发现,摩氏摩根菌可感染棘胸蛙引起白内障病,并初步研究了病原菌的生物学特性、病理特征和药物敏感性。鱼类来源的摩氏摩根菌分子检测技术已经较成熟[27-28],而两栖类来源的摩氏摩根菌分子检测技术还未见报道,接下来我们将对鱼类来源摩氏摩根菌检测技术应用到两栖类的可能性进行试验,或者开发两栖类特异性的分子检测技术,为预防摩氏摩根菌做好必要准备工作。
