农杆菌浸蘸柱头创制高品质抗虫棉研究
2018-11-09吴慎杰史秀梅张换样秦丽霞解晓红杨晓黎汤飞宇李燕娥焦改丽
吴慎杰 ,李 静 ,史秀梅 ,张换样 ,秦丽霞 ,解晓红 ,杨晓黎,汤飞宇,李燕娥,焦改丽
(1.山西省农业科学院棉花研究所,山西运城044000;2.农业部黄土高原作物基因资源与种质创制重点实验室,山西太原030031;3.江西农业大学农学院,江西南昌330045)
我国绝大多数原棉适纺32~40支纱,适纺60支纱及以上的高品质原棉严重缺乏[1]。高品质陆地棉即绒长≥31 mm、比强度≥34 cN/tex、整齐度指数≥83和麦克隆值在3.5~4.5,其可以替代长绒棉纺大于60支的高支纱,相对长绒棉其产量高和生产成本低,可以显著降低纺织成本,使纺织品的品质和价格具有强大竞争优势,深受纺织企业喜爱。优质中长绒棉市场需求异常紧俏,据预测,欧洲每年需求高强力中长绒棉现已增长至450万t左右,国内每年需求40万~50万t。“十五”期间,国家将中长绒陆地棉育种列入重点攻关计划。农业部在2003—2007年出台了中长绒陆地棉的育种目标。经过多年攻关,在新疆、河北、江苏和江西等地一批新的早熟中长绒棉品种(系)已在田间试验、示范、推广中,为我国棉花发展提供了科技支撑。但是它们大多不抗虫且丰产性欠佳,而采用回交转育抗虫基因的方法连锁累赘,导致选择效果不理想且年限较长。通过杂种优势利用的途径,尽管能直接利用外源抗虫基因,且杂种一代往往具有一定的产量超亲优势[2-3],但纤维品质一般,为中亲优势[4-6],于是高品质棉与常规Bt抗虫棉杂交很难获得F1为高品质的杂交种,其F1产量优势上又不如高品质棉品种互交杂种[4-6]。所以,在高产优质组合的选育上同时实现抗虫,需要2个亲本均为高品质棉且至少有1个亲本含有抗虫基因,利用纤维品质平均优势维持F1的纤维品质,利用产量超亲优势来提高产量,表达抗虫基因,使F1具有抗虫性。然而,由于缺乏高品质抗虫资源,极大限制了高品质抗虫杂交棉选育。
本研究以江西和新疆等地的10份高品质陆地棉品种(系)为受体,采用农杆菌菌液浸蘸棉花柱头的转化方法,将Bt+Sck双价抗虫基因导入中长绒陆地棉的基因组中,纯合转基因株系,旨在选出高抗虫高品质品系,作为进一步高品质抗虫杂交棉选育的核心亲本,以促进高品质抗虫杂交棉育种发展。
1 材料和方法
1.1 试验材料
转化受体材料为 20166,20412,20458,20448,S31.8-1,316,602,KD52026,新陆中 19 和新陆早 31等10个陆地棉品种(系)。其中,前4个品系由江西农业大学汤飞宇教授提供;S31.8-1是山西省农业科学院棉花研究所生物技术实验室泗棉3号组培变异产生的高比强材料,连续3a纤维比强度测定在37.0以上;其余品种(系)由新疆石河子农业科技开发研究中心的艾尼江博士提供。所有酶类是从NEB公司订购,试剂盒DIG DNA Labeling and Detection Kit1购于Roche公司,硫酸卡那霉素由河南润弘制药股份有限公司生产(医用,2 mL/支,0.5 g/支)。
转化农杆菌菌株为LBA4404。双元植物表达载体PcRPBSck35sBt(由中科院遗传发育研究所朱祯研究员提供)携带Bt和Sck双价抗虫基因,Sck基因由PRPB(棉花曲叶病毒复制蛋白)组成型强启动子驱动表达,Bt基因由35s启动子驱动,T-DNA区段含卡那霉素抗性选择基因nptII[7]。
1.2 试验方法
1.2.1 转化方法 2009年4月于山西省农业科学院棉花研究所试验田种植每个受体材料2行,行长7 m。苗期用卡那霉素进行抗性筛选,避免受体混杂。定苗时每行留20株,于盛花期(7月15—25日)进行转化,见花就做。将携带目的基因的农杆菌于28℃振荡培养16~24 h,离心后用转化液(10%的蔗糖、0.5%(V/V)的Silwet L-77和 5 mg/L的 6-BA)重悬至OD600=0.8~1.0备用。在田间用农杆菌菌液浸蘸柱头法[8-9],不切割柱头,于开花当天17:00—19:00直接将菌液涂抹于授粉后的柱头,改用绑花保湿,将双价抗虫基因(Bt+Sck)导入受体棉花。
1.2.2 卡那霉素抗性筛选 将2009年收获的转基因种子,于2010年3月5日高密度播种在苗圃上(苗圃用无滴膜搭成拱形,苗床用清洗干净的细沙铺成),待棉苗长到3~5片真叶时用4 000 mg/L卡那霉素喷洒,7~10 d拔去叶片明显发黄的苗子;再10 d后剩余植株用4 000 mg/L卡那霉素喷洒,进行第2次卡那霉素抗性选择,2次选择留下的植株为转基因候选植株[10]。
1.2.3 PCR分析 采用改良的CTAB法[11]提取转基因候选棉株和非转基因棉株的基因组DNA,进行PCR 检测。Bt引物,F:5′-CACAATCCCACTATC-3′,R:5′-GGACACTGTACGGAT-3′;扩增片段约 900bp。Sck 引物,F:5′-GTGGATCCCACATGTTTG-3′,R:5′-TGCAGGATTTGCAAGCCG-3′;扩增片段约 600 bp。NptII引物,F:5′-GAGGCTATTCGGCTATGACTG-3′,R:5′-TAGAAGGCGATGCGCTGCGA-3′;扩增片段约750 bp。PCR 扩增体系20 μL。程序为 94℃,5 min;94 ℃,30 s,55 ℃,30 s,72 ℃,1 min,30 循环;72℃5 min。取10 μL扩增产物在0.8%的琼脂糖凝胶上进行电泳检测。
1.2.4 免疫试纸检测 用600 μL蒸馏水于1.5 mL离心管中研磨0.1 g的幼嫩叶片,离心后取上清用购自北京银土地公司的国产BT-Cry1Ab/1AC抗虫检测试纸条检测BT毒蛋白的有无[12]。
1.2.5 Southern blot 提取3个纯合株系及各自受体叶片的 DNA(40 μg)[11],质粒和基因组 DNA均使用NEB公司的HindⅢ酶切,用DIG标记从Bt基因扩增片段作为探针进行杂交,扩增片段长900 bp,引物是5′-CACAATCCCACTATC-3′(F)和5′-GGACA CTGTACGGAT-3′(R)。DNA酶切后在0.8%琼脂糖凝胶上电泳分离10~16 h,用纸吸印法将DNA转移至尼龙膜(positively charged,Roche)上,Southern杂交的具体操作按Roche公司的地高辛试剂盒(DIG DNA Labeling and Detection Kit1)说明进行。1.2.6 转基因纯合株系的选育 利用1.2.2,1.2.3和1.2.4的检测方法,结合南繁北育的系统选育手段,连年进行株行种植,如果连续2代田间均不分离,该株系即为转基因纯合系。
1.2.7 纯合系的抗虫性检测 在棉花花铃期(7月上旬),分别取双价抗虫转基因棉花的倒2叶和抗虫棉晋棉50植株相应叶片(对照),参照唐灿明等[13-14]的方法进行抗虫性鉴定和分级,每株系重复5次。浸湿的脱脂棉包住叶柄,每叶片接种到一个培养皿中,每皿8头棉铃虫初孵幼虫,用Parafilm膜封口,27℃散射光下饲养7 d,调查幼虫数和棉铃虫的死亡率。
1.2.8 纯合株系的农艺性状调查 2011—2012年,在山西省农业科学院棉花研究所杨保农场,纯合系于4月15日左右播种,株距36cm,平均行距75cm,7 m行长,3个小区重复,每小区每纯合系4个株行,随机区组排列,栽培管理水平与当地大田生产一致。每小区每纯合系在吐絮期(9月初)随机取10株棉花,重复3次调查其第1果枝节位、果枝数、单株铃数、果节数和株高等性状;每小区每纯合系收正常吐絮20铃,重复3次考察铃质量和衣分;每小区每纯合系随机收获10株所有籽棉并压榨,重复3次考察单株皮棉产量和籽棉产量。所有指标均为2011,2012年2 a结果的平均值。
1.2.9 纤维品质检测 考查铃质量和衣分的棉样送中国农业科学院棉花研究所纤检中心,用HVI900纤维品质检测仪检测[1]断裂比强度、马克隆值、整齐度指数、伸长率和上半部平均长度等性状。
2 结果与分析
2.1 转化体的初步筛选
筛选到的卡那霉素抗性植株,上部真叶均没有黄斑,非转化植株上部真叶有黄斑(图1)。经过连续2次的卡那霉素抗性筛选获得卡那霉素抗性植株,进一步对这些植株进行BT免疫试纸的测定,试纸上显示2条带的为阳性(图2-1~6管中的试纸),证明目的基因的蛋白得以表达;只显示上面一条带(质控线)的为阴性(图2-第7管中的试纸),不同阳性样品的检测线颜色深浅不同,说明它们的毒蛋白含量或表达水平有差异。2次检测均为阳性即为获得的转化体,共获得转化体63株(表1)。笔者认为,在种植密度一致的条件下,以种植小区面积、种植植株数目或转化花朵数为基数比收获的种子数为基数计算转化效率更具有代表性,因为不同的品系结实率是不同的,对柱头所做不同处理直接降低结实率;而在转化过程中处理之间或品系之间的工作量基本相同。所以,在比较转化效率时,以种植的植株数40株为基数,经过2次检测获得的候选转基因植株的多少即能代表转化的效率,结果显示,不同的受体材料的转化效率差异很大,就田间的表型来看,株型较大、营养生长较强的材料转化效率较高(316,S31.8-1,KD52026),具体原因仍有待研究。



表1 各受体获得的抗性植株数量
2.2 PCR检测证明目的基因整合到受体基因组
根据目的基因和标记基因各设计特异引物,提取2.1获得的各转化体的基因组DNA,进行标记基因和2个目的基因的扩增验证,阴性对照(图3-泳道6)没有扩增条带,阳性对照质粒(图3-泳道7)扩增出Bt基因片段,约900 bp,Sck基因片段,约600 bp;NptII基因片段(约 750 bp);阳性植株(图3-泳道1~5)与质粒对照(图3-泳道7)能扩增出大小一致的目的条带,初步表明Bt基因被整合到了受体基因组中。

2.3 Southern blot证明目的基因整合到3个纯合系基因组

利用1.2.2,1.2.3和1.2.4的检测方法,结合南繁北育的系统选育手段,连续2代田间均不分离的株系即为转基因纯合系。在2010年(海南)和2011年(山西)大田株行选择中,有3个转化事件经卡那霉素抗性筛选、免疫试纸检测和PCR检测不再分离,为候选纯合株系,提取叶片DNA后,以40 μg转化植株基因组DNA,40μg受体基因组DNA和1~2μg质粒DNA进行Southern blot分子检测。Bt基因的分子杂交显示,质粒DNA有1条接近3.5 kb杂交条带;其受体S31.8-1(图4-泳道3)无条带;转基因纯合系S486(图4-泳道4)有4 000~5 000 bp的2条带,即2个拷贝,S497(图4-泳道5)和S498(图4-泳道6)分别有3 000,2 500 bp左右的单带,即各自1个拷贝,其受体20448(图4-泳道7,8)无条带。证明Bt基因已被整合到3个纯合系的基因组中。
2.4 转基因纯合株系具有很好的抗虫性
3个纯合株系室内抗虫鉴定结果显示,盛花期转Bt+Sck双价抗虫棉株系的棉铃虫死亡率都大于90%,抗虫性显著高于受体对照,高于或相当于阳性对照抗虫棉晋棉50的抗虫水平,转Bt+Sck双价抗虫棉表现出对棉铃虫很高的毒杀作用(表2,图5)。
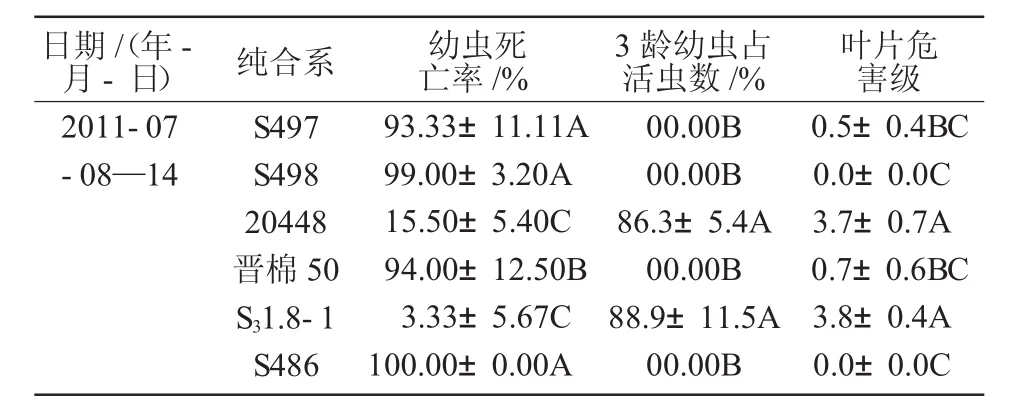
表2 3个纯合株系对棉铃虫的抗性分级

2.5 转基因株系维持了和受体相当的纤维品质
纤维品质的测定结果表明,转基因纯合系与各自的受体间整齐度、绒长、伸长率和比强度无明显差异,S498和S497的马克隆值比受体20448低,而S486比受体S31.8-1的马克隆值高。可见,3个转基因纯合系维持了和受体基本相当的纤维品质(表3)。

表3 转基因纯合系的纤维品质测定
2.6 转基因株系的产量性状明显优于受体
产量性状调查显示,转基因纯合株系与各自的受体对照相比,单株铃数、单株籽棉产量和单株皮棉产量显著增加;转基因株系和受体的单铃质量和衣分间差异不显著,比对照稍有增加(表4)。

表4 转基因纯合系的产量性状
2.7 转基因株系的株型与各自受体相比有明显改变
转基因纯合株系与各自受体对照相比,转基因纯合系的株高、第1果枝节位、果枝数和单株果节数明显降低(表5),而单株铃数显著增加(表4),所以,单株的成铃率增加。可能是由于35s启动子组成型表达抗虫基因,改变了植株的营养分配,使得转基因植株的营养生长受到抑制,生殖生长受到促进,株型和产量性状得到了明显改善。

表5 转基因纯合系的株型性状
3 结论与讨论
利用农杆菌菌液浸蘸和涂抹柱头的转化方法,首次直接将Bt+Sck双价抗虫基因导入了高品质棉品系,获得了多达63个转化事件,经系统选择和可靠的分子检测,至2011年底获得了3个高品质抗虫棉纯合系,转基因株系具有较高的抗虫性同时维持了受体的高纤维品质。
到 2012年年底,我们通过 1.2.2,1.2.3,1.2.4,1.2.6的检测和选择方法获得了40多个转化事件的纯合株系,虽然没有全部进行Southern检测,但通过免疫试纸测定,可确证BT毒蛋白都得到了表达。这些转化事件和受体比较,大多转化事件的抗虫性、产量、品质和适应性表现良好,尤其是株型和结铃性明显变好,高品质棉营养生长旺盛的缺点得到改良,可能是由于35s启动子组成型表达BT蛋白,改变了植株的能量分配,但机理需要进一步深入研究。这些纯合的转基因材料已经返还和提供给受体提供者以及山西省农业科学院棉花研究所一些课题作为高品质抗虫杂交棉选育的亲本使用。
棉花的再生受基因型的限制,同样的高品质棉只有极少基因型可以胚胎发生,所用的10个受体我们均尝试了再生体系的构建,没有获得成功,即高品质棉基于胚胎发生的农杆菌转化体系没有建立[15-16]。针对这一情况,本研究使用了2009年报道的农杆菌浸蘸柱头法这种新的转基因技术[8-9],同时对该转化方法进行了如1.2.1的改良;与传统农杆菌介导法相比,其更为简便、经济和高效,避免了组织培养受基因型限制和易产生体细胞无性系变异等问题[17]。该方法建立依耐农杆菌棉花传统转化方法、农杆菌转化棉花花粉[18]、拟南芥花器官浸泡[19]和棉花花粉管通道[20]4种转化方法的结合。在实验室通过GUS组织化学分析观察农杆菌侵染下胚轴切面或胚性愈伤时,48 h的瞬时转化率处于12.61~42.8%;农杆菌浸泡花粉后授粉会使大部分花粉破裂死亡;花粉落在柱头上需要萌发出花粉管伸长到子房完成受精,且细胞核处于花粉管的下段,在这一阶段的某一时刻农杆菌滴注柱头表面或柱头切面,花粉管细胞暴露在柱头表面或切面也应有12.61~42.8%的概率被侵染,然后在完成受精的同时完成转化;这种假设的T-DNA靶向目标明显区分于拟南芥的in planta农杆菌侵染过程,拟南芥的in planta转化T-DNA靶向于成熟的雌配子体,转化胚乳细胞和转化胚胎是相对独立的转化事件[19]。即农杆菌侵染了已经进入花柱的花粉管细胞进一步到达胚珠,精卵细胞结合形成了转化的合子,进而发育成转化的种子,该过程我们现在基本可以确证(未报道);但是无法排除由花粉管萌发将农杆菌带入胚珠或农杆菌通过花粉管通道进入胚珠的可能。期望进一步提高该方法的转化效率,简化和标准化转化程序,使之成为大多数育种工作者的有利工具,促进更多转基因高品质棉品种用于生产,确实为我国高品质抗虫杂交棉的选育作出贡献。
