纤维小体结构及其功能的研究进展
2018-11-08朱兆静卢向阳
朱兆静, 潘 虎, 郭 俊, 卢向阳, 王 翀, 田 云
(1.湖南省农业生物工程研究所,湖南长沙 410128; 2.湖南农业大学生物科学技术学院,湖南长沙 410128;3.西藏自治区农牧科学院农业质量标准与检测研究所,西藏拉萨 850000)
纤维素作为植物细胞壁组分中的一种多糖物质,也是木质纤维素的重要组分之一,是目前地球上最丰富的可再生资源,开发利用价值极高,但由于与木质素相互掺杂,导致极难被降解,造成了纤维素资源的极大浪费[1]。纤维小体(cellulosome)一般由厌氧微生物产生,是由支架蛋白以及多种酶组装成的大分子复合物,能够高效地降解纤维素而引起广泛关注。
Lamed等首次从超嗜热厌氧微生物热纤梭菌(Clostridiumthermocellum)中发现并鉴定了纤维小体复合体,分子大小为 2×106~6×106u,由14~50个亚基组成[2]。研究发现,纤维小体普遍存在于厌氧生物中,原因在于依靠高度组织化的细胞表面酶系统,调节细胞代谢活动,实现酶的再循环利用和水解产物的直接同化,抵抗厌氧发酵产能的不足[3]。厌氧真菌[梨囊鞭菌属(Piromyces)、根囊鞭菌属(Orpinomyces)和新美鞭菌属(Neocallimastix)]中也有纤维小体复合物的存在,但真菌系统中缺乏真正的黏附结构域和锚定结构域,与细菌纤维小体有着明显的不同[4]。
纤维小体降解纤维素的高效性取决于其高级结构的复杂程度,而不同微生物中的纤维小体结构组分和组装模式具有明显的不同,导致纤维素降解能力的差异[5]。此外,纤维小体在蛋白质等其他大分子的代谢以及细胞间的识别也发挥着一定的功能。本文根据最近的研究进展,对纤维小体的结构和功能进行了综述。
1 纤维小体的结构
纤维小体一般是由2部分组成:一部分是含有锚定结构域(dockerin)的多酶亚基,有催化作用;另一部分是含有1个或多个黏附结构域(cohesin)的支架蛋白(scaffoldins),有组装作用[6]。纤维素酶通过锚定结构域与支架蛋白上的黏附结构域特异性结合,组装成纤维素酶多酶复合体,其中支架蛋白上还含有1个纤维素结合域(CBM),将底物纤维素结合于纤维素多酶复合体上。
1.1 支架蛋白
支架蛋白的种类和数量在不同物种中都有所不同,主要包括初级支架蛋白、锚定支架蛋白和衔接子支架蛋白(图1-a)。根据支架蛋白的数量,可将纤维小体分为简单纤维小体和高度结构化的纤维小体[7]。一些嗜温梭菌产生的纤维小体只含有单个初级支架蛋白,称为简单纤维小体(图1-b);而另一些细菌产生的纤维小体含有多个相互作用的支架蛋白,复杂程度较高,称为高度结构化的纤维小体(图1-c)。
初级支架蛋白的表达量高,含有多个黏附结构域以及纤维素结合域[8]。例如,在嗜纤维梭菌(Clostridiumcellulovorans)中,酶EngE上的锚定结构域模块与初级支架蛋白的黏附结构域相互作用形成简单纤维小体;此外,EngE酶还含有1个肽聚糖结合的Slayer同源(SLH)结构域,可将其锚定到细胞表面[9]。高度结构化的纤维小体包含多个支架和多种酶,其初级支架蛋白含有专门的锚定结构域,通过与锚定支架蛋白的黏附结构域相互作用来介导细胞表面附着。锚定支架蛋白通过专门的锚定模块与细胞表面相互作用,非共价结合于SLH结构域或共价结合于转肽酶序列。衔接子支架蛋白存在于更复杂的纤维小体,介导支架蛋白-支架蛋白或支架蛋白-酶的连接,调节纤维小体的组装[10]。单价衔接子支架蛋白(含单个黏附结构域)可以改变整合到纤维小体中的酶的类型,并且可以根据底物的不同,插入不同活性的酶到不同的纤维小体复合物中;多价衔接子支架蛋白(含有多个黏附结构域)可以作为扩增纤维小体复合物和多个酶整合的平台,能够更有效地对底物进行水解[11]。
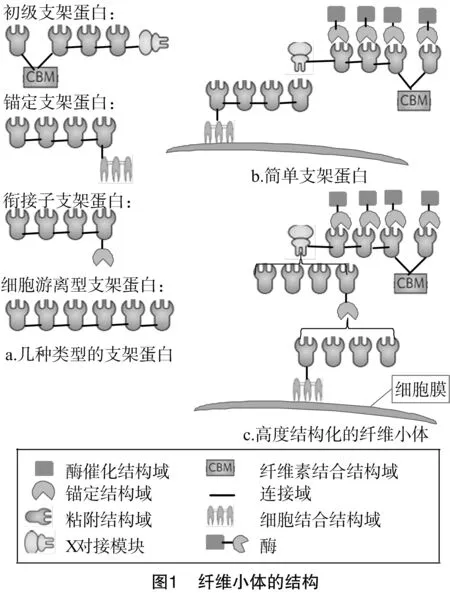
目前,已知的纤维小体大多数是细胞锚定型的,而在热纤维梭菌(C.thermocellum)中发现了固有的无支架蛋白的细胞游离型纤维小体,其结构成分与细胞锚定型纤维小体不同[12]。
1.2 酶组分
纤维小体在支架蛋白存在的情况下,通过黏附结构域-锚定结构域相互作用将一系列不同的酶结合起来,使得各种纤维素相关的酶在彼此协调有序的空间里高效地发挥作用。纤维小体中的酶组分与游离纤维素酶系中的相似,都属于糖苷水解酶家族,各组分之间具有协同作用。
最早发现的热纤维梭菌纤维小体中含有多种纤维素酶、木聚糖酶、果胶酶和果胶裂解酶、甘露聚糖酶、木聚糖酶、糖酯酶、几丁质酶和混合连接β-葡聚糖酶,具有高效打破结晶纤维素的结晶结构和降解纤维素链的能力[13]。Ravachol等阐明了解纤维梭菌(C.cellulolyticum)中13个GH9家族的外切葡聚糖苷酶的特征,这些酶依据各自独立化的组织模块表现出不同的酶活以及与其他外切葡聚糖苷酶多元化的协同效应[14]。上述报道表明,纤维小体中酶的多样性与协同性对于高效降解纤维素底物的重要性。其他糖苷水解酶(如GH5、GH10、GH11 和GH43等)是纤维小体的常见组件,为细菌提供了1个强大多样的酶系,增加植物细胞壁多糖的水解。
纤维小体中除了含有锚定结构域的纤维素降解酶外,还存在含有锚定结构域的其他酶蛋白,如丝氨酸蛋白酶抑制剂[15]、蛋白酶[16]和expansin-like蛋白[17]。此类蛋白质对于细菌的生理生化过程、纤维小体组分的装配以及生物质的降解都有一定的作用。
1.3 黏附结构域-锚定结构域
黏附结构域-锚定结构域之间通过非共价键连接,是纤维小体装配的基础。这种非共价作用是自然界中最强的蛋白质-蛋白质相互作用之一,并且表现出物种特异性[18]。
目前,在厌氧微生物纤维小体中发现了3种黏附结构域-锚定结构域,分别为typeⅠ、typeⅡ和typeⅢ[19]。typeⅠ相互作用存在于含有锚定结构域的催化亚基和初级支架蛋白的黏附结构域之间;typeⅡ相互作用发生在2个支架蛋白中,通常是锚定支架蛋白和初级支架蛋白之间,但也有例外,例如,溶纤维素拟杆菌(Bacteroidescellulosolvens)是唯一已知的具有相反相互作用模式的细菌,即其酶含有typeⅡ锚定结构域,而scaffoldins包含typeⅠ锚定结构域[20]。typeⅢ 黏附结构域-锚定结构域对在反刍球菌的纤维素酶体中发现,不同于在梭菌属中观察到的typeⅠ和typeⅡ[21]。
对黏附结构域和锚定结构域模块的结构研究表明,其对于界面识别起关键作用,负责纤维小体中模块间的识别和绑定。typeⅠ的黏附结构域通常由约150个氨基酸组成,并且以2个9-链β-折叠组成果冻卷的拓扑结构,其中β-折叠上的5、6、3、8链与锚定结构域相互作用[22]。typeⅢ黏附结构域存在与 typeⅠ黏附结构域类似的拓扑异构结构,其β-折叠的5、6、3、8链与锚定结构域相互作用,而4链和8链之间包含2个“β转角”,类似于typeⅡ型的黏附结构域[23];此外,typeⅢ黏附结构域还有1个典型的13-链α螺旋被1个氨基酸末端循环所包围,在其他类型的黏附结构域中是不存在的[24]。
typeⅠ型的锚定结构域含有约70个氨基酸并折叠成2个串联重复,每个重复包含1个特异性的Ca2+结合环和1个α-螺旋,在螺旋的10、11、17、18位点处存在保守的特征性“识别残基”[25]。锚定结构域通常通过2个α螺旋重复序列的其中1个α-螺旋与黏附结构域相连,由此提出了typeⅠ型的双重结合模式,即2个对称重复的锚定结构域以任意1个与黏附结构域结合,且能以180°旋转。这表明含有锚定结构域的蛋白以2个不同的取向掺入复合物中,可以避免大的多组分的纤维素酶体中的空间冲突,促进纤维素底物降解期间酶的构象变化。typeⅡ的黏附结构域-锚定结构域对不具有双重结合模式,2个螺旋通过黏附结构域-锚定结构域界面处的几种相互作用与黏附结构域相连,表现出了单一结合模式[26]。模块之间的结合模式没有严格的界限,typeⅢ型相互作用可以是单一结合模式或双重结合模式,如瘤胃菌属typeⅢ的黏附结构域-锚定结构域是高度多样的,并且在一些情况下,第2个钙结合性锚定结构域环的序列严重失真;生黄瘤胃球菌 (Ruminococcusflavefaciens)的Ctt A蛋白的typeⅢ的锚定结构域含有2个额外的螺旋,以类似typeⅠ型相互作用的方式与Sca E 黏附结构域相连。
1.4 纤维素结合模块(CBM)
纤维素结合模块能够选择性地将纤维小体锚定在纤维素底物上,在纤维素降解中发挥关键作用。几种梭菌型纤维小体的支架蛋白都包含1个CBM3,位于支架蛋白的 N 端或者序列的中间[27],例如,解纤维梭菌中的支架蛋白Cip C含有160个氨基酸组成CBM3,这与热纤梭菌纤维小体支架蛋白的CBM3很相似。
最近的研究发现,纤维小体中还存在CBM2家族的纤维素结合模块,如,纤维放线菌(Acidothermuscellulolyticus)纤维小体细胞游离型的支架蛋白Sca M中含有3个typeⅠ型的黏附结构域和2个CBM2家族;C.clariflavum的基因组中也发现了类似的编码含CBM2的支架蛋白基因[28]。CBM2通常与游离的纤维小体相关,被分为2个亚家族,其中一个结合纤维素,而另一个结合木聚糖[29]。CBM2仅存在于游离型的支架蛋白上而不存在于细胞锚定的支架蛋白上,这表明其与CBM3有着不同的作用。
CBMs对纤维小体的功能有十分重要的影响,但并非仅作为支架蛋白的一部分。已知的纤维小体的纤维素结合蛋白仅含有CBM2和CBM3 2个家族,但在纤维小体的酶组分中CBM家族广泛分布,其中CBM3、CBM6、CBM50家族的CBM占的数量较多,这些结构与酶的催化作用密切相关[30]。
1.5 细胞表面结合模块
纤维小体通过其支架蛋白上的细胞结合模块与细菌细胞表面的肽聚糖共价相连,将其紧密地结合于细胞表面,且不同纤维小体的连接方式具有多样性[31]。目前,对纤维小体附着于细胞表面的机制研究得比较少,但它对于纤维小体发挥生物学功能有重要的影响。
支架蛋白中最常见的细胞表面结合模块是表层同源结构域(S-layer homology module,SLH),如热纤维梭菌纤维小体的多个支架蛋白均带有C端SLH 模块,SLH 模块将这些支架蛋白锚定在细胞表面上[32]。在解纤维梭菌的纤维小体中,SLH 模块存在于纤维小体的酶组分 EngE中,支架蛋白中则含有4个亲水性结构域(HLD),二者共同作用将纤维小体锚定于细胞表面[33]。此外,在瘤胃球菌的纤维小体中,其支架蛋白1个类似LPXTG 的基序(motif),通过溶蛋白性裂解和分选酶(sortase)-介导的附着机制共价结合在细胞表面[34]。
1.6 纤维小体表达调控
纤维小体在底物碳源的降解方面发挥着重要功能,同时,碳源也是决定纤维小体组装的重要因素,影响着酶亚单元的整合以及整体结构。定量蛋白组学分析显示,热纤维梭菌中纤维小体的催化亚基的分布受底物依赖性的调节,纤维小体及其他一些碳水化合物活性酶(CAZymes)基因的表达在纤维素发酵期间上调现象[35]。其纤维小体的结构组分包括支架蛋白CipA(Cthe3077)和7种锚定蛋白,含有Ⅱ型黏附结构域的锚定蛋白有5种(Cthe1307/SdbA、Cth3078/OlpB、Cthe3079/Orf2p、Cthe0735、Cthe0717),其余2种含有Ⅰ型黏附结构域(Cthe3080/OlpA、Cthe0452),其中编码CipA、Orf2p、OlpB和OlpA的基因在纤维素发酵过程中表现出最大量的表达。在底物缺乏的情况下,跨膜 anti-σ因子与细胞中的σ因子相连,每种anti-σ因子也有1个类似CBM的组件,与外部培养基中多糖底物相结合。CBM与相应的底物相结合导致 anti-σ因子改变构象,释放辅助性σ因子,然后与RNA聚合酶相互作用,从而启动纤维小体基因的转录[36]。
2 纤维小体的功能
2.1 纤维小体对植物细胞壁的降解
研究表明,纤维小体能够在各种各样的环境中高效地降解植物细胞壁。瘤胃是食草类动物提供能量的主要场所,包含1个由古细菌、原生动物、真菌和细菌等组成的复杂群落,参与植物细胞壁结构多糖的降解。瘤胃是迄今已知的纤维素降解能力最强的天然发酵罐,但实际上瘤胃中真正降解纤维素的微生物种类和数量都相对较少[37]。这些微生物中降解植物细胞壁的酶,多以纤维小体多酶复合体的形式黏附于细胞表面,紧密结合纤维素,由此降解架构复杂且不溶性的大分子多糖底物。目前,瘤胃中唯一已知的产纤维小体的细菌是瘤胃球菌,其多酶复合物的组装依靠内部的黏附结构域-锚定结构域相互作用,通过其CBM模块促进底物靶向和细菌黏附,从而引发纤维素底物的解构。
此外,在C.clarilavum纤维小体的基因组中,编码含锚定结构域蛋白的基因含有2个扩展样蛋白基因Clocl_1862和Clocl_1298,是首例在细菌中发现的扩展样蛋白[17]。扩展蛋白是一类非催化活性的小分子蛋白,它们能够干扰植物细胞壁多糖的非共价结合,通过机械作用分离相关多糖链,从而松散底物的结晶度并破坏植物的细胞壁[38]。Kim等研究发现,利用大肠杆菌宿主异源表达植物扩展蛋白的表达量非常低,然而,细菌源的扩展蛋白具有高的表达量,使其在生物质降解和应用方面存在巨大的优势[39]。
2.2 纤维小体参与细胞代谢
Bensoussan等对牛瘤胃纤维小体的研究发现,含有锚定结构域的491个蛋白拥有79种不同的功能:12种功能与碳水化合物活性酶相关,参与纤维素的降解;剩余56种与木质纤维素的降解并不相关,其中部分与蛋白质的分解代谢相关,在大分子的降解和清除中发挥着广泛的作用。在这种情况下,纤维小体中的酶组分与经典纤维素酶功能不同,其中大部分在蛋白质的分解代谢以及微生物相互作用中发挥功能,例如含有锚定结构域的D-丙氨酰-D-丙氨酸羧肽酶。D-丙氨酰-D-丙氨酸肽是细菌细胞壁的重要结构组分,通常是各种抗生素的靶标位点,是纤维小体参与瘤胃抵御微生物攻击的一个途径[40]。这些发现意味着含锚定结构域的蛋白不仅参与纤维素的降解,还广泛地参与细胞生命活动过程。
3 纤维小体的人工改造及其应用
3.1 微型人造纤维小体
随着对纤维小体研究的深入,人们已经意识到纤维小体在纤维素转化中的价值,从而开启了通过人工设计并改造天然纤维小体,使其更有效地作用于纤维素降解的新思路。人造纤维小体概念由Bayer等首次提出,即通过人工设计并利用基因工程手段改造天然纤维小体,进而高效降解木质纤维素。现已有多个实验室采用DNA重组技术,构建携带黏附域的支架蛋白基因和携带锚定域的纤维素酶基因,表达纯化后在体外组装成预期的多酶复合体。
Fierobe等设计了一系列含有2种黏附域的支架蛋白,在体外组装了含2种纤维素酶的双酶复合体,它的比活性比游离酶高了7倍[41]。为拓宽纤维小体酶的多样性,增加对底物的降解,除利用来源于自然界多酶复合体中的纤维素酶外,还可通过基因工程方法将游离纤维素酶或非纤维素酶(β-葡糖苷酶、裂解多糖单加氧酶LPMO和植物细胞壁扩展蛋白)掺入到人工设计的纤维小体中,例如,漆酶的整合提高了纤维素酶活性,从而为人造纤维小体介导的木质素和纤维素的降解铺平了道路[42]。
人工构建的纤维小体能够灵活地组合不同的纤维素酶和其他酶组分,能使酶的降解效率成倍地增加,对纤维素的工业化利用十分有利。此外,人造纤维小体启发了其他复合物的设计,包括自组装12酶和18酶复合物等,增加了在单个复合物中酶的数量和多样性,可以设计出更多符合人们意愿的多酶复合体。
3.2 纤维小体用于生物质开发利用
微型人造纤维小体可高效降解植物细胞壁多糖中难降解的纤维素类物质,在发酵生产可再生能源过程中起着极其重要的作用,也为解决纤维素资源利用问题提供了思路。嗜热纤维小体因其能提高反应速率,增加工艺灵活性,降低污染风险等,在工业应用领域具有极大的潜力。Moraïs等将来源于热纤维梭菌的热稳定性外切葡聚糖酶Cel48S、内切葡聚糖酶Cel8A以及通过易错PCR法获得的热稳定的β-葡糖苷酶,引入到人工纤维小体,结果显示,“热稳定的”人工纤维小体的降解速率比常规设计的人工纤维小体增加了1.7倍。工程化的嗜热菌剂完全降解生物质须要引入更多的酶,而将植物生物质转化为生物燃料的理想嗜热微生物尚未确定,故开发嗜热统合生物工艺(consolidated bio-processing,CBP),将产纤维小体的嗜热微生物用于生产生物燃料是一个优选的策略[43]。
CBP技术的提出,促使纤维小体作用于植物源的生物质生产生物燃料的发展。该技术是将纤维素酶和半纤维素酶的生成、纤维素和半纤维素多糖成分的水解以及发酵生成生物燃料等一系列生物催化过程组合在一起,是由1种或1组微生物完成的生产工艺[44]。现已将毕赤酵母(Pichiapastoris)[45]、枯草芽孢杆菌(Bacillussubtilis)[46]和 植物乳杆菌(Lactobacilluslantarum)[47]等几种微生物工程化,在其细胞表面锚定微纤维小体或人工纤维小体,用于将纤维素酶促转化成糖和乳酸。上述研究表明,纤维小体组分可以在外来生物体中进行功能性组装,用于从有机废物中高效的生产生物燃料。
4 总结与展望
纤维小体能够高效降解植物细胞壁,在发酵生产可再生能源过程中起着极其重要的作用,也为解决纤维素资源利用问题提供了思路。对纤维小体的研究具有重要的实践意义和广阔的应用前景。目前,纤维小体的研究主要集中于基因及基因组水平,寻找纤维小体产生菌以及相关蛋白的表达方面,对纤维小体超分子结构与功能的研究相对缺乏。未来的研究应该致力于纤维小体超分子功能,探索其酶组分如何协同高效降解天然纤维素,以及它们在生态系统中发挥的作用。同时,应继续深入了解不同来源的纤维小体在组成上的同源性和多样性、纤维小体分泌和组装过程等,为工程改造纤维小体和利用纤维素资源提供更多的理论基础。
