金丝桃苷胶囊的制备及质量标准研究
2018-11-07李园园罗明和石三军陆军军医大学第三附属医院野战外科研究所药剂科重庆400042
李园园,罗明和,石三军,明 月 (陆军军医大学第三附属医院野战外科研究所药剂科,重庆400042)
0 引言
金丝桃苷(hyperin, Hyp),又名槲皮素⁃3⁃O⁃β⁃D吡喃半乳糖苷,一种广泛存在于金丝桃科、蔷薇科、桔梗科、唇型科、小檗科、杜鹃花科、葵科等多种植物中的黄酮醇苷类化合物。近期对金丝桃苷的研究极为活跃,国内外研究[1-8]表明,Hyp 具有镇痛、抗炎、保护心肌和肝脏等广泛的药理作用。Hyp是难溶性药物,其生物利用度较差,极大限制了该药物的应用[9-12]。将难溶性药物制备成固体分散体后,不但能提高药物的溶出速率和溶解度以提高药物的吸收和生物利用度,而且还可以将固体分散体进一步制备成胶囊剂,达到更好的口服吸收和治疗效果[13]。本实验采用研磨法制备Hyp的固体分散体,并将含药固体分散体进一步制备成胶囊剂,并建立了金丝桃苷胶囊的质量标准。
1 仪器与试药
岛津LC⁃20A高效液相色谱仪(日本岛津公司);KQ⁃500E型医用超声波清洗器;BT 25S电子天平(赛多利斯科学仪器有限公司);ULUP⁃III⁃10T触摸屏高端超纯水器(成都优普电子产品有限公司);乙腈为色谱纯;其他试剂均为分析纯。微晶纤维素、PEG6000、淀粉;金丝桃苷对照品(南京泽朗生物科技有限公司)。
2 制备工艺研究
2.1 金丝桃苷固体分散体制备将金丝桃苷原料药和PEG 6000按1∶6的比例置于蒸发皿中,混合均匀,至60℃水浴上使完全溶解,立即置于-20℃冷冻干燥,研磨成细粉,过80目筛网制得金丝桃苷PEG固体分散体。
2.2 辅料的选择由于金丝桃苷PEG固体分散体的流动性差、吸湿性强[14],故选用淀粉、微晶纤维素和不同比例淀粉与微晶纤维素混合物作为辅料,按7份固体分散体添加8份辅料混合,过筛,考察颗粒流动性和吸湿性,以确定辅料种类。
2.2.1 休止角的测定 采用固定漏斗法,将3只漏斗串联,使最底端距水平坐标纸1 cm,将药物颗粒沿漏斗壁倒入最上层的漏斗,直到药粉圆锥尖端接触到漏斗口为止(表1)。
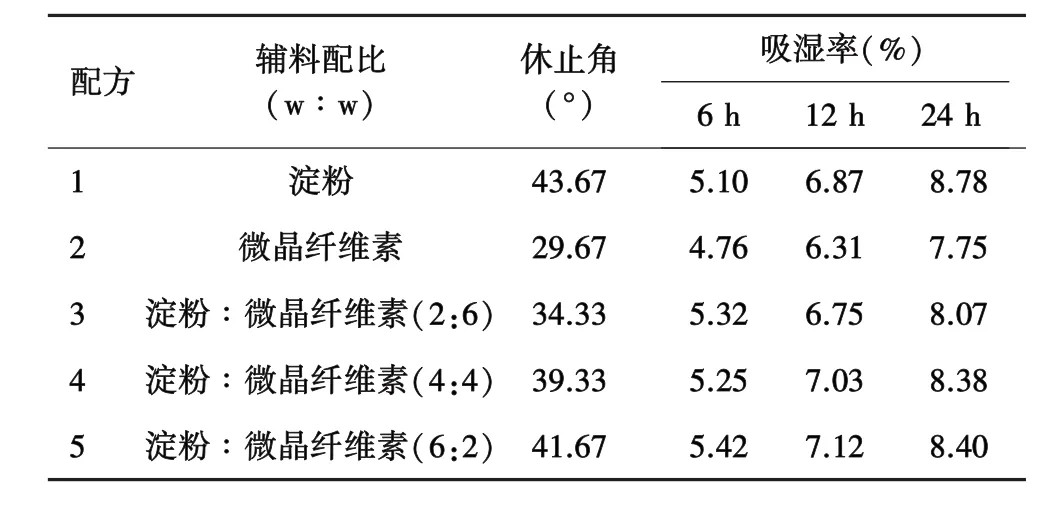
表1 不同辅料胶囊颗粒的休止角及吸湿率考察
2.2.2 吸湿率的测定 将底部盛有NaCl饱和溶液的玻璃干燥器于实验前1天放入25℃恒温培养箱中。精密称取各配方,平铺于已恒重的称量瓶中,厚度约为2 mm,置于相对湿度为75%的玻璃干燥器中,分别于 6 h、12 h、24 h 精密称重(表 1)。
由表1结果可知,金丝桃苷PEG固体分散体中加入辅料后,其流动性和吸湿性都有所改善。其中,以微晶纤维素为辅料时,其休止角可达到29°左右,且在75%湿度环境中放置24 h后,仍呈粉末状,吸湿率最小为7.75%。因此选择微晶纤维素为辅料制备胶囊颗粒,填充胶囊。
2.3 辅料用量的考察为了确定微晶纤维素的最佳用量,按表2配方混合固体分散体和辅料,考察不同配方的流动性和吸湿性(表2)。
由表2结果可知,随着微晶纤维素比例的增加,颗粒流动性和吸湿性逐渐改善。当置于75%湿度环境24 h后,配方1表面有黏结,说明其吸湿性过大,而其他配方均为粉末。综合分析,配方2的休止角过大,配方3和配方4的休止角尽管都符合要求,但是考虑考虑配方3中固体分散体的比例较高,利于提高胶囊的载药量,因此选择配方3为最佳配方比例,即将金丝桃苷固体分散体粉末按照质量比7∶8与辅料混合,研磨均匀,过 30目筛网,干燥,填充 0#药用胶囊。
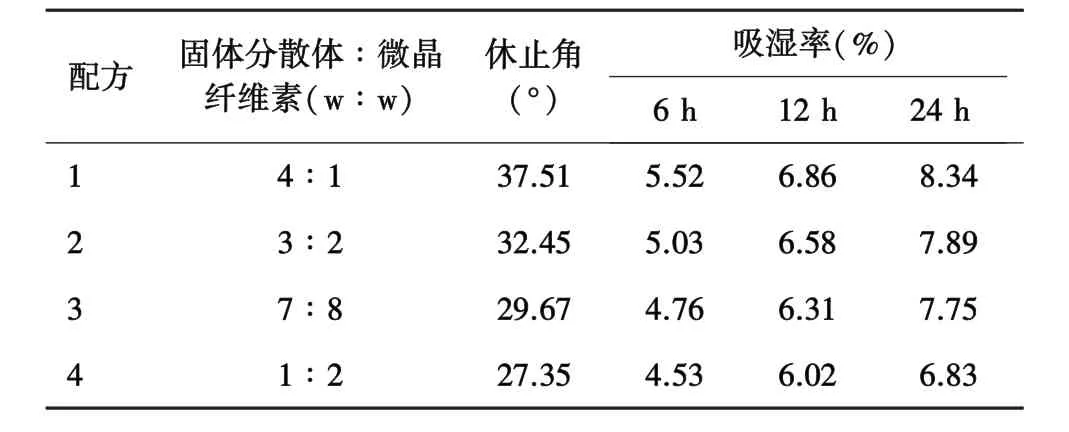
表2 不同比例微晶纤维素胶囊颗粒的休止角及吸湿率考察
3 金丝桃苷含量的测定
3.1色谱条件色谱柱:Luna C18 (150 mm×4.6 mm,5 μm 菲罗门);流动相:20%乙腈水溶液(含0.1%甲酸);洗脱方法:0~15 min,横梯度(保持流动相比例不变)洗脱;检测波长:360 nm;流速:1 mL/min;进样量:10 μL。
3.2溶液配制
3.2.1 对照品溶液的制备 精密称定金丝桃苷对照品(纯度99%)9.7 mg,置于500 mL容量瓶中,用甲醇定容,摇匀,静置,即得浓度为 19.4 μg/mL 的对照品溶液。
3.2.2 供试品溶液的配制 精密称取金丝桃苷胶囊内容物30.0 mg,研细后加入适量甲醇,超声15 min后放冷,转移至100 mL容量瓶中并甲醇定容,摇匀即得供试品溶液。
3.2.3 阴性对照溶液的制备 精密称取不含金丝桃苷的胶囊内容物 30 mg研细,按“3.2.2”供试品溶液制备方法制成阴性对照溶液。
3.3方法学验证
3.3.1 系统专属性试验 分别取对照品溶液、阴性对照溶液及供试品溶液按“3.1”的色谱条件进样,记录金丝桃苷对照品的保留时间。由结果可知,供试品中金丝桃苷与其他杂质分离度良好,在金丝桃苷相应位置处无干扰,故此色谱条件有很好的系统专属性(图 1)。
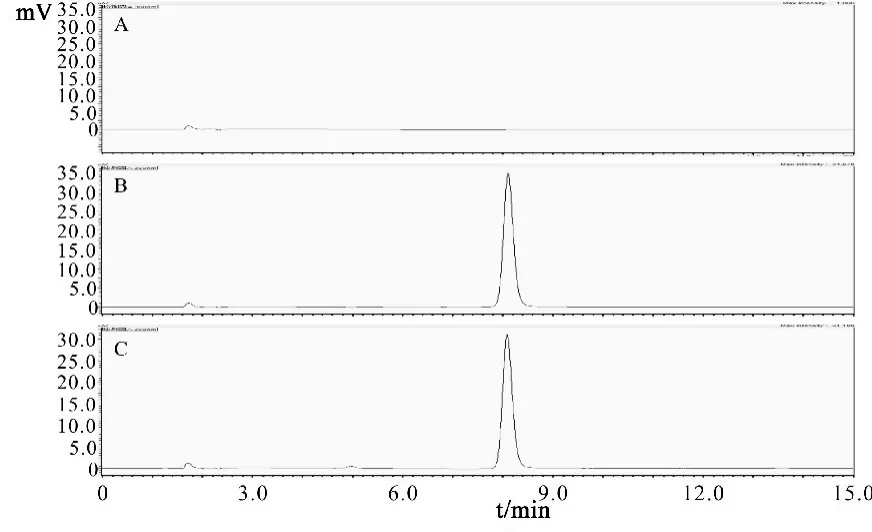
图1 金丝桃苷胶囊中金丝桃苷的HPLC色谱图
3.3.2 线性关系考察 精密称定金丝桃苷对照品10.0 mg,置于10 mL容量瓶中,用甲醇定容,摇匀,静置,即得浓度为1000 μg/mL的对照品储备液。精密吸取适量对照品储备液分别置于10 mL容量瓶中,甲醇定容,摇匀,配制成9个不同浓度的对照品溶液(1.5、3、6、9、12、15、18、22、25 μg/mL),依次按“3.1”进样分析。以峰面积(y)为纵坐标,浓度(x)为横坐标(μg/mL) ,进行线性回归,得回归方程 Y=21 682X-2343.5,r=0.9993,表明金丝桃苷在 1.5~25 μg/mL 范围内与峰面积呈良好的线性关系(表2)。

图2 金丝桃苷含量测定标准曲线
3.3.3 精密度试验 将之前配置好的 22 μg/mL 对照品溶液按“3.1”连续进6针,计算峰面积的相对标准偏差(relative standard deviation,RSD),结果平均峰面积为471 469.3,RSD 为 0.35%,表明仪器精密度良好。
3.3.4 加样回收率试验 取已知含量的同一批号样品共 6 份,分别称取约 14.9 mg、14.8 mg、13.2 mg、13.1 mg、15.4 mg、15.4 mg,研磨均匀后置于 100 mL量瓶中,加入适量甲醇超声30min,放冷,再加入金丝桃苷对照贮备液(19.4 μg/mL)50 mL,加甲醇定容,摇匀。按“3.1”色谱条件测定金丝桃苷的含量,计算回收率(表3),金丝桃苷总平均回收率为98.7%,总RSD=0.4% (n=6),符合要求。

表3 加样回收试验结果
3.3.5 定量限的测定 将金丝桃苷对照品溶液进行稀释,信噪比约为10∶1确定其定量限,结果得出定量限为 0.75 μg/mL。
3.3.6 稳定性试验 精密量取金丝桃苷胶囊内容物30 mg,置于 100 mL 容量瓶中,按“3.2.2”制备供试品溶液,分别于 0、2、4、6、8、10、12 h 按“3.1”进样分析,以金丝桃苷面积计算RSD,结果测得平均积分面积为429 762.57,RSD 为 0.41%,表明样品在 12 h内稳定。
3.3.7 金丝桃苷含量的测定 分别精密量取三批金丝桃苷胶囊内容物30 mg,置于100 mL容量瓶中,按“3.2.2”项下制备供试品溶液,按“3.1”项下进样分析。 计算出金丝桃苷含量为67.08 mg/g(表4)。

表4 金丝桃苷胶囊中金丝桃苷的含量测定结果(n=3,mg/g)
4 讨论
本研究采用研磨法可简便、有效地制备难溶性药物金丝桃苷固体分散体胶囊。通过不同辅料对金丝桃苷固体分散体吸湿性的考察,发现含淀粉颗粒吸湿性较高,稳定性较差,而单独使用微晶纤维素作为辅料流动性好、吸湿度较低,因此采用微晶纤维素作为制备固体分散体胶囊的辅料。我们推测,在体内,金丝桃苷被可溶性的微晶纤维素包围,使难溶性的金丝桃苷具有良好的可润湿性,遇胃肠液后,微晶纤维素很快溶解,药物被润湿,因此溶出速率与吸收速率均相应提高。然而具体结果有待于实验的证明,后期研究中我们将对其体内释药特征进行深入研究。此外,由于高度分散的金丝桃苷被足够的微晶纤维素分子包围,使其不易形成聚集体,保证了药物的高度分散性,加快药物的溶出与吸收[15-16]。 为了便于金丝桃苷固体分散体胶囊剂的质量控制,本研究建立了该制剂金丝桃苷含量的HPLC检测方法,该方法专属性强、准确可靠,具有较高的抗干扰能力,可以作为金丝桃苷胶囊的质量控制方法。
