MTA1基因同小细胞肺癌生物学行为的相关性研究
2018-11-07薛洪省李建新钱海利赵志龙
薛洪省,韩 丽,李建新,钱海利,赵志龙
(1大连大学附属中山医院,辽宁大连116600;2中国医学科学院肿瘤医院,分子肿瘤学国家重点实验室,北京100021)
0 引言
肺癌作为人类癌症致死的首要原因,其中小细胞肺癌(small cell lung cance,SCLC)约占肺癌总数的13%[1],对于老年抽烟患者是一种死亡率较高的疾病。其肿瘤细胞生长迅速、早期转移以及早期对化疗药物出现耐药等问题均可以影响临床治疗效果。近40年间,无论外科手术还是化学药物在预后方面均未取得满意效果[2]。通过对SCLC分子生物学的研究,其恶性生物学行为逐步被揭示,新的化学药物以及靶向药物已经成为研究热点。
肺癌形成是由于在基因转录过程中碱基异常错配所引起的长期累积结果。在多种恶性性肿瘤中均普遍高表达肿瘤转移相关蛋白1(metastasis associated protein 1, MTA1)[3-4]。 MTA 家族包括 6 个不同亚型,分 别 为: MTA1、 MTA1s、 MTA1⁃ZG29p、 MTA2、MTA3及 MTA3L[5]。MTA1作为染色质核重塑和核小体去乙酰化物复合体(NuRD复合体)成员之一,主要通过调控靶基因染色质重构影响基因转录[6]。研究[7]提示,人类多种恶性肿瘤如乳腺癌、口腔鳞癌、食管鳞癌、结肠癌、非小细胞肺癌(non⁃small cell lung cance,NSCLC)均与MTA1过表达密切相关。然而,SCLC中有关MTA1研究尚少,主要发病机制尚未明确。为了研究SCLC中MTA1的表达及功能机制,我们通过人SCLC及正常肺组织芯片、肺癌细胞株及MTA1转基因小鼠探索MTA1在体内外的表达、功能及作用机制。
1 材料和方法
1.1 SCLC及正常肺组织石蜡包埋组合芯片芯片中包含SCLC组织40例,正常肺组织10例,每张芯片中包含2点相同的组织标本(西安艾丽娜生物公司、附TNM和临床分期)。
MTA1和 SOX2染色强度评分:0(阴性)、1(弱阳性)、2(中阳性)、3(强阳性);MTA1 和 SOX2 染色阳性细胞百分比评分:0(0%~10%)、1(>10%~25%)、2(>25%~50%)、3(>50%~75%)、4(>75%~100%)。染色评分为染色强度评分和染色阳性细胞百分比评分的乘积[8]。>8分为强表达,≤8分为弱表达。
1.2 细胞系及培养条件人SCLC细胞系NCI⁃H446,人 NSCLC 细胞系 NCI⁃A549 和 NCI⁃H1650,均由中国医学科学院肿瘤医院分子肿瘤学国家重点实验室保存并提供。细胞培养基为含10%小牛血清、盘尼西林(100 U/mL)、链霉素(100 mg/mL)的 RPMI 1640。细胞孵育在含有5%CO2,37℃的湿润培养箱中。
1.3 MTA1小干扰RNA转染MTA1小干扰RNA(MTA1⁃siRNA)和阴性对照 siRNA(NC⁃siRNA,上海吉玛制药技术有限公司)按照试剂操作说明书进行,其中空白对照组(mock)为仅加入Lipofectamine2000(Invitrogen公司)转染试剂。
1.4 聚合酶链反应(PCR) 使用Trizol试剂按照试剂操作说明提取细胞RNA。MTA1扩增的有义引物5′⁃CAGCTACGAGCAGCACAACG⁃3′和 反 义 引 物 5′⁃TGTCCGTGGTTTGCCAGA⁃3′。 内参磷酸甘油醛脱氢酶(GAPDH)的有义引物 5′⁃GGTGGTCTCCTCTGACT⁃TCAACA⁃3′和 反 义 引物 5′⁃GTTGCTGTAGCCAAAT⁃TCGTTGT⁃3′。 PCR 条件:预变性 94℃ 60 s,40 个循环,94℃ 60 s,60℃ 30 s,72℃ 30 s。
1.5 免疫印迹分析(western blot) 组织及细胞蛋白提取、浓度测定、凝胶电泳、转膜、封闭后分别与抗MTA1多克隆抗体(1 ∶1000,Abcam),抗⁃β⁃actin 单克隆抗体(1 ∶10000,Abcam),抗 E⁃cadherin 多克隆抗体(1 ∶1000,Abcam),抗⁃PARP 多克隆抗体(1 ∶1000,Cell Signaling),抗⁃puma 多克隆抗体(1 ∶1000,Cell Signaling),抗⁃CyclinD1 多克隆抗体(1 ∶500,BIO⁃WORLD),抗⁃CyclinE1 多克隆抗体(1 ∶500,BIO⁃WORLD),抗⁃SOX2 多克隆抗体(1 ∶1000,Abcam),抗⁃OCT4多克隆抗体(1∶1000,Abcam)进行封闭杂交,然后分别和对应的辣根过氧化物酶标记的二抗(1∶5000)室温杂交孵育,最后通过 LAS⁃4000自动曝光系统进行结果检测。
1.6 细胞增殖实验将3×103细胞/孔接种于含有完全培养基中的96孔细胞培养板中,待细胞贴壁后,将培养基更换为100 μL的不含血清培养基及10 μL的MTS试剂混合液,37℃培养箱中孵育2 h,最后利用酶标仪测定培养板各孔在λ=490 nm处的吸光度。
1.7 细胞克隆实验使用完全培养基将收获转染48 h后的细胞悬浮成1×103个细胞/mL,然后在6孔板中分别加入0.5 mL的悬浮液及2.5 mL完全细胞培养基,摇匀后静置于培养箱中10 d,然后用含0.2%结晶紫染料固定染色10 min,在凝胶成像系统下拍照分析。
1.8 免疫组化组织固定、包埋、切片后经烤片、石蜡脱水、抗原修复、冲洗、封闭。加入抗MTA1多克隆抗体(1 ∶100,Abcam)、抗 SOX2多克隆抗体(1 ∶100,Abcam)4℃避光孵育过夜,洗涤后取PV⁃9000 Immu⁃no⁃Bridge免疫组化试剂盒(北京中杉金桥生物公司)按照操作说明书进行。进行DAB显色。显色充分后终止反应。复染、反蓝、脱水、中性树脂封片。
1.9 转基因小鼠MTA1转基因小鼠由中国医学科学院肿瘤医院分子肿瘤学国家重点实验室保存并提供,实验室使用许可证[SYSKS(京)2008⁃0025]。 动物实验得到中国医学科学院肿瘤医院实验动物研究所实验动物使用与管理委员批准(ILAS⁃002),MTA1转基因小鼠具体制备步骤见文献[9]。
1.10 统计学处理统计学分析采用均值和T检验,P<0.05表示差异有统计学意义。
2 结果
2.1 SCLC组织和细胞中MTA1呈高表达状态在SCLC细胞NCI⁃H466中,通过 PCR及 western blot检测到MTA1高表达,且较NSCLC细胞系NCI⁃A549及NCI⁃H1650表达水平显著增高(图1A)。利用包括40例SCLC组织和10例正常肺组织的组织芯片(图1B),进行免疫组化染色,显示SCLC中的MTA1表达评分较正常肺组织显著增高(P=0.003,图 1C)。同时,SCLC 组织 MTA1表达在性别(P=0.399)、年龄(P=0.999)、肿瘤分期(T 分期:P =0.478、N 分期:P=0.814、M 分期:P = 0.119)各亚组中无显著差异(表 1)。
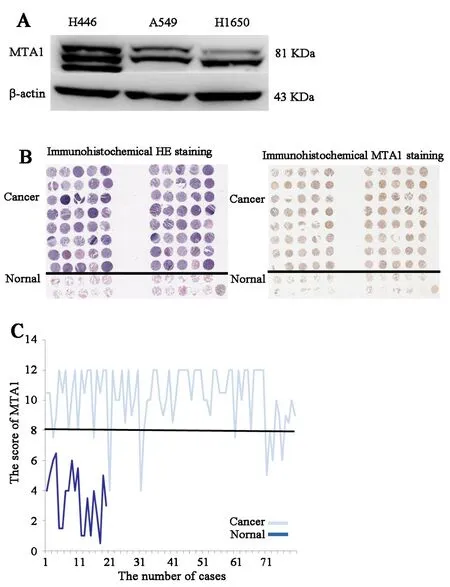
图1 SCLC组织芯片及细胞系中MTA1呈高表达状态
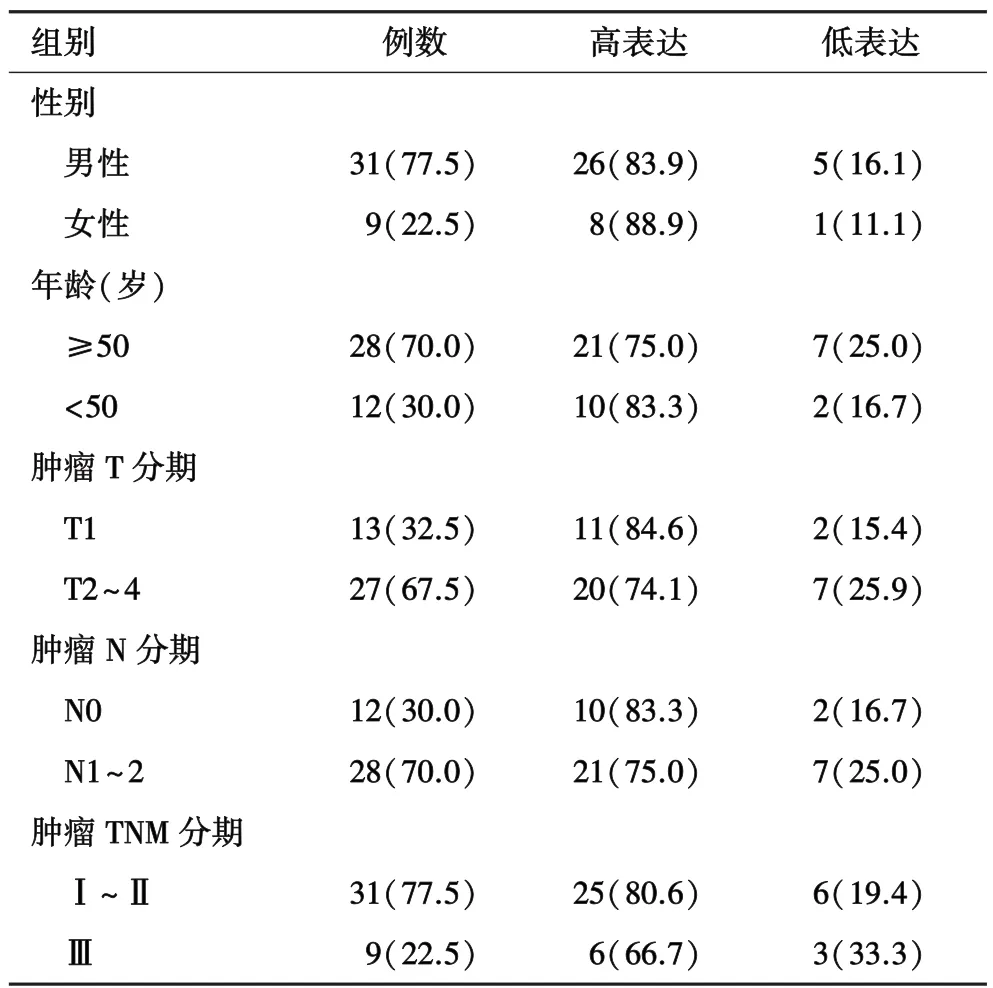
表1 MTA1蛋白表达与SCLC患者临床病理特征的关系[n(%)]
2.2 下调MTA1表达后,SCLC细胞增殖能力明显下降对比 NC⁃siRNA组,MTA1⁃siRNA组的 SCLC细胞中MTA1表达水平明显下调(图2A、B),同时,SCLC细胞增殖能力(P=0.022)和细胞克隆形成能力(P=0.038)显著降低(图 2C、D)。
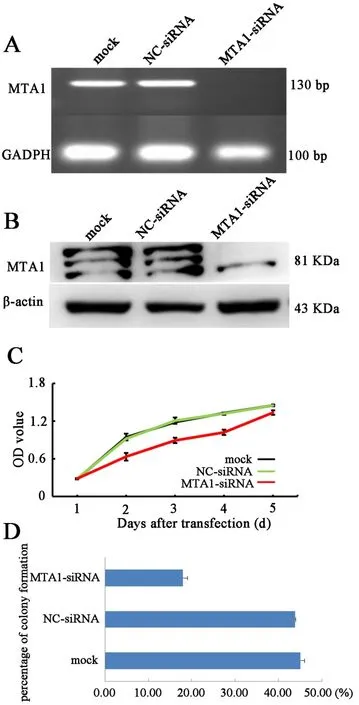
图2 下调MTA1表达后,SCLC细胞增殖能力明显下降
2.3 MTA1表达下调后,SCLC细胞恶性生物学能力显著下降对比 NC⁃siRNA 组,MTA1⁃siRNA 组SCLC细胞中E⁃cadherin蛋白表达量明显增高。凋亡相关蛋白PUMA表达亦明显增加,各组中周期相关蛋白cyclin E1和 cyclin D1无明显变化(图3)。
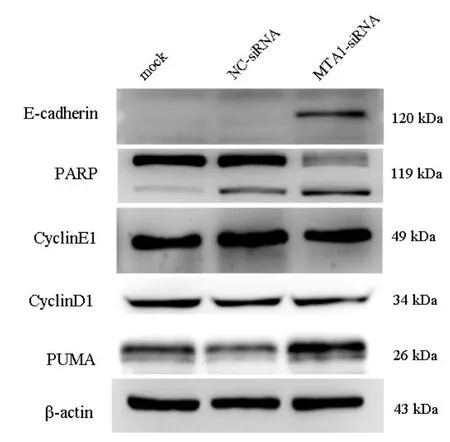
图3 MTA1表达下调后,SCLC细胞恶性生物学能力显著下降
2.4 MTA1通过调控干细胞转录因子2参与SCLC的恶性生物学进程通过检索TCGA数据库中发现肺癌中与MTA1表达呈正相关的基因约有12 000个,SOX2相关系数为0.25(图4A)。免疫组化结果对比正常肺组织,SCLC组织芯片中SOX2染色得分明显增高(P=0.015,图 4B)。 对比 NC⁃siRNA 组,MTA1⁃siRNA组SCLC细胞中SOX2蛋白表达量明显降低,Oct4表达无明显差异(图4C)。MTA1转基因小鼠肺组织MTA1和SOX2蛋白表达量均较野生型小鼠肺组织明显增高(图4D、E)。免疫组化结果提示MTA1同SOX2具有紧密的正相关性(r=0.781,图4F、G)。
3 讨论
Sasaki在 2002年首次在 74例 SCLC中发现MTA1普遍高表达。因此,推断MTA1与肺癌的侵袭和转移过程密切相关[10]。 之后,多项研究[11-14]证实MTA1在NSCLC发生发展进程中具有促进作用。MTA1作为染色质重塑及核小体去乙酰化复合体组成部分通过转录因子依赖的方式调控靶基因的转录表达[15],促进基因转录[16],增加蛋白质的稳定性[17],涉及DNA的损伤修复[18],并且正常组织中处于普遍低表达水平[19]。MTA1在肿瘤的浸润和转移方面具有重要价值,为评估肿瘤恶性程度、个体化治疗及预后判断指明了方向。
为了探索SCLC中MTA1的表达及功能,实验证实MTA1在肺癌细胞系中高表达,并且在SCLC细胞系NCI⁃H446中显著高表达。通过siRNA下调SCLC中MTA1表达,SCLC的增殖及克隆能力显著下降,揭示MTA1参与调控SCLC的生长和增殖。MTA1作为转录生长因子⁃β1的下游效应器介导 E⁃cadherin表达参与肿瘤的侵袭及转移过程,并发挥重要作用[20]。恶性肿瘤中E⁃cadherin蛋白表达缺失表现为肿瘤生长迅速、早期转移、预后不良等[21]。下调MTA1表达后E⁃cadherin表达显著上调,表明MTA1通过调控E⁃cadherin参与肿瘤细胞的侵袭转移。在DNA损伤修复方面,MTA1通过最为常见的PARP依赖途径参与DNA损伤修复[20]。本研究通过下调MTA1后PARP出现了显著的凋亡带,Puma呈高表达,提示SCLC中MTA1通过PARP依赖方式参与DNA损伤修复。恶性肿瘤中MTA1过表达可激活cyclin D1通路[23],cy⁃clin D1及cyclin E1表达无明显变化,原因可能是SCLC中MTA1调控细胞周期相关蛋白的作用机制不同。推断MTA1在不影响SCLC细胞周期的方式下参与整个肿瘤进程。
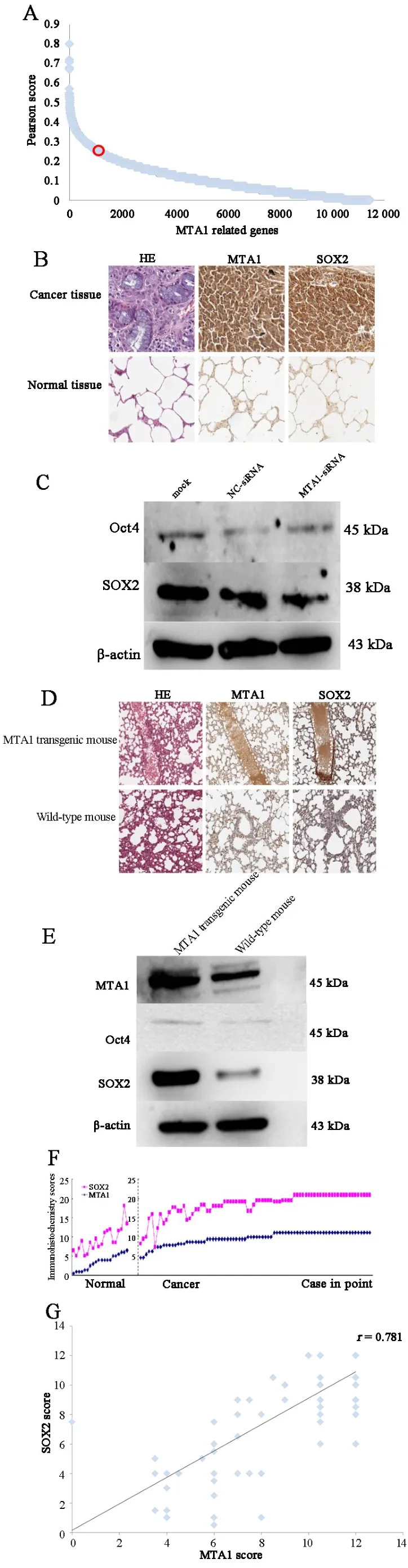
图4 MTA1通过参与肿瘤干细胞调控促进肿瘤恶性生物学行为
肿瘤发生、发展的整个过程中均涉及肿瘤干细胞[24]。SOX2作为HMG DNA结合域转录因子家族中的成员对胚胎干细胞全能性的发育起着重要作用,并与肿瘤的发生发展有关[25]。SOX2在人类食管癌、NSCLC、SCLC 中呈现普遍高表达[26-28]。 研究[29]发现SOX2参与肿瘤干细胞进程,并促进了肿瘤细胞的生长,下调SOX2表达后细胞生长受到明显抑制。既往研究[30]表明过表达MTA1和SOX2后肿瘤表现为高侵袭性及高转移性生长方式。在TCGA数据库中通过分析发现总体肺癌中MTA1与SOX2呈中等相关性。至今,在SCLC中仍没有关于MTA1与SOX2之间相互关系的可用数据。 研究[3,31-32]提示 MTA1 通过复杂的信号通路激活上皮间质转化(epithelial⁃mes⁃enchymal transition,EMT),同样有研究证实SOX2也参与了EMT过程。EMT在肿瘤干细胞特征维持方面处于基础地位,并在肿瘤侵袭转移过程中发挥重要作用[33]。SCLC组织芯片结果提示肿瘤组织较正常组织MTA1显著增高,但在性别、年龄、肿瘤TNM分期等亚组中MTA1表达无明显差异,提示SCLC中MTA1普遍高表达,亦不排除病例数少造成的统计误差。SCLC组织芯片结果提示MTA1与SOX2表达呈正相关,表明MTA1可能通过调控SOX2涉及到肿瘤干细胞的调控过程中。对比野生型小鼠,MTA1转基因小鼠肺组织中SOX2显著高表达,更进一步证实了MTA1与SOX2的正相关性。在TCGA数据库中由于包含了大量NSCLC患者进而造成二者相关性减小,而本研究数据弥补了TCGA中关于SCLC部分的空白。至此,在SCLC中提示MTA1可能通过EMT方式调控SOX2。
本研究表明在SCLC中MTA1作为关键调控因子通过调控SOX2参与肿瘤干细胞生物学进程,并且在肿瘤的增殖、凋亡方面具有显著影响。在SCLC恶性进程中发挥着重要生物学作用,这将有可能为SCLC的治疗带来新的希望。
