核桃JrCOR基因的克隆及表达分析
2018-11-05徐丽陈新张力思魏海蓉刘庆忠
徐丽,陈新,张力思,魏海蓉,刘庆忠
(山东省果树研究所/山东省果树生物技术育种重点实验室,山东 泰安 271000)
低温是限制植物分布与生长的重要环境因素之一,低温冻害是全球农林业普遍存在的自然灾害,给全世界农林业造成了巨大损失,全球每年因低温伤害造成的农作物损失高达数千亿美元,已引起各国政府和学者的普遍关注[1]。在植物响应低温胁迫的驯化过程中,体内发生着许多生理生化和分子变化[2],包括细胞和组织结构的变化、基因表达水平的变化等[3]。
1970年Weiser[4]提出植物在适应低温的过程中基因表达发生改变的观点。Guy等[5]研究发现缓慢持续的低温胁迫能诱导和增强一些基因的表达,增强植物耐寒性,这种现象称为低温冷驯化,这种由冷胁迫诱导而表达的基因称为冷诱导基因(cold regulated gene,COR)。这类基因所表达的蛋白称为低温诱导蛋白。冷诱导基因编码的产物可以分为两类,一类是调控性蛋白,调控寒冷信号传导、抗寒基因表达和抗寒蛋白活性;另一类是与植物抗寒性提高直接相关的功能性蛋白,比如一些涉及脂类代谢、糖代谢以及抗氧化的酶、分子伴侣、抗冻蛋白和其它起渗透调节作用的物质[6]。
脱水素(dehydrins,DHNs)属于胚胎发育晚期丰富蛋白(late embryogenesis abundant proteins,LEA),是一种亲水性蛋白,属于LEA蛋白的第二家族[7]。脱水素显著的特征是在C端或其附近含有至少一个富含赖氨酸的基序,由约15个氨基酸残基(EKKGIMDKIKEKLPG)组成的K片段,此片段在不同物种间极为保守;N端含有保守基序T/VDEYGNP组成的Y片段,K片段与Y片段之间有可被磷酸化的约6个丝氨酸串联成的S片段。所有的脱水素不一定含有Y和S片段,但都含有K片段,它是第二组LEA区别于其它组的特征[8,9]。低温是限制植物生长和影响产量的主要非生物逆境之一,脱水素在抵御低温等非生物胁迫过程中发挥着重要作用[10]。有研究表明过量表达脱水素基因可增强拟南芥的低温抗性,提高抗寒力[11];Kosová等[12]发现低温锻炼后,10个大麦品种中Dhn5基因的积累量与其抵御冻害的能力呈正相关;小麦脱水素WCS120的积累量与其获得的冰冻抗性呈正相关,可以区分不同冬小麦品种的冰冻抗性强弱[13,14];酒红杜鹃和云锦杜鹃杂交后代叶片中脱水素基因的表达与其抗冻能力密切相关[15]。
核桃(Juglansregia)又名胡桃、羌桃、波斯胡桃或英国胡桃,是胡桃科(Juglandaceae)胡桃属(Juglans)的一种植物。核桃作为我国具有很高经济价值的经济林树种,在北方地区的气候中,冬春季经常受到寒流和冷空气的侵袭。低温冻害是影响核桃生长发育以及造成其产量和质量下降的主要胁迫因素之一,在寒害发生严重的年份,可以造成核桃大面积减产甚至地区性核桃绝收,导致巨大经济损失。而我国南方的核桃品种与北方核桃品种相比,抗寒性更差,因此将南方核桃品种引种到北方种植面临严重的寒害问题,多数南方核桃品种因低温侵害而冻死。因此对核桃进行低温、抗寒的研究在理论和实践上都有重要意义。
本研究通过RACE技术克隆了与低温胁迫相关的核桃脱水素基因JrCOR的全长序列,分析了该基因在低温胁迫下的表达模式,为将其进一步应用于核桃抗寒分子标记辅助育种提供参考依据,为利用基因工程手段培育抗寒核桃新品种奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 植物材料与处理 试验所用核桃材料取自于山东省果树研究所国家核桃资源圃。
材料处理:(1)为研究在人工可控条件下JrCOR基因的表达,将山东省果树生物技术重点实验室保存的香玲核桃组培苗放入光照箱中适应2 h以上(光照强度100 μmol·m-2·s-1,光照时间16 h/8 h,昼夜温度25℃/21℃,湿度80%~90%),然后进行4℃低温胁迫处理,分别在处理0、2、4、8、24 h后采集叶位相同的叶片,用于研究JrCOR基因响应低温的表达模式。(2)参照Naik等[16]的方法(稍作修改),分别于2014年11月15日(处于未进入冷适应时期,NC,non-cold acclimation,日均温7℃以上)、2014年12月6日(处于冷适应时期,CA,cold acclimation,日均温7℃以下)、2015年1月6日(处于中冬时期,MW,mid-winter,日均温0℃以下)、2015年3月6日(处于脱除冷适应时期,DA,deacclimation,日均温回升至7℃以上)四个时期摘取花芽,用于研究JrCOR基因的季节表达。
1.1.2 试剂 EASYspin植物RNA快速提取试剂盒购自北京艾德莱生物科技有限公司,TaqDNA聚合酶、DNA凝胶回收试剂盒和DNaseⅠ等均购自天根公司,PCR试剂及克隆载体pMD19-T Vector均购于宝生物(大连)有限公司,荧光定量PCR试剂用品购自康为世纪公司。
1.1.3 仪器和设备 Eppendorf移液器,Eppendorf台式离心机,漩涡振荡器,金属浴仪,电子天平,超纯水仪,PCR仪,微波炉,真空抽气泵,酸度计,电泳仪,超净工作台,恒温摇床,凝胶成像仪,紫外分析仪,荧光定量PCR仪,高压蒸汽灭菌锅等。
1.1.4 PCR引物 根据GenBank中登录的脱水素蛋白保守区序列,通过DNAMAN比对人工设计简并引物,采用Primer Premier软件设计特异引物,以18SrDNA为内参基因。引物序列见表1。

表1 引物信息
1.2 试验方法
1.2.1JrCOR基因的克隆 使用EASYspin植物RNA提取试剂盒及RNase-Free DnaseⅠ纯化。利用Thermo Scientific公司RevertAid First Strand cDNA Synthesis Kit,以Oligo(dT)18为引物反转录合成cDNA第一链。利用简并引物P1和P2(表1)进行中间片段的扩增。根据已知中间片段,设计引物P3和P4(表1)进行基因3′端和5′端片段扩增。然后根据所得的序列,设计引物P5和P6(表1)进行基因ORF扩增验证。
1.2.2 生物信息学分析 利用NCBI数据库(http://www.ncbi.nlm.nih.gov/)和DNAMAN分析JrCOR核苷酸和氨基酸序列,进行同源性分析,构建系统进化树。利用在线工具ProtParam(http://web.expasy.org/protparam/)分析蛋白质的相对分子量、理论等电点、亲水性、不稳定指数Ⅱ等。
1.2.3JrCOR表达模式分析 分别提取不同季节、不同组织和低温胁迫处理不同时间的核桃材料总RNA,反转录合成cDNA第一条链作为实时荧光定量PCR(quantitative real-time PCR,qRT-PCR)的模板。以核桃18SrDNA基因为内参,以获得的JrCOR基因全长序列为模板设计一对引物P7和P8(表1),进行荧光定量分析。每个试验设3次重复,利用ABI 7500 PCR仪Sequence Detection Software(2-ΔΔCt法)和Origin 6.2软件进行数据分析。
2 结果与分析
2.1 JrCOR基因的克隆
以核桃cDNA为模板,用简并引物P1和P2进行PCR扩增,获得了中间片段约626 bp。通过RACE-PCR获得了5′端片段758 bp和3′端片段514 bp,分别与目的基因的5′端和3′端片段大小相符,且均与中间片段重叠。根据所获得的中间片段、5′端片段和3′端片段拼接出基因全长序列,设计全长扩增引物进行PCR扩增得目的片段(图1)。利用NCBI ORF Finder可知,该基因全长1 156 bp,5′UTR为176 bp,3′UTR 239 bp,ORF为741 bp,编码246个氨基酸。具有一个明显的S区域特征位点和两个K区域特征位点,因此属于LEA蛋白的第二家族SK2类型[10](图2)。
2.2 生物信息学分析
通过在线软件Protparam预测,蛋白质的分子式为C1241H1969N337O426S2,分子量为58.1 ku,理论等电点(pI)为5.28,总体亲水性(GRAVY)为-1.673,属于亲水蛋白,不稳定指数Ⅱ为51.53,属于不稳定蛋白。选择同源性较高的几个物种进行进化树比对,如图3所示,同属的葡萄柚和橙聚为一束,同属于蔷薇科的苹果与枇杷聚为一束,核桃与中粒咖啡亲缘关系较近,符合APG分类系统(图3)。
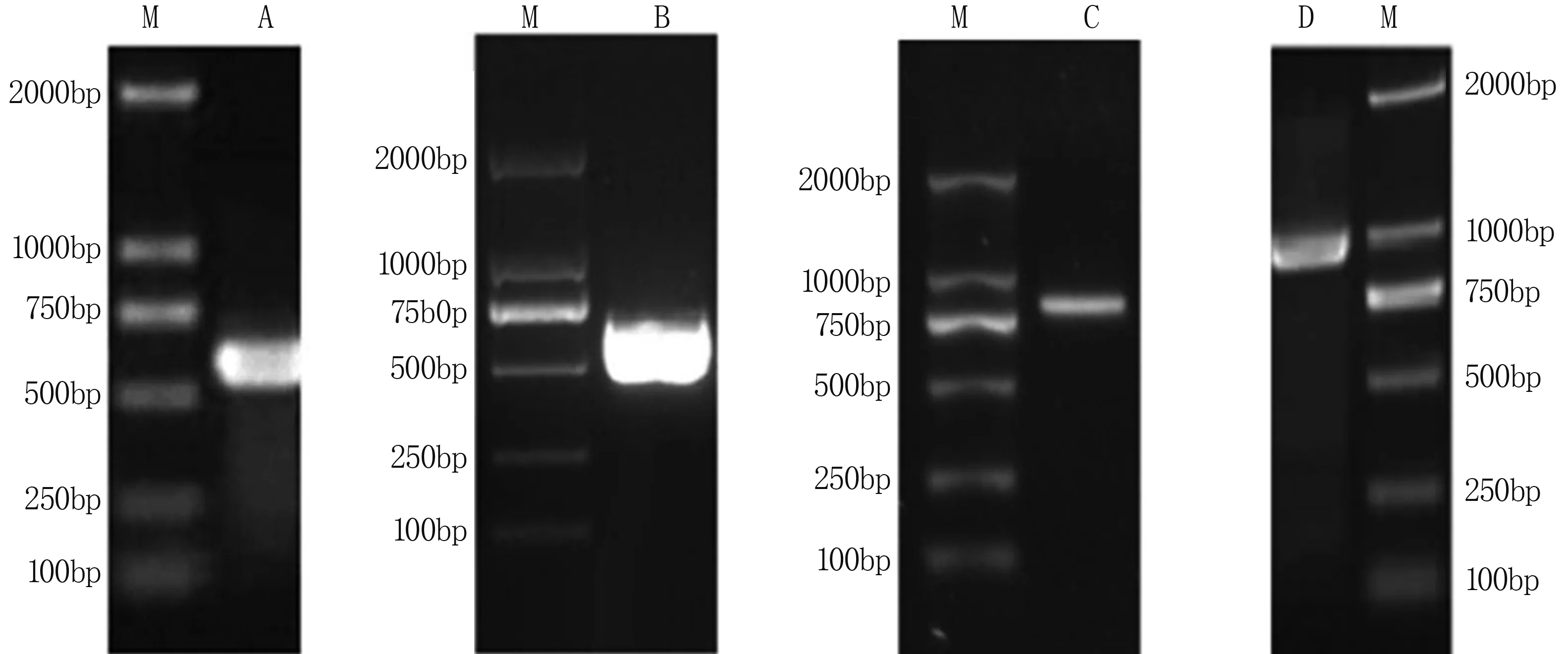
A:中间片段;B:3′RACE片段;C:5′RACE片段;D:全长cDNA片段;M: DL2000 Maker。

氨基酸序列以单个字母表示。下划线为转录起始密码子ATG;星号标记为终止密码子TAA;方框部分表示S区域特征位点;阴影部分表示K区域特征位点。
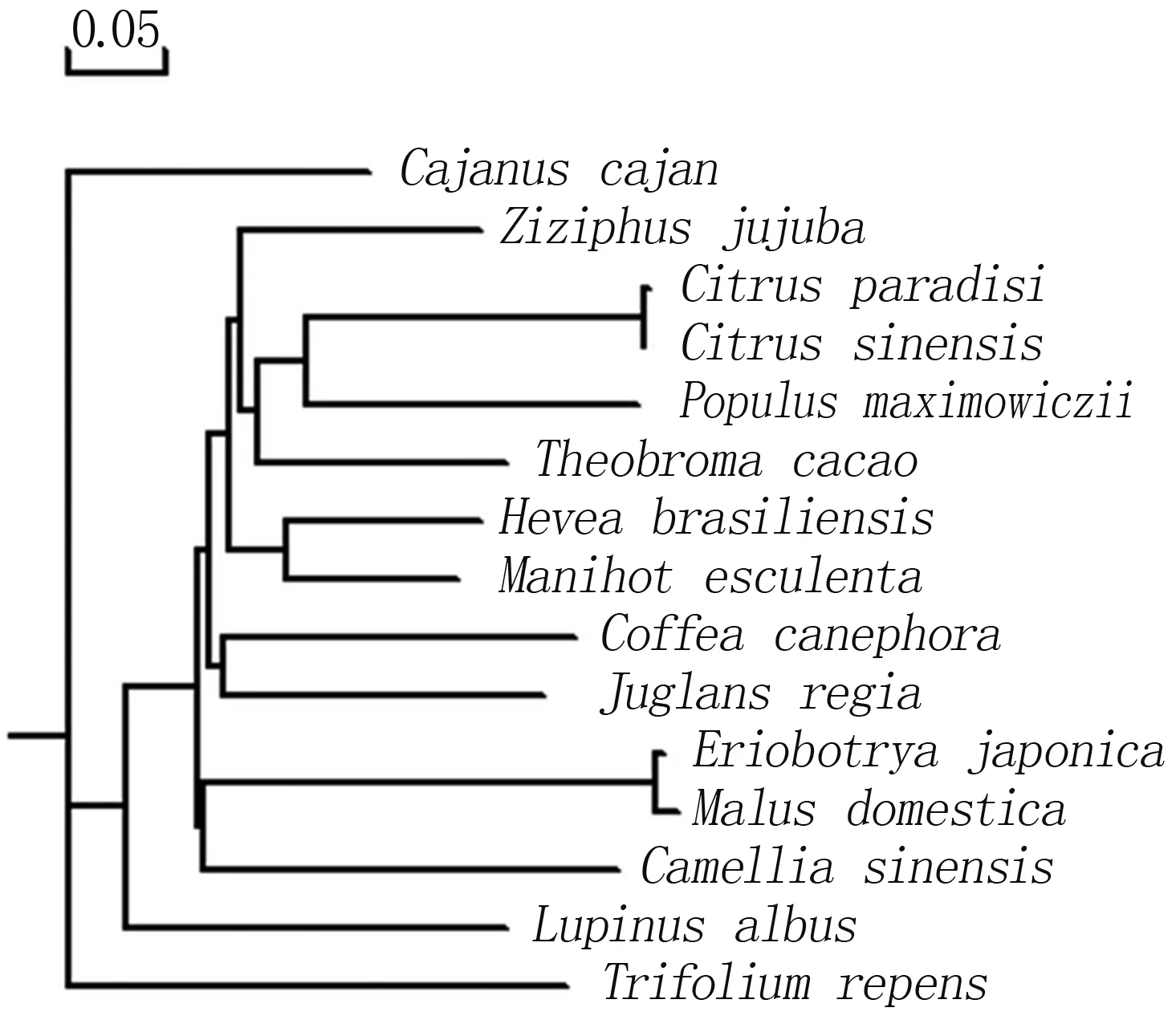
橡胶树Hevea brasiliensis (ANG59272.1.);木薯Manihot esculenta(AGC51777.1);枣Ziziphus jujube(XP_015884105.1);木豆Cajanus cajan(XP_020216079.1);中粒咖啡Coffea canephora(ABC68275.1);辽杨Populus maximowiczii(ABS12346.1);苹果Malus domestica(NP_001315938.1);葡萄柚Citrus paradise(AAN78125.1);枇杷Eriobotrya japonica(AGV21054.1);白羽扇豆Lupinus albus(AAT06600.2);山茶Camellia sinensis(ACT10283.1);白车轴草Trifolium repens(ADD09608.1);橙Citrus sinensis(XP_006473752.1);可可Theobroma cacao(EOY15190.1)。
系统进化树分析
2.3 JrCOR基因不同时期的表达变化
通过荧光定量PCR对不同季节核桃花芽中JrCOR基因的表达模式进行分析,发现在自然越冬条件下,JrCOR基因的总体表达趋势表现为随着冬季气温的降低,JrCOR基因的表达量升高,而进入春季气温回升后,JrCOR基因的表达量降低(图4)。对前面两个时间的对比可以发现,JrCOR基因的表达量会随着气温的变化而有所波动;第三个取材时间是在小寒和大寒节气之间,这个阶段的气温很低,JrCOR基因的表达水平相对较高,以保证核桃的抗寒性足够越冬;第四个取材时间是惊蛰节气过后,气温已经回升,JrCOR基因表达水平相应降低,因此后面两个时间点的JrCOR基因表达水平差异相对较大。
2.4 JrCOR 基因低温胁迫条件下的表达变化
从低温胁迫处理下JrCOR基因表达结果来看,经4℃低温处理不同时间后,JrCOR基因表达量不同,随处理时间延长呈先升后降趋势,这可能与该基因在冷胁迫过程中所行使的功能有关(图5)。4℃处理2 h时,JrCOR基因表达量迅速增加,表明JrCOR基因受低温诱导。随后其表达量继续升高,在处理4 h时表达量到达高峰。4℃处理8 h时JrCOR的表达降至较低水平,与未处理和处理24 h时的表达量接近。
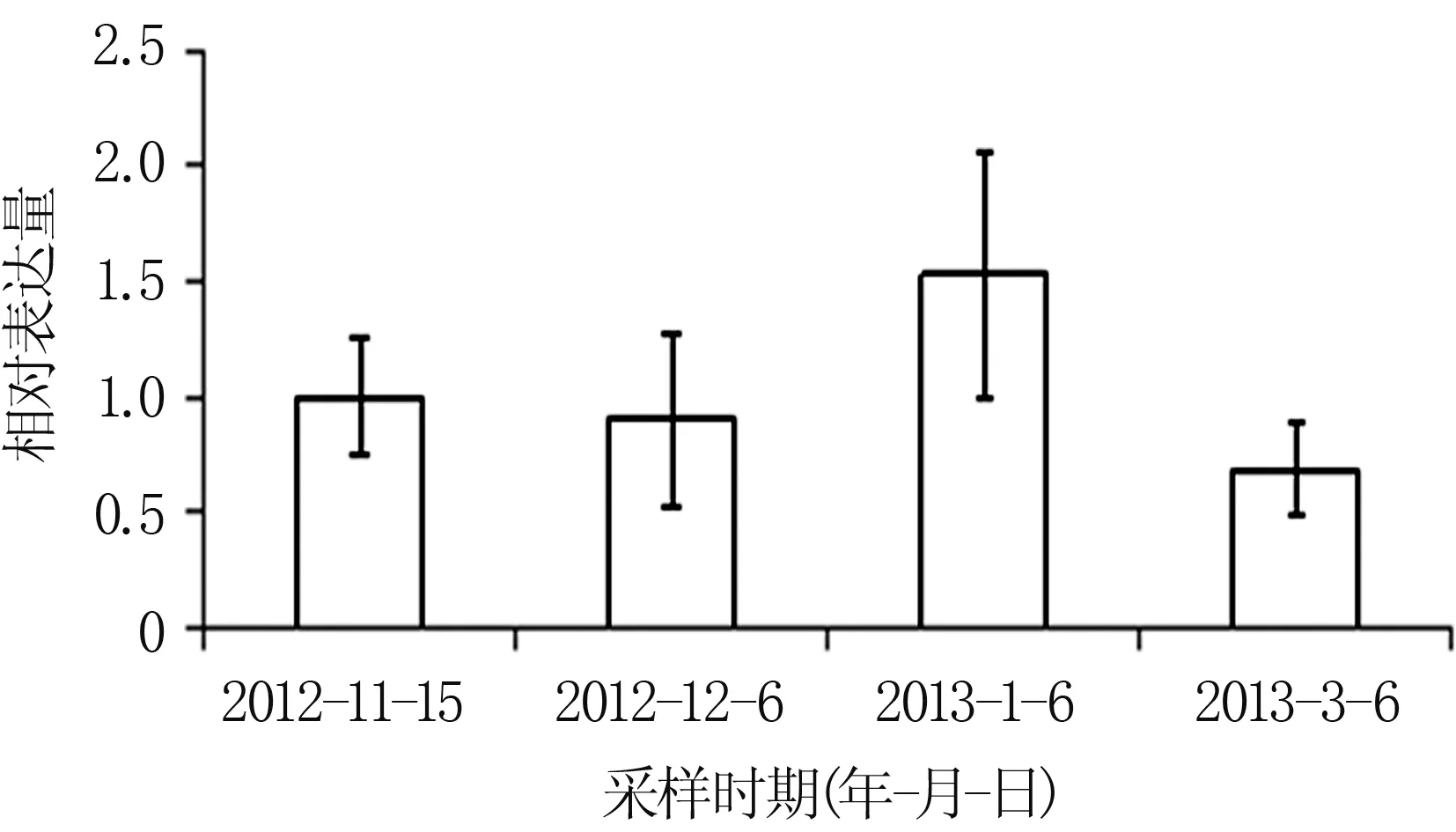
图4 不同时期核桃花芽中JrCOR基因的表达模式
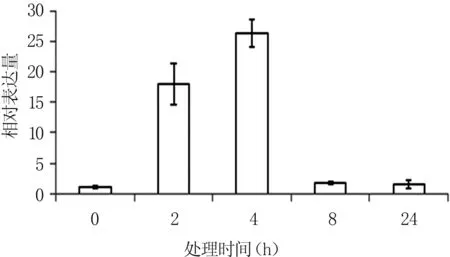
图5 核桃叶片JrCOR基因在低温胁迫条件下的表达模式
3 讨论与结论
本试验选取核桃品种‘香玲’为研究对象,是因为香玲品质优良,具有较高的经济价值和推广前景。通过同源克隆的方法获得JrCOR基因全长序列,其具有明显的S区和K区,属于典型的SK2型脱水素基因。进化分析结果也符合传统分类学的标准。在表达分析的研究中,荧光定量PCR结果表明越冬过程中JrCOR基因的表达水平存在变化,总体趋势是冬季气温降低表达水平上升而进入春季气温升高表达水平下降,可能是因为其表达与低温诱导关系显著,这与本课题组先前的研究结果相似[17]。
低温胁迫处理的荧光定量PCR结果显示,在模拟低温环境下处理2 h时,JrCOR的表达水平迅速升高,4 h时达到最大值,说明核桃JrCOR基因受低温胁迫的诱导,而且能快速响应低温胁迫,这种快速响应低温信号的结果和陈新[18]在榛子上的研究结果一致。
本试验对核桃抗寒基因JrCOR进行了初步研究,为增强核桃类植物的抗寒性和培育有较强抗寒能力的核桃品种提供了分子水平的理论依据。后续可继续开展构建表达载体,在核桃组织中超表达目的基因,以探究其过量表达对核桃某些性状的影响,检测核桃的抗寒性;另还可以对该基因的表达产物进行更细致的蛋白质结构以及其功能相关方面的研究。
