肿瘤坏死因子α对心房神经丛功能和房颤阈值的影响
2018-11-02王猛王振亚邓洁琳孟冠南黄兵余锂镭江洪
王猛 王振亚 邓洁琳 孟冠南 黄兵 余锂镭 江洪
430060 武汉大学人民医院心内科 武汉大学心血管病研究所 心血管病湖北省重点实验室
心房颤动是临床最常见的快速性心律失常之一,而其发病机制尚不明确。目前研究表明,心外膜心房自主神经节(ganglionated plexi,GP)是内源性自主神经的重要组成部分,在心房颤动的触发及维持中发挥着重要作用,心脏自主神经节活性的增高可以诱发心房颤动,而抑制其活性可以抑制心房颤动的诱发及维持[1-3]。既往研究表明,炎症在心房颤动的触发及维持中也发挥着重要作用,心房颤动患者血清中肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、白细胞介素(interleukin,IL)和C反应蛋白(C-reaction protein,CRP)等炎症因子水平显著升高[4-5]。TNF-α作为一种重要的促炎因子,在各种炎症性疾病中均发挥着重要作用。然而,目前关于TNF-α与心房颤动之间关系的潜在机制尚未明确。因此,笔者假设TNF-α可通过增强GP的活性参与心房颤动的发生和维持,通过将微量TNF-α注入心房右前GP(anterior right ganglionated plexi,ARGP)中,来探讨其对ARGP功能、对右心房和右肺静脉心房颤动阈值(atrial fibrillation threshold,AF-TH)的影响。
1 材料与方法
1.1 实验分组与处理
本研究经武汉大学动物实验伦理委员会审核并批准(伦理号:04120A),由武汉大学人民医院动物实验中心提供健康成年雄性家犬14只(体重15~18 kg)。采用随机数字表法将14只雄性家犬分为两组:实验组(7只)及对照组(7只);所有犬均以戊巴比妥钠30 mg/kg体重经静脉进行麻醉,术中每小时末以2 mg/kg体重维持麻醉状态。开通股动静脉通道,股动脉穿刺连接压力换能器持续监测血压,股静脉持续滴注生理盐水补充丢失体液,气管置管连接小型动物呼吸机维持正压通气,持续记录体表标准肢体导联心电图。
实验犬取左侧卧位,经右侧第4肋间开胸,剪开心包,暴露心脏。将3根多极导管分别缝合于右上肺静脉、右下肺静脉和右心房等处用于起搏及记录。所有信号均通过LEAD-7000多导电生理记录仪系统(四川锦江电子公司)显示。
1.2 TNF-α及生理盐水注射
于右上肺静脉和右心房连接处确认脂肪垫中ARGP所在位置,分别将电极导管置于脂肪垫发放高频刺激(high-frequency stimulation,HFS)(频率20 Hz,脉宽0.1 ms,15 V),引起心率减慢最显著处即为ARGP所在位点。既往研究表明,经静脉注射8 μg/kg的TNF-α即可引起心房纤维化的发生,而将0.1 mg/ml的TNF-α注入下丘脑室旁核的神经元可引起交感神经的激活[6-7],因此,本实验选择在直视状态下将0.1 ml TNF-α(0.1 mg/ml)在1 min内分4个不同位点缓慢注入实验组犬ARGP内,而对照组注入等体积的生理盐水。
1.3 ARGP功能测定
通过HFS刺激ARGP确定引起心率-电压反应最敏感的部位,将直径0.1 mm的刺激电极一端插入ARGP,另一端连接刺激仪(Grass,美敦力,S88),从5 V电压起始进行电压递增式HFS(20 Hz,0.1 ms),刺激时间为10 s,间隔为30 s,刺激以5 V电压间隔递增,直至30 V电压。进行HFS时引起窦率减慢的最大值作为ARGP的功能指标[8]。
1.4 ARGP神经活性测定
通过HFS(20 Hz,0.1 ms)刺激ARGP引起心率减慢最明显处为最佳记录位点,将3个镀钨微电极用微型固定器并列固定,微电极尖端距离调整为2~3 mm,将尖端插入ARGP记录神经活性,另一端连接Powerlab生理记录仪(8/35,AD Instrument,澳大利亚)。神经活性信号定义为高于噪声振幅3倍的记录信号,信噪比大于3且稳定后,在基础状态和注入TNF-α或生理盐水30 min后持续记录30 s的ARGP活性[9]。
1.5 AF-TH测定
以2倍起搏阈值电压,起搏周长为330 ms进行心房起搏,在心房起搏后2 ms心房有效不应期内发放40 ms时长的HFS(200 Hz,0.1 ms),HFS电压以1 V起始,1 V递增HFS刺激,每次刺激持续20 s,一旦诱发快速触发电位,HFS立即停止以便观察能否诱发心房颤动,各位点可诱发出心房颤动的最低HFS电压水平即定义为各位点的AF-TH[9-10]。心房颤动定义为>500 次/min的不规则的心房激动并伴随不规则的方式传导,持续时间>5 s。

表1 两组不同刺激电压下干预前后对最大心率减慢的影响
注:与基础状态比较,aP<0.01;与对照组比较,bP<0.01
1.6 统计学方法
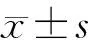
2 结果
2.1 在不同刺激强度下ARGP引起的最大心率变化百分比
与基础状态相比,注入TNF-α 30 min后,HFS刺激ARGP引起的心率减慢最大改变百分比显著增强。以15 V刺激电压为例,实验组引起心率减慢的最大幅度由18.4%±5.5%增加至32.7%±6.8%(P<0.01),而对照组引起心率减慢改变未见明显变化(17.4%±5.3%比 16.8%±5.8%,P=0.08),见表1。
2.2 TNF-α对ARGP神经活性的影响
与基础状态比较,实验组干预30 min后ARGP的神经放电频率及振幅均显著增加,而对照组无明显改变,见表2。
2.3 TNF-α对心房各位点AF-TH的影响
与基础状态比较,实验组干预30 min后各位点的AF-TH显著降低(均为P<0.05),而对照组所有位点的AF-TH均无明显变化(均为P>0.05),见表3。
3 讨论
自主神经系统主要包括外源性和内源性自主神经系统,在心律失常的发生和维持中发挥着重要作用。Hou等[11]在研究中发现,GP是外源性和内源性自主神经系统的集成中心,增加其活性能降低心房的电生理稳定性并增加心房颤动的可诱导性。此外,我们团队在快速心房起搏的心房颤动模型中发现,GP活性显著增高并伴随GP的电重构和心房的结构重构,而电重构与结构重构相互促进,在心房颤动的诱发及维持中发挥着重要作用[12]。基础实验及临床研究发现,在心房颤动的发生过程中,心房组织中TNF-α的表达量显著增加,而TNF-α水平的增加可以导致心房的电重构和结构重构[13],因此,TNF-α可能通过直接或间接影响GP的活性参与房颤的发生。

表2 两组干预前后ARGP神经活性的变化
注:与基础状态比较,aP<0.01;与对照组比较,bP<0.01

表3 两组各位点AF-TH情况
注:与基础状态比较,aP<0.01;与对照组比较,bP<0.01
TNF-α被视为一种重要的内生性炎症调节因子,参与了细胞增殖、生长抑制、细胞死亡等炎症和免疫反应过程,在各种免疫及炎症性疾病中均发挥着重要的作用。在心脏中,TNF-α主要由心肌细胞、成纤维细胞和内皮细胞等生成,是重要的促炎因子,可促进IL-6、IL-1等炎症因子的产生,并协同这些炎症因子增加了心脏的炎症状态,影响心脏的收缩功能[14-15]。研究发现,TNF-α可通过引起心肌细胞离子通道和缝隙连接发生重构导致心房发生电重构,进而引起动作电位的传播和钙离子的传递异常[16]。Lee等[17]在实验中发现,经TNF-α处理的肺静脉心肌细胞出现了瞬时内向电流增加、细胞内外钠-钙交换电流增大、胞内肌浆网钙含量减少等变化,致使舒张末期细胞内钙含量增加,这些改变表明TNF-α能够增加肺静脉的致心律失常活性并损伤心肌细胞的钙调节能力,进而导致炎症相关性心房颤动的发生。此外,有研究发现TNF-α可以使心房紧密连接蛋白40的表达量下降,从而增加心房颤动的发生率[18]。而本研究进一步发现,将微量TNF-α注入ARGP后,ARGP的功能和活性显著被激活,并降低了心房的AF-TH,提示TNF-α可能通过增强GP的活性参与了心房颤动的发生和维持,这与我们的推测是相符合的。
目前,虽然肺静脉隔离及GP消融可以治疗心房颤动,但仍存在心房颤动复发、引发室性心律失常等不良反应。因此,或许未来可以通过降低体内TNF-α等炎症因子水平延缓心房的电重构和结构重构,进而抑制心房颤动的发生发展。在本研究中,我们通过向GP中局部注射TNF-α增加其炎症状态并观察心房电生理特性的变化,而在正常生理状态下TNF-α对GP活性的影响及病理状态下通过何种途径来增加GP活性的机制尚不明确,仍需进一步通过慢性实验研究明确其潜在的神经免疫机制。
利益冲突:无
