植物杆菌属(Plantibacter)菌株WZW03的分子标记与定殖促生能力
2018-11-01王志刚刘泽平胡云龙朱晓慧
王志刚,刘泽平,胡云龙,刘 虹,朱晓慧
(1.齐齐哈尔大学 生命科学与农林学院,黑龙江 齐齐哈尔 161006; 2.农业农村部华南都市农业重点实验室,广东 广州 510640)
植物根际促生菌(plant growth-promoting rhizobacteria,PGPR)能够有效提高土壤中的有效养分,并促进植物的生长发育,由于其环境友好的特性,亦被誉为化肥最有效的替代品[1]。一株高效PGPR在植物根际土壤中的定殖能力是其实现促生能力的关键[2],因此,检测PGPR的定殖情况是根际促生菌研究领域的重点工作之一[3]。用于研究PGPR在植物体内外定殖的常见标记方法有抗生素标记法、GFP(绿色荧光蛋白)标记法、DNA和RNA探针法等[4-5]。常慧萍等[6]将luxAB发光酶基因转入到AzotobacterN2106中,阐明了其在小麦根际的定殖动态;张楠等[7]采用GFP标记法对BacillusamyloliquefaciensSQR9进行标记,发现其定殖主要发生在主根、侧根及根毛区,而根尖区细菌数量较少。对PGPR菌株进行分子标记和定殖研究对于阐释其促生机制和指导生产实践具有重要意义。
植物杆菌属(Plantibacter)菌株WZW03是从西瓜根际分离获得的具有解钾能力的高效西瓜根际促生菌,在连作土壤中能够促进西瓜植株生长,改善根系结构,缓解西瓜连作障碍[8],但是其根际定殖能力和促生机制尚不明确。本实验拟采用生物法利用荧光质料POT2-RFP标记Plantibactersp. WZW03,研究转化子遗传稳定性和其在西瓜根际的定殖促生能力,为植物根际促生菌个体生态学研究提供实验参数。
1 材料与方法
1.1 供试材料
供试菌株为齐齐哈尔大学微生物实验室从西瓜根际分离获得的Plantibactersp. WZW03。荧光质粒POT2-RFP由清华大学戴俊彪教授实验室惠赠,具有氨苄西林(Amp)抗性,激发光波长为558 nm。
1.2 培养基
菌种活化与培养采用LB培养基[9],液体培养基不加琼脂。抗性LB培养基:每100 mL液体培养基中加入0.1 mL的50 mg·mL-1Amp溶液。西瓜幼苗根系对标记菌株的吸附实验采用MS半固体培养基[10]。
1.3 POT2-RFP标记
添加ddH2O配置20 μg·mL-1的POT2-RFP质粒溶液,于-20 ℃保存待用。
将Plantibactersp. WZW03活化后,接种于LB培养基,培养至D600=0.6,转移至离心管中,冰浴10 min,5 000 r·min-1离心(4 ℃)10 min,弃上清,回收菌体,加入10 mL预冷的0.05 mol·L-1CaCl2,重悬菌体,冰浴60 min,5 000 r·min-1离心(4 ℃),弃上清,加2 mL预冷的0.05 mol·L-1CaCl2,重悬菌体,用1 mL离心管分装,每份100 μL,-80 ℃保藏待用。
取20 μg·mL-1的质粒0.1 μL,加入100 μL刚解冻的菌液,轻弹混匀,冰浴30 min,42 ℃热激45 s,冰水混合物中静置2 min。向离心管中加入预热的LB培养基900 μL,30 ℃、270 r·min-1复苏2 h,取100 μL涂布于带有抗性(50 μg·mL-1Amp)的LB平板,同时取100 μL解冻的原菌液梯度稀释涂布于LB平板上作为对照,培养48 h计数,计算转化率。
1.4 基因标记菌株检测
挑取生长在含Amp的 LB平板上的转化子单菌落涂布到载玻片上,经过固定处理后使用共聚焦显微镜拍照,通过检测菌株是否具有红色荧光以判断POT2-RFP基因是否表达。将转化后生长在含Amp的LB平板上的转化子单菌落接种于含Amp的LB抗性液体培养基中,于30 ℃、120 r·min-1条件下培养至D600=0.6,5 000 r·min-1离心去上清,菌体沉淀使用无菌水进行悬浮,并通过荧光分光光度计(日立F-7000)对悬浮液进行分析(激发光波长为558 nm)。
1.5 标记菌株的遗传稳定性
将标记菌株WZW03-P接种于含50 μg·mL-1Amp的LB液体抗性培养基中,30 ℃培养至D600=0.6,按1%(体积分数)的接种量将WZW03-P接种于无抗性LB液体培养基中,30 ℃培养,每24 h转接LB培养基一次,连续10次后,将菌液分别稀释涂布到LB平板和抗性LB平板上,培养48 h,进行影印对比接种实验[11],接种稳定菌株重复进行遗传稳定性检验,直至稳定性达到90%以上。
1.6 西瓜幼苗根系对标记菌株的吸附
取籽粒大小一致的西瓜种子,用0.1%(质量分数)HgCl2消毒10 min,用无菌水清洗5次,30 ℃条件下催芽,待西瓜胚根长至0.5 cm时,挑选长势一致的萌发西瓜种子播种于含无菌MS半固体培养基的培养皿中,培养14 d(28 ℃/光照12 h,18 ℃/黑暗12 h,相对湿度60%),得到西瓜幼苗。将培养好的西瓜幼苗在无菌操作条件下从MS培养基中取出,使用无菌水对西瓜幼苗进行清洗,洗掉根部带有的琼脂。WZW03-P在LB抗性培养基中培养24 h后,3 000 r·min-1离心收集菌体,用无菌生理盐水重悬至5.20×109cfu·mL-1,然后按照10倍梯度稀释,制备不同浓度的菌悬液,贮存于10 mL试管中备用。将洗净的西瓜幼苗浸入含有5.20×108cfu·mL-1菌悬液的试管中,室温下分别浸入0.5、1、2、5、10、30、50、80、120 min。另取洗净的西瓜幼苗浸入不同稀释浓度的WZW03-P悬液中,室温静置30 min。实验需要对各样品进行处理,即去掉西瓜幼苗的茎叶,使用无菌滤纸将西瓜幼苗根部菌液吸干,研磨稀释后在抗性LB培养基涂布计数,重复3次,计算菌株的吸附数量(cfu·g-1)。
1.7 菌株的土壤存活率检测
取过2 mm筛的灭菌土和未灭菌自然土各400 g,加入30 mL 5.20×108cfu·mL-1的WZW03-P菌液(制备方法与1.6节相同)充分搅拌,分别标记为S-WZW03-P和N-WZW03-P,同时设置灭菌土对照(S-CK)和自然土对照(N-CK),并保持含水量在30%左右,置于18 ℃和相对湿度60%的培养箱中避光培养,每5 d随机取出3 g土壤,采用LB抗性培养基平板计数法监测WZW03-P的存活量,每个处理重复3次。
1.8 菌株的促生及定殖检测
使用Amp抗性LB培养基,培养WZW03-P至D600=0.5。按照1.6节的方法处理西瓜种子,待西瓜胚根长至0.5 cm时,将长势一致的萌发西瓜种子分别播种于添加了30 mL菌液的灭菌土(S-WZW03-P)和未灭菌土(N-WZW03-P)中,设置灭菌对照(S-CK)和未灭菌对照(N-CK),共计4个处理。置于智能人工气候箱内培养30 d(30 ℃/光照12 h,18 ℃/黑暗12 h,相对湿度60%),测量相关指标。采用根系分析系统(GXY-A)扫描根系,分析总根长、根表面积、根系平均直径和根体积。
45 d后收集西瓜幼苗的根际(0~0.2 cm)、近根(1~2 cm)、远根(5~6 cm)土壤,每个处理收集1 g土壤,120 r·min-1振荡30 min后梯度稀释,将稀释液涂布于带有Amp(50 μg·mL-1)抗性的LB平板中,30 ℃培养2 d,平板计数。
2 结果与分析
2.1 转化子验证
POT2-RFP质粒具有Amp抗性,标记成功的菌株能够在含Amp抗性的LB平板中生长。检测结果发现,转化子浓度达到(12.30±3.51) cfu·mL-1,活菌浓度为(6.07±0.45)×106cfu·mL-1,转化率为2.03×10-6。在共聚焦荧光显微镜下,标记菌株WZW03-P发出红色荧光(图1-A),表明质粒已经转化并表达。质粒POT2-RFP含有红色荧光基因,其最大激发光为558 nm,由图1-B可知,在558 nm的激发光下,在650~700 nm产生荧光,其中最大荧光波长为672.6 nm,属于红光区段,证明质粒转化成功。
2.2 转化子WZW03-P稳定性和生长特性
以10代为一个循环,检测到第3个循环时,转化子稳定性达到99%(图2-A),可以实现稳定遗传,完全可以进入到下一步实验研究。对WZW03-P和WZW03进行生长曲线测定,由图2-B可知,WZW03-P和WZW03在对数期和稳定期均表现出相似的生长态势,虽然WZW03-P的生物量相较于WZW03偏低,但是在75 h时统计学差异不显著(P>0.05)。
2.3 西瓜幼根对WZW03-P的吸附特性
西瓜幼根浸入菌液后,随着浸入时间延长,吸附量不断增大,50 min时吸附量达到最大,(50.87±0.06)×105cfu·g-1(表1)。28 ℃条件下将西瓜幼苗浸入不同浓度的WZW03-P菌悬液中,随着菌液浓度的增大,幼根吸附量也不断增大,菌液浓度达到5.2×108cfu·mL-1时,西瓜根系吸附量基本达到饱和,不再随着菌液浓度的增加而增加(表2)。
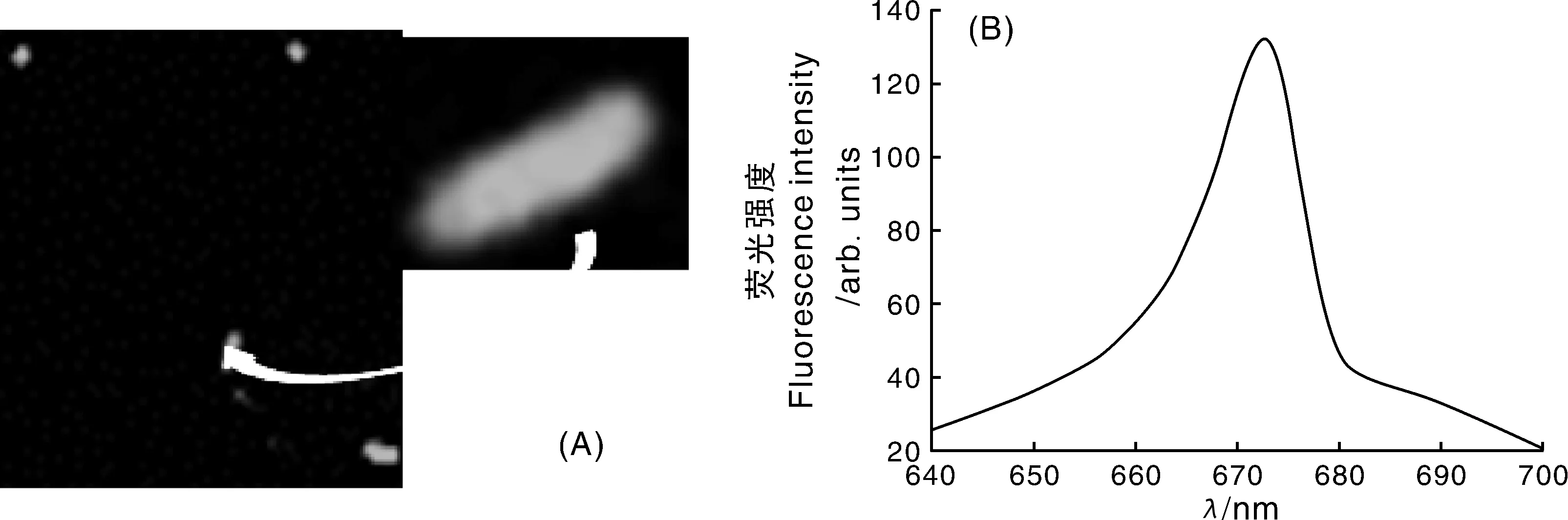
图1 转化子Plantibacter sp. WZW03-P的荧光检测Fig.1 Fluorescence detection of Plantibacter sp. WZW03-P
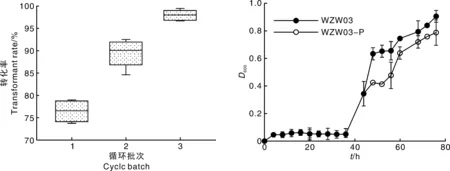
图2 转化子WZW03-P遗传稳定性与生长特性Fig.2 Genetic stability and growth characteristics of WZW03-P
表1WZW03在西瓜根系的吸附动态
Table1Adsorption dynamics of WZW03 in watermelon root
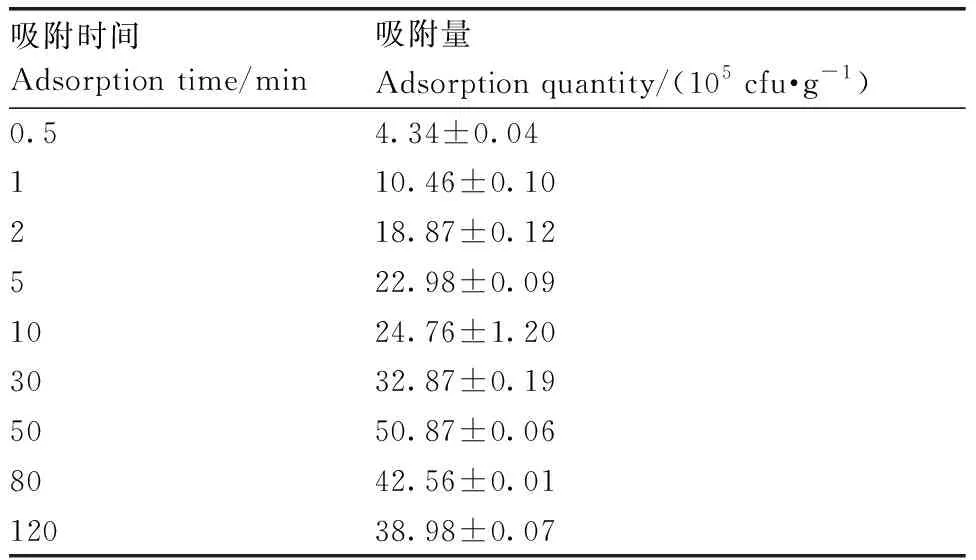
吸附时间Adsorption time/min吸附量Adsorption quantity/(105 cfu·g-1)0.54.34±0.04110.46±0.10218.87±0.12522.98±0.091024.76±1.203032.87±0.195050.87±0.068042.56±0.0112038.98±0.07
2.4 WZW03-P在土壤中的存活量检测
通过检测菌株在灭菌土和自然土中的生物量可知,加入菌株后,菌株生物量即开始下降,0~5 d下降速率最为显著,5~20 d之间下降速率趋缓,20 d后菌株的数量基本稳定在106cfu·g-1左右(图3)。在25 d的监测期内,自然土壤中的WZW03-P数量始终高于灭菌土壤,说明菌株在自然土壤中定殖能力较强,且可能与土壤中的其他微生物存在协同效应,说明菌株在农业生产实践中具有广阔的应用前景。
2.5 WZW03-P对西瓜幼苗生长的影响
由表3可知,与S-CK相比,S-WZW03-P的西瓜幼苗地下部鲜质量和干质量均显著提高(P<0.05),增幅分别为58.0%和40.0%。与N-CK相比,在自然土壤中经WZW03-P处理后,西瓜幼苗地上部和地下部干质量均显著增加(P<0.05),增幅分别为80.0%和50.0%。
表2菌液浓度对WZW03在西瓜根系吸附的影响
Table2Effect of bacteria concentration on adsorption of WZW03 in watermelon root

菌液浓度Bacteria concentration/(cfu·mL-1)吸附量Adsorption quantity/(cfu·g-1)5.20×10105.20×10205.20×10343.21±2.445.20×104(5.13±1.56)×1035.20×105(1.12±0.74)×1045.20×106(1.61±0.56)×1055.20×107(1.66±0.21)×1065.20×108(1.27±0.34)×1075.20×109(1.36±0.46)×107

图3 WZW03-P在土壤中的存活动态Fig.3 Dynamics of WZW03-P in soil
由图4可知,在灭菌土壤中,相较于S-CK,S-WZW03-P的西瓜幼苗在总根长、根表面积和根体积上都显著增加,根系平均直径增加量不显著。在自然土壤中,较于N-CK,N-WZW03-P的西瓜幼苗在总根长、根表面积和根体积也增加显著,根系平均直径增加量不显著。灭菌土 (S-CK和S-WZW03-P) 中的西瓜幼苗根系相较于自然土 (N-CK和N-WZW03-P),各项指标差异不显著,说明菌株WZW03-P在灭菌和自然土壤中均能发挥较好的促生效应。
表3菌株WZW03-P对西瓜幼苗生长的影响
Table3Effects of WZW03-P on seedling growth of watermelon
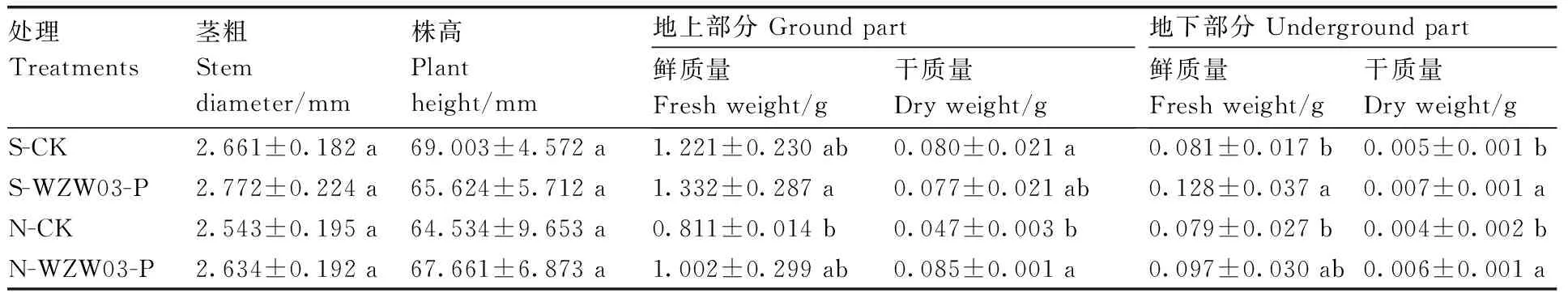
处理Treatments茎粗Stemdiameter/mm株高Plantheight/mm地上部分 Ground part鲜质量Fresh weight/g干质量Dry weight/g地下部分 Underground part鲜质量Fresh weight/g干质量Dry weight/gS-CK2.661±0.182 a69.003±4.572 a1.221±0.230 ab0.080±0.021 a0.081±0.017 b0.005±0.001 bS-WZW03-P2.772±0.224 a65.624±5.712 a1.332±0.287 a0.077±0.021 ab0.128±0.037 a0.007±0.001 aN-CK2.543±0.195 a64.534±9.653 a0.811±0.014 b0.047±0.003 b0.079±0.027 b0.004±0.002 bN-WZW03-P2.634±0.192 a67.661±6.873 a1.002±0.299 ab0.085±0.001 a0.097±0.030 ab0.006±0.001 a
生物量以单株苗计。同列数据后无相同字母的表示差异显著(P<0.05)。
Biomass was measured based on single plant. Data followed by no same letters within the same column indicated significant difference atP<0.05.

图4 菌株WZW03-P对西瓜幼苗根系的影响Fig.4 Effect of WZW03-P on watermelon seedling root
2.6 WZW03-P在西瓜根际的定殖能力
由图5可知,在S-WZW03-P和N-WZW03-P中,WZW03-P在土壤中的定殖数量从高到低均表现为根际(0~0.2 cm)>近根(1~2 cm)>远根(5~6 cm)。在S-WZW03-P和N-WZW03-P根际土中,菌株的定殖数量分别达到2.15×106cfu·g-1和2.70×105cfu·g-1。在根际和近根区域灭菌土壤中的菌株WZW03-P含量远高于未灭菌土壤,但是远离根际的土体中,二者WZW03-P菌株含量均较低,且没有显著差异。
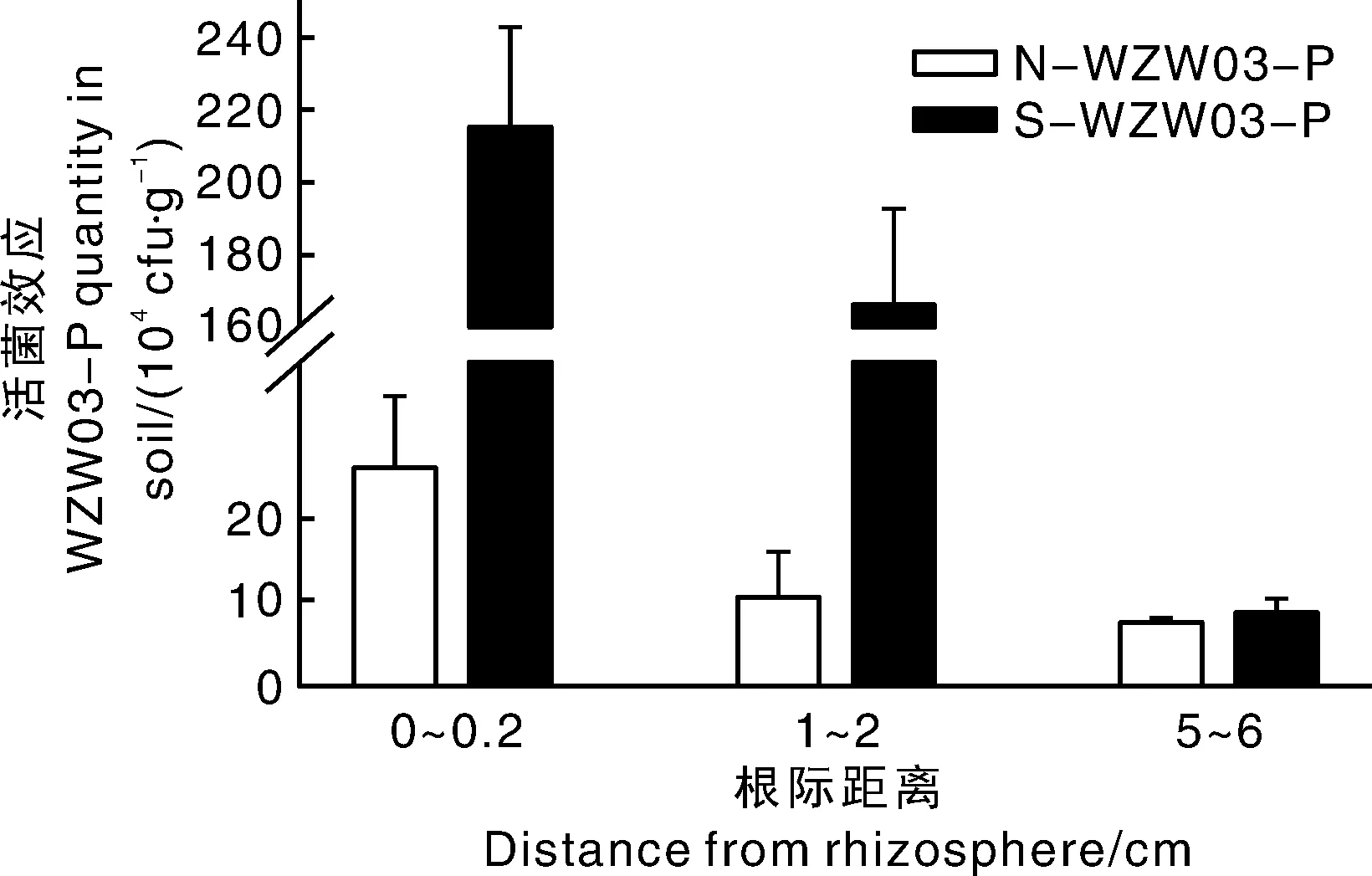
图5 菌株WZW03-P于不同根系范围的定殖情况Fig.5 Colonization of WZW03-P in different root systems
3 讨论
PGPR能够定殖于植物根部,通过分泌各类次级代谢产物促进植物生长,其定殖能力是影响植物生长的关键因素,检测PGPR的定殖情况是研究PGPR的一个重要途径。分子标记是研究PGPR作用机理及定殖规律的重要手段之一[12]。Leff等[13]使用荧光质粒对Escherichiacoli进行荧光标记,荧光基因在短时间内消失。本实验通过生物法将荧光质粒POT2-RFP转入WZW03号菌株,转化菌株经过多次传代后仍具有较好的荧光表达能力,遗传性较为稳定。车建美等[14]荧光标记的清枯雷尔氏菌与野生株相比出现生长滞后的现象,本实验转化后的菌株WZW03-P的生长特性与未转化的WZW03相比生物量略有下降,但是差异不显著,完全可以应用于后续研究。促生菌吸附于作物根表是形成定殖的必要条件[15],也是促生菌起到促生作用的关键[16]。WZW03-P接种土壤中20 d后定殖数量趋于稳定,与Xanthomonassp. P5310的定殖特点类似[17]。WZW03-P在灭菌和未灭菌土壤中,均对西瓜植株生长具有促生效应,说明菌株在土壤中具有明显的竞争优势,促生效果明显,同时能够显著优化根系结构,促进根系总根长、根表面积和根体积增加。距离西瓜根际越近,菌株WZW03-P在土壤中的含量就越高,说明菌株具有良好的定殖能力与竞争优势,且与作物根系之间可能存在互利共生关系[18]。
