固相萃取-气相色谱串联质谱测定饮用水中N-亚硝胺类消毒副产物
2018-10-29汤庆会余沛芝曹荥玉关永年牛璐瑶符策竿WidoSchmidt刘洪波
汤庆会,余沛芝,陆 坤,曹荥玉,关永年,牛璐瑶,符策竿,Wido Schmidt,刘洪波
(1.苏州工业园区清源华衍水务有限公司,江苏苏州 215021;2.上海理工大学环境与建筑学院,上海 200093;3.德国水技术中心,德国德累斯顿 2,D-01326)
亚硝胺类化合物(N-nitrosamines,NAs)是一类存在于环境和水体中的持久性有机污染物[1],是一类新型的消毒副产物,已被国际癌症研究署(IARC)列为高疑似致癌物质[2-3]。近年来N-亚硝胺因其饮用水中的强致癌性在许多工业化国家引起了广泛的关注。目前,主要研究的亚硝胺物质有9种,即亚硝基二甲胺(NDMA)、亚硝基二乙基胺(NDEA)、亚硝基甲乙胺(NMEA)、二正丙基亚硝胺(NDPA)、对亚硝基二异丁胺(NDBA)、亚硝基吗啉(NMOR)、亚硝基吡咯烷(NPYR)、亚硝基哌啶(NPIP)、亚硝基二苯胺(NDPhA)。有些已被确定为氯胺的消毒副产物(DBPs)[4-5],有些是臭氧与二甲胺或某些人为化学物质的反应产物[6-7]。
N-亚硝胺,尤其是N-亚硝基二甲胺(NDMA)经常在许多国家的饮用水氯胺消毒处理过程中被检测到。1989年, 加拿大安大略省首次在饮用水中发现了NDMA[8],并确定其为消毒过程产生的副产物。1998年,NDMA在美国火箭燃料产生的地下水污染物中首次被发现,随后被证实是氯胺消毒处理生成的副产物[9-10]。近年来,亚硝胺的研究已经涉及到食品和工业制品,熏肉、腌菜、烟草、婴儿奶嘴等橡胶制品中均已检出亚硝胺类物质[11-12]。
我国水源水质情况有逐年恶化的趋势,自来水厂需要进行深度处理来确保供水安全,从而减小对人体的危害。深度处理后的净化工艺一般采用常规的加氯消毒和臭氧氧化。但是亚硝酸盐和有机氮均会在水中生成N-亚硝胺,且之前的研究发现臭氧消毒后会有较高浓度的NDMA产生[13],更高浓度消毒副产物的检出说明必须加大对饮用水中N-亚硝胺的检测力度。目前,水中N-亚硝胺的提取方法主要有液液萃取、固相萃取(SPE)和固相微萃取(SPME)。采用的检测方法主要有GC-NCD、GC-NPD、GC/MS、GC/HRMS、GC/MS/MS、LC/MS/MS、LC/MS/HRMS和UPLC/MS/MS[14]。相较于其他方式的前处理,固相微萃取因其影响因素多、灵敏度低,适用于废水中N-亚硝胺的检测。对于不同的进样方式,采用LC进样时,低分子量的N-亚硝胺的检测易受杂质和溶剂基质效应的影响,因此采用GC进样效果相对较好。与其他的检测器相比,MS检测的响应值更低,其效果优于其他检测器。
本试验采取高灵敏度、低检出限、简单易行的固相萃取-气相色谱串联质谱方法测定苏州清源水厂两种处理工艺中常见的9种N-亚硝胺物质。通过对常规工艺和深度处理工艺的多种N-亚硝胺化合物进行测定,比较两种工艺各处理过程中的亚硝胺种类和含量,说明饮用水中N-亚硝胺类物质的产生源头,从而全面地对该水厂的饮用水水质进行评价,为该水厂的工艺进一步优化提供依据。优化水样前处理和GC/MS/MS检测N-亚硝胺的条件,建立一种检测限低至0.3 ng/L的饮用水中痕量N-亚硝胺的检测方法,并将其应用于水厂全工艺过程中水样的检测,对水厂的水质质量监测具有至关重要的作用。
1 试验部分
1.1 仪器
气相色谱串联质谱仪(Agilent 7890B GC System-Agilent 7000C GC/MS Triple Quard);色谱柱为DB-WAX(30 m×0.25 mm×0.25 μm);固相萃取装置Auto Trace SPE(美国Caliper公司);浓缩仪TurboVapⅡ(美国Caliper公司)。
1.2 试剂
9 种N-亚硝胺(o2si公司,USA)所有标样稀释后配制成2 000 mg/L的甲醇溶液;NDMA-d14(o2si公司,USA)稀释后配制成1 000 mg/L的甲醇溶液;椰子壳活性炭柱(上海安谱实验科技股份有限公司);甲醇、二氯甲烷(Merck公司,Germany);氮气(99.999%)和氦气(99.999%)。
1.3 色谱/质谱条件
1.3.1 色谱条件
升温程序:起始温度为40 ℃,保持3 min,以10 ℃/min的速率升至110 ℃,以15 ℃/min的速率升至200 ℃,再以40 ℃/min的速率升至240 ℃,保持5 min。
进样口温度为240 ℃,采用不分流进样。
气体流量为1.7 mL/min,恒流模式。
1.3.2 质谱条件
离子源:EI源,电子轰击能量为70 eV,离子源温度为230 ℃,传输线温度为240 ℃,四级杆温度为150 ℃。
1.4 线性试验
校准曲线可用标准曲线或工作曲线。虽然标准曲线线性最低点可低至0.2 μg/L,但实际水样经过固相萃取后会出现峰漂移的现象,因此采用工作曲线。本方法采用内标法(10 μg/L的NDMA-d14为内标物质),配制9种N-亚硝胺化合物浓度分别为1.0、2.0、5.0、10、15、20 ng/L的水溶液。
1.5 样品处理
采用固相萃取(SPE)方法对样品进行处理。依次使用6 mL二氯甲烷、12 mL甲醇和15 mL超纯水活化椰子壳活性炭柱;将1 000 mL水样连续地通过固相萃取柱,上样速率约为10 mL/min,待上样结束后,用氮气吹干15 min;使用15 mL二氯甲烷洗脱SPE柱,洗脱液经氮气吹脱浓缩至0.5 mL后加入内标物质,用二氯甲烷定容至1.0 mL。
1.6 样品前处理条件
本试验比较了C18、HLB和椰子壳活性炭柱3种固相萃取小柱纯化的效果。样品加入适量N-亚硝胺混合标样溶液,方法同1.5,3次平行试验。通过比较每个萃取小柱所萃取的9种亚硝胺的平均回收率来确定最佳的萃取小柱。椰子壳活性炭柱对N-亚硝胺的回收率明显高于C18、HLB小柱,因此,本试验采用椰子壳活性炭柱。
2 结果与讨论
2.1 气质联用仪分析条件的优化
2.1.1 色谱柱的优化
分别选用非极性柱DB-5MS(30 m×0.25 mm×0.25 μm)和强极性柱DB-WAX(30 m×0.25 mm×0.25 μm)进行9种N-亚硝胺类化合物色谱分离条件试验。结果表明:选用非极性柱时,N-二甲基亚硝胺的色谱峰与溶剂峰不能分离,其他待测物的色谱峰分离度也不佳;选用强极性柱DB-WAX 时,获得的色谱峰峰形对称,定量准确,重现性好,分离效果好,如图1所示。因此,本试验选用DB-WAX作为色谱柱进行9种N-亚硝胺类化合物色谱分离条件试验。

图1 9种N-亚硝胺的分离效果图Fig.1 Separation Effect of Nine Kinds of N-Nitrosamines
2.1.2 柱温升温速率的优化
由于NPYR、NPIP 和NDBA 这3种物质的出峰时间比较接近,同时为了排除溶剂对峰分离的影响,可以选择优化柱温的升温速率来获得最佳的分离效果。柱温的起始温度设为40 ℃,分别比较升温速率为15、10、5 ℃/min 时的分离效果。结果显示:当升温速率为15 ℃/min时,溶剂峰与NDMA 的色谱峰分离不明显;当升温速率为10 ℃/min 时,两者能够有效分离;当升温速率为5 ℃/min 时,色谱峰的分离效果并没有明显改善。综合比较,选择升温速率为10 ℃/min,可获取最佳的分离度。当柱温升高到110 ℃时,NDMA已经出现峰,为了提高分析速度,此时将升温速率提高至15 ℃/min;当柱温升高到200 ℃时,待测物均已出现峰,因此将柱温升温速率提高到40 ℃/min。
2.2 方法的线性关系及方法检出限
本试验条件下,9种亚硝胺类化合物为1.0~20 ng/L,用色谱柱DB-WAX绘制标准曲线。结果表明,9种N-亚硝胺有良好的线性关系,其线性回归方程、线性相关系数、最低检出限如表1所示。9种N-亚硝胺线性相关系数R2为0.992~0.999,最低检出限为0.3 ng/L。
2.3 回收率
为增强试验的精确度,分别测定实际出厂水水样的2个加标浓度2、10 ng/L的回收率(表2)。由表2可知,NPYR两个浓度的加标回收率和NDphA浓度为10 ng/L的加标回收率均低于70%。但是其他物质无论浓度高低,它们的单位加标回收率在EPA规定的可接受范围(70%~120%)。因此,本试验采用的固相萃取-气相色谱串联质谱的方法适用于检测饮用水中N-亚硝胺类化合物。
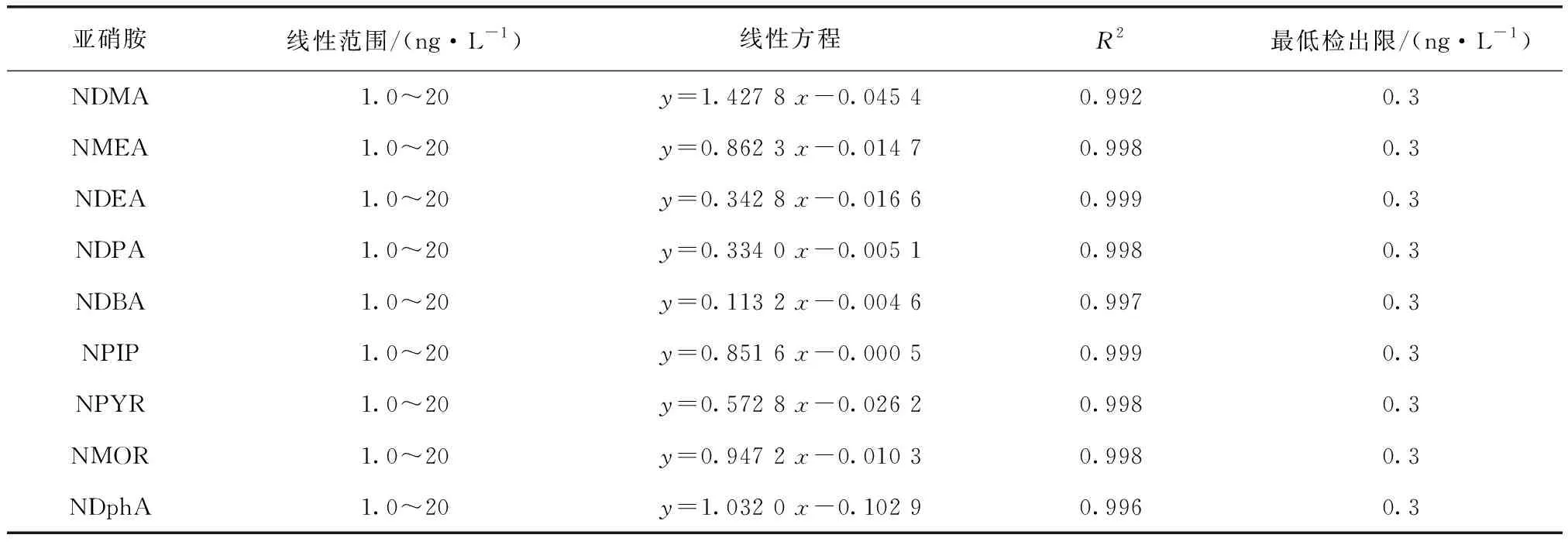
表1 9种N-亚硝胺的线性方程、线性相关系数和最低检出限Tab.1 Linear Equations, Correlation Coefficients and Minimum Detection Limits of Nine Kinds of N-Nitrosamines
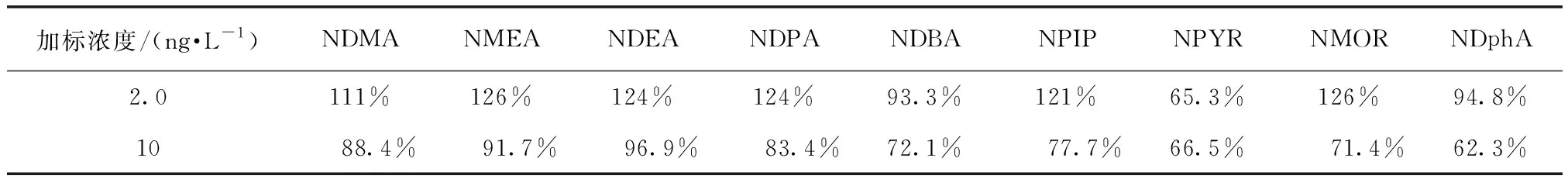
表2 9种N-亚硝胺的加标回收率Tab.2 Recovery Rates of Nine Kinds of N-Nitrosamines
2.4 实际样品的检测
实验室选取不同水源两个水厂的各个过程水样进行检测,水厂1为常规处理工艺,水厂2为预处理+常规处理+深度处理工艺,9种N-亚硝胺的检测结果如表3所示。
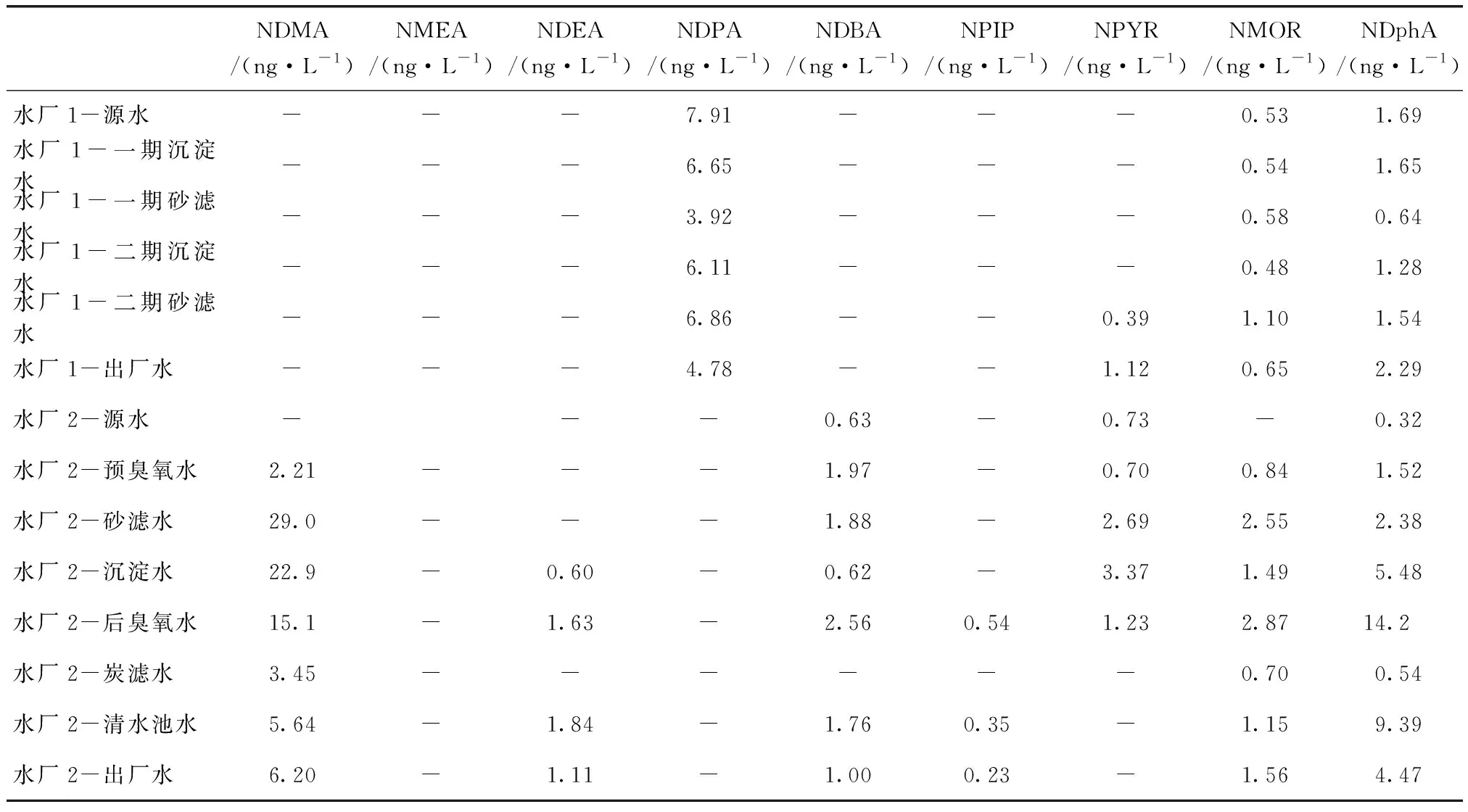
表3 水厂全过程水样中9种N-亚硝胺的种类和含量Tab.3 Types and Contents of Nine Kinds of N-Nitrosamines in Water Plant
由表3可知,常规处理工艺和深度处理工艺中N-亚硝胺类物质的种类和含量。水厂1中只检出4种N-亚硝胺,除了NDPA含量较高外,其他3种N-亚硝胺含量均低于2.5 ng/L;水厂2中检测出的N-亚硝胺种类明显多于水厂1,水厂2中检出7种N-亚硝胺,且砂滤水的NDMA浓度达29.0 ng/L。
相较于其他几种亚硝胺,水厂2中NDMA在每个处理工艺中均可检出,其检测量最高,且远高于其他N-亚硝胺,说明各深度处理工艺对NDMA的生成有很大的影响。臭氧会导致NDMA的生成,含有N,N二甲胺的化合物是NDMA的前驱物,在臭氧条件下会促成NDMA生成。文献说明,二甲胺的生成与臭氧浓度成负相关,二甲胺随着臭氧浓度的增加而减少,同时也会减少NDMA的生成量[15]。水厂2中砂滤水和沉淀水NDMA的含量最高,说明在混凝沉淀中加入的消毒剂与水中物质反应生成了较多的NDMA,是NDMA的主要来源,氯胺会和二甲胺反应生成氯代不对称二甲肼(UDMH),而UDMH会与氧气反应生成NDMA[15],臭氧也会对N-亚硝胺类的生成起到一定的作用。
水厂1的原水水质较好,总氮和氨氮基本达到Ⅱ类,而水厂2的原水总氮、氨氮含量明显高于水厂1,水厂2中N-亚硝胺的前驱体含量高,深度处理中的臭氧会大大增加N-亚硝胺的生成。而碳滤对N-亚硝胺的去除率在75.6%以上,说明生物活性炭的投加对水中N-亚硝胺的去除起到了主要作用,出厂水的9种N-亚硝胺含量均低于10.0 ng/L。深度处理工艺相较于常规工艺,消毒剂的投加以及臭氧化的处理,使得水中N-亚硝胺类物质的量增加。
3 结论
本试验建立了固相萃取-气相色谱串联质谱方法高效检测两种处理工艺中9种N-亚硝胺物质。该方法的相关系数为0.992~0.999;除个别外,加标回收率均在72.1%~126%;9种N-亚硝胺的最低检出限为0.3 ng/L。对不同水源的两个水厂进行了全过程水样的检测,结果表明,深度处理后,出厂水中N-亚硝胺含量较高,其中NDMA的含量最高。深度处理过程中的消毒剂和臭氧化是饮用水中N-亚硝胺类生成的主要原因。亚硝胺作为消毒副产物,对人体健康的影响不容忽视,因此应对其来源、分布和含量等进行更多的研究,并通过切实可行的方法,时刻关注饮用水中的N-亚硝胺类物质。
