大肠杆菌-鸭疫里默氏杆菌高效穿梭质粒pFY02的构建和应用
2018-10-25冯言程安春刘马峰
冯言,程安春,刘马峰
1 四川农业大学动物医学院 预防兽医研究所,四川 成都 611130
2 四川农业大学动物医学院 禽病防治中心,四川 成都 611130
3 四川省动物疫病与人类健康四川省重点实验室,四川 成都 611130
鸭疫里默氏杆菌(Riemerella anatipestifer,RA)是属于黄杆菌科的革兰氏阴性菌,常引起鸭、鹅、火鸡等家禽传染性的败血症及浆膜炎,由于该病的高发病率与高死亡率,已成为危害各国养鸭业的主要细菌性传染病之一[1-3]。鸭疫里默氏杆菌血清型众多,目前已经鉴定的至少有21种血清型,且各血清型之间无交叉保护作用[4-6],这就为疫苗防控该病增加了极大困难。且随着耐药菌株的逐年增加,使用抗生素防治该病也难以奏效[7-8]。
欲有效防控该病,首先要鉴定该菌的致病因子,进而深入了解该病的发病机制。目前鉴定的参与鸭疫里默氏杆菌致病的毒力因子有CAMP[9-10]、 sip[11-12]、 TbdR1[13]、 B739_1208[14]等。以上毒力基因的鉴定的方法基于基因缺失,而基因缺失后需要将缺失基因克隆至穿梭质粒进行功能回补验证。在我们之前的研究中,构建了能够用于鸭疫里默氏杆菌基因回补的穿梭质粒pLMF03[15],然而该质粒所包含酶切位点较少,接合转移效率低下,不能满足所有鸭疫里默氏杆菌基因的回补。为解决这一缺陷,本研究构建了结合转移效率高,能稳定存在于鸭疫里默氏杆菌中且能用于鸭疫里默氏杆菌基因回补的穿梭质粒pFY02。
1 材料与方法
1.1 菌株及试剂
质粒 pPM5由比利时那慕尔大学 Guy R.Cornelis教授惠赠[16]。质粒 pEX18GM 由中国农业大学张立群教授惠赠[17]。质粒pLMF03由本实验室保存;菌株E.coliDH5α、E.coliS17.1、RA ATCC、RA CH-1、RA ATCC ΔtonB2由本实验室保存;DNA纯化回收试剂盒、质粒小提试剂盒、细菌基因组 DAN提取试剂盒购自北京天根生化科技有限公司;PCR试剂盒、限制性内切酶购自New England Biolabs(NEB) 公司;DNA连接试剂盒购自Thermo公司;荧光定量PCR试剂盒购自南京诺唯赞生物科技有限公司;胰蛋白胨、酵母粉、胰蛋白胨大豆肉汤培养基(TSB) 购自OXOID公司;琼脂粉购自北京索莱宝科技有限公司;脱纤维羊血购自郑州益康生物有限公司;氨苄西林、卡那霉素、头孢西丁购自上海生物工程有限公司; CaCl2、NaCl、MgSO4均来自国药集团化学试剂有限公司,分析纯。
1.2 引物设计与合成
参照 GenBank公布的转移位点oriT序列(GenBank Accession No.AAC27024.1)、鸭疫里默氏杆菌复制起始基因pRA0726 ori序列(GenBank Accession No.KU997673.1)[18]、高表达启动子High EXP序列(GenBank Accession No.CP003787.1) 和鸭疫里默氏杆菌tonB2基因序列(GenBank Accession No.RA0C_1209)分别设计扩增引物oriTP1/P2、pRA0726 oriP1/P2、High EXPP1/P2 和tonB2P1/P2,其中在High EXPP2中加入酶切位点SacⅡ、NheⅠ、StuⅠ、BsshⅡ的序列;分别设计鸭疫里默氏杆菌单拷贝基因recA(GenBank Accession No.RA0C_RS04870) 和穿梭质粒pFY02单拷贝基因cfx(GenBank Accession No.KU997671.1) 的荧光定量PCR引物recAP1/P2和cfxP1/P2(表1),所有引物由华大基因有限公司合成。
1.3 基因的克隆及回收纯化
结合转移位点oriT的序列是以质粒pEX18GM 为模板,oriTP1/P2为引物进行 PCR扩增得到;鸭疫里默氏杆菌复制起始基因pRA0726 ori的序列是以质粒 pLMF03为模板,pRA0726 oriP1/P2为引物进行PCR扩增得到;高表达启动子High EXP的序列是以RA CH-1菌株基因组为模板,High EXPP1/P2为引物进行PCR扩增得到;鸭疫里默氏杆菌tonB2基因的序列是以RA ATCC菌株基因组为模板,tonB2P1/P2为引物进行PCR扩增得到。扩增程序为:98 ℃预变性 30 s;98 ℃变性 10 s,55 ℃退火 30 s,72 ℃延伸xs(oriT、pRA0726 ori、High EXP和tonB2基因的延伸时间x分别为30 s,1 min,15 s和30 s),30个循环;72 ℃延伸7 min;22℃保存。经PCR扩增后的产物,用1%的琼脂糖凝胶进行电泳检测,确定基因片段扩增正确后,按照北京天根生化科技有限公司DNA纯化回收试剂盒操作说明进行PCR产物回收,–20 ℃保存。
1.4 穿梭质粒pFY02的构建方法
将纯化回收的转移位点oriT序列和待改造质粒pPM5进行SphⅠ和HindⅢ双酶切,用DNA纯化回收试剂盒回收长片段酶切产物。用 DNA连接试剂盒连接载体片段pPM5与基因片段oriT,将连接产物转化至E.coliDH5α感受态细胞,用加有100 µg/mL氨苄西林的LB固体培养基培养细菌,37 ℃培养24 h,分离长出的单菌落,用PCR的方法鉴定出阳性克隆(鉴定oriT片段,约800 bp)。用 LB液体培养基扩大培养阳性克隆菌株,用质粒小提试剂盒提取质粒,将质粒送往华大基因有限公司测序,测序无误后,将新构建质粒命名为pPM5::oriT。
用限制性内切酶SphⅠ和PstⅠ双酶切质粒

表1 引物序列Table 1 Primer sequence
pPM5::oriT和鸭疫里默氏杆菌复制起始基因pRA0726 ori片段,用上述方法将质粒pPM5::oriT和pRA0726 ori基因片段连接,转化及PCR鉴定(鉴定pRA0726 ori片段,约2 000 bp)。质粒测序无误后,将新构建质粒命名为pFY01。
用限制性内切酶SalⅠ和XbaⅠ酶切质粒pFY01和高表达启动子High EXP片段,用上述方法将质粒pFY01和High EXP基因片段连接,转化及PCR鉴定(鉴定High EXP片段,约250 bp)。质粒测序无误后,将新构建质粒命名为pFY02。
1.5 穿梭质粒 pFY02在鸭疫里默氏杆菌中的拷贝数检测
用TSB培养细菌RA ATCC pFY02至对数生长期,按照细菌基因组 DNA提取试剂盒说明书提取其总DNA,测其DNA浓度后用去离子水稀释为 2 ng/µL备用。用鸭疫里默氏杆菌单拷贝基因recA和穿梭质粒pFY02上单拷贝基因cfx进行荧光定量PCR对DNA模板量化分析,cfx基因拷贝数比上recA基因拷贝数的比值即是穿梭质粒pFY02的拷贝数,具体操作方法参考Lee等[19]。实验进行3次重复,取平均值。
1.6 穿梭质粒pFY02转化效率及稳定性检测
首先将构建的穿梭质粒pFY02转化至E.coliS17.1感受态细胞中,用加有 100 µg/mL氨苄西林的LB固体培养基培养细菌,37 ℃培养24 h,分离长出的单菌落,用PCR的方法鉴定出阳性克隆(鉴定oriT与pRA0726 ori总片段,约 2 800 bp)。
本研究使用大肠杆菌(供体菌) -鸭疫里默氏杆菌(受体菌) 结合转移的方法,将质粒 pFY02导入鸭疫里默氏杆菌中,即将E.coliS17.1 pFY02和鸭疫里默氏杆菌RA ATCC11845分别用LB和TSB培养至对数生长期,7 000 r/min离心10 min,去掉上清,用10 mmol/L的无菌MgSO4分别清洗并重悬菌体,然后按1OD(约2×109CFU) 鸭疫里默氏杆菌和5OD(约2×108CFU) 大肠杆菌的比例混合两种菌,用孔径为0.22 µm的灭菌滤膜过滤混合的细菌,将滤膜贴于血平板上,30 ℃培养10–12 h后取出滤膜,用10 mL浓度为10 mmol/L的 MgSO4洗下滤膜上的菌,取 100 µL菌液涂于加有50 µg/mL卡那霉素和1 µg/mL头孢西丁的血平板上,37 ℃培养 24 h。分离长出的单菌落,用PCR的方法鉴定阳性菌落(鉴定oriT与pRA0726 ori总片段,约 2 800 bp)。将鉴定为阳性的单菌落用血平板传10代,用PCR的方法鉴定质粒的稳定性。
用上述的结合转移方法将普通的穿梭质粒pLMF03和新构建的穿梭质粒pFY02分别导入鸭疫里默氏杆菌RA ATCC11845。进行结合转移时,两组实验结合转移过程中使用的大肠杆菌和鸭疫里默氏杆菌数保持一致,对比两组实验结合转移后长出来的菌落数并分别数出平板上的菌落数,计算出两种穿梭质粒的结合转移效率(计算公式:结合转移后长出来的鸭疫里默氏杆菌数/结合转移前加入的鸭疫里默氏杆菌数)。实验进行3次重复,取平均值。
1.7 穿梭质粒 pFY02在鸭疫里默氏杆菌回补基因能力的检测
用限制性内切酶StuⅠ和XbaⅠ酶切质粒pFY02和tonB2片段,按照步骤1.4的方法将tonB2片段克隆到穿梭质粒pFY02上,用PCR的方法鉴定阳性克隆(鉴定tonB2片段,约850 bp)。用LB液体培养基扩大培养阳性克隆菌株并用质粒小提试剂盒提取质粒pFY02::tonB2。 用结合转移的方法将重组质粒pFY02::tonB2导入RA ATCC ΔtonB2菌株中,分离长出的单菌落,用PCR的方法鉴定回补菌株(鉴定tonB2片段,约850 bp)。
通过检测生长曲线初步鉴定穿梭质粒pFY02的回补能力。在3个均加有20 mL TSB的离心管中分别加入过夜培养的 RA ATCC pFY02、RAATCC ΔtonB2pFY02 及 RA ATCC ΔtonB2pFY02::tonB2菌株,并控制初始OD600为0.1,37 ℃摇床培养,每隔2 h测一次OD600值,根据测量不同菌株的OD600值制图。实验进行3次重复,取平均值。
1.8 穿梭质粒pFY02回补基因表达量的检测
用 Western blotting的方法检测穿梭质粒pFY02回补基因的表达能力。用 TSB分别培养RA ATCC pFY02、RA ATCCΔtonB2pFY02 和 RA ATCCΔtonB2pFY02::tonB2至OD600为 1,分别取1 mL上述菌液,12 000 r/min离心2 min,去掉上清后分别用100 µL的蛋白上样缓冲液重悬,样品经沸水浴 10 min后分别取 10 µL进行SDS-PAGE。电泳完的 PAGE胶经过转膜、蛋白封闭、孵育抗体、显色后观察各个菌的TonB2蛋白是否表达。
2 结果与分析
2.1 大肠杆菌-鸭疫里默氏杆菌穿梭质粒pFY02的构建
本研究构建的穿梭质粒是在质粒pPM5的基础上进行改造的,为了提高其结合转移效率,我们需要将转移位点oriT序列克隆到此质粒中。用限制性内切酶SphⅠ和HindⅢ双酶切oriT片段和质粒pPM5,用DNA连接试剂盒连接载体片段和目的片段,将连接产物转化至E.coliDH5α感受态细胞后用加有100 µg/mL氨苄西林的LB固体培养基培养细菌,分离长出的单菌落,用PCR的方法鉴定出阳性克隆(鉴定oriT片段,约800 bp),结果见图 1。提取阳性克隆菌株中的质粒,将质粒送往华大基因有限公司测序,测序无误,重组质粒构建成功,将其命名为pPM5::oriT。
由于此质粒中无鸭疫里默氏杆菌的复制起始位点,为了使其能够在鸭疫里默氏杆菌中复制,本研究将鸭疫里默氏杆菌复制起始基因pRA0726ori克隆到此质粒中。限制性内切酶用SphⅠ和PstⅠ,构建方法同上。用PCR鉴定阳性克隆时,鉴定pRA0726 ori片段,约2 000 bp,结果见图2。质粒测序无误,重组质粒构建成功,将其命名为pFY01。
为了方便基因片段插入穿梭质粒上且提高基因的表达量,我们将在质粒pFY01上克隆一段带有多个内切酶位点的高表达启动子序列High EXP。限制性内切酶用SalⅠ和XbaⅠ,构建方法同上。用PCR鉴定克隆中是否含有High EXP片段,约250 bp,结果见图3。从阳性克隆中抽提质粒经测序鉴定,确认无误后将其命名为 pFY02。穿梭质粒pFY02构建过程示意图见图4。

图1 菌落PCR鉴定E.coli DH5α pPM5::oriTFig.1 Identification of the E.coli DH5α pPM5::oriT strains by PCR.M: DM5000 DNA marker; 1: oriT gene(about 800 bp) was amplified from the plasmid pEX18GM; 2–3: oriT gene was amplified from the individual bacterial colonies of E.coli DH5α pPM5::oriT.
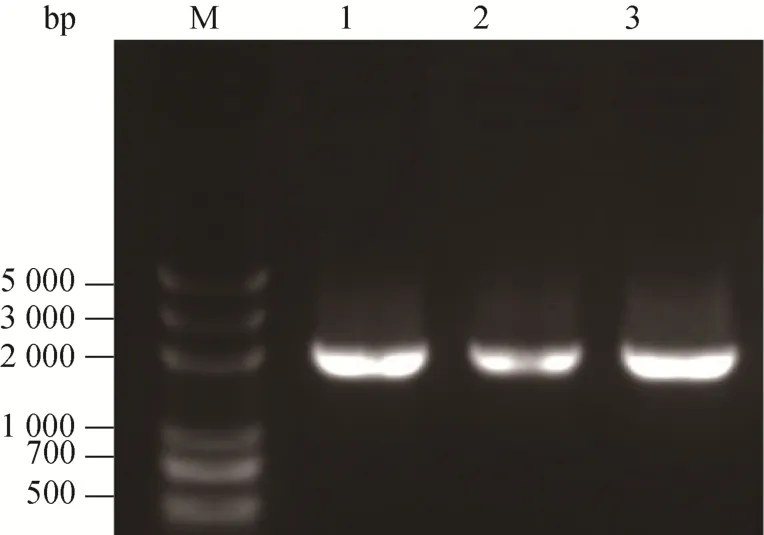
图2 E.coli DH5α pFY01的菌落PCR鉴定图Fig.2 Identification of the E.coli DH5α pFY01 strains by PCR.M: DM5000 DNA marker; 1: pRA0726 ori gene(about 2 000 bp) was amplified from the plasmid pLMF03; 2–3: pRA0726 ori gene was amplified from the individual bacterial colonies of E.coli DH5α pFY01.
2.2 穿梭质粒 pFY02在鸭疫里默氏杆菌中的拷贝数测定
使用Lee等[19]的方法,通过荧光定量PCR检测穿梭质粒pFY02在鸭疫里默氏杆菌的质粒拷贝数,实验进行3次重复,取平均值,结果见图5。结果显示cfx基因的拷贝数比上recA基因的拷贝数的比值约为26,即穿梭质粒pFY02的拷贝数为26。
2.3 穿梭质粒 pFY02结合转移效率提高且能在鸭疫里默氏杆菌中稳定存在

图3 E.coli DH5α pFY02的菌落PCR鉴定图Fig.3 Identification of the E.coli DH5α pFY02 strains by PCR.M: DM5000 DNA marker; 1: High EXP gene(about 250 bp) was amplified from the genome of RA CH-1; 2–3: High EXP gene was amplified from the individual bacterial colonies of E.coli DH5α pFY02.
将穿梭质粒pFY02转化至E.coliS17.1中,用PCR的方法鉴定出阳性克隆E.coliS17.1 pFY02(鉴定oriT与pRA0726 ori总片段,约2 800 bp);通过大肠杆菌(供体菌) -鸭疫里默氏杆菌(受体菌)结合转移的方法,将质粒pFY02导入鸭疫里默氏杆菌中,用 PCR的方法鉴定阳性克隆 RA ATCC pFY02(鉴定oriT与pRA0726 ori总片段,约2 800 bp);将鉴定为阳性的RA ATCC pFY02传10代,用PCR的方法鉴定质粒的稳定性(鉴定oriT与pRA0726 ori总片段,约2 800 bp),结果见图6。可以看出质粒能稳定存在于鸭疫里默氏杆菌中。进行3次重复实验,取平均值,计算出普通穿梭质粒pLMF03与穿梭质粒pFY02结合转移长出的菌落数分别约为120个和2 500个(图7A)。计算出普通穿梭质粒pLMF03与穿梭质粒pFY02的结合转移效率分别为 6×10–6和 1.25×10–4(图 7B),即穿梭质粒 pFY02的结合转移效率较普通穿梭质粒pLMF03高,结合转移效率提高约21倍。
2.4 穿梭质粒 pFY02可用于鸭疫里默氏杆菌基因缺失株的回补
本研究选择鸭疫里默氏杆菌tonB2基因缺失株来验证穿梭质粒pFY02的基因回补能力。将鸭疫里默氏杆菌的tonB2基因克隆到穿梭质粒pFY02中,构建重组质粒pFY02::tonB2。通过结合转移将质粒 pFY02::tonB2导入 RA ATCC ΔtonB2菌株,分离长出的单菌落,用PCR的方法鉴定(鉴定tonB2片段,约850 bp),结果见图8,即回补菌株RA ATCC ΔtonB2pFY02::tonB2构建成功。
在3个均加有20 mL TSB的离心管中分别加入过夜培养的 RA ATCC pFY02、RA ATCC ΔtonB2pFY02 和 RA ATCC ΔtonB2pFY02::tonB2,并控制初始OD600为0.1,37 ℃摇床培养,每隔2 h测一次OD600,根据测量不同菌株的OD600值制图。实验进行3次重复,取平均值,结果如图9所示。结果显示,与RA ATCC野生株相比,tonB2基因缺失株生长明显受损,然而tonB2基因回补株生长状态明显好于缺失株,说明穿梭质粒pFY02具有回补鸭疫里默氏杆菌基因的功能。

图4 穿梭质粒pFY02的构建过程示意图Fig.4 Schematic of the establishment process about shuttle plasmid pFY02.
2.5 穿梭质粒 pFY02回补鸭疫里默氏杆菌的基因能稳定表达
为了检测插入穿梭质粒pFY02的基因片段在鸭疫里默氏杆菌中的表达能力,使用 Western blotting的方法来检测RA ATCC pFY02、RA ATCC ΔtonB2pFY02 和 RA ATCC ΔtonB2pFY02::tonB2中的TonB2蛋白水平,TonB2蛋白约42 kDa。结果见图10,RA ATCC pFY02和RA ATCC ΔtonB2pFY02::tonB2中TonB2蛋白的水平相似,而tonB2基因缺失株中没有TonB2蛋白,说明插入穿梭质粒pFY02的基因能够在鸭疫里默氏杆菌中稳定表达。
3 讨论
随着对鸭疫里默氏杆菌研究的深入,基因缺失技术得到广泛应用,使缺失基因的功能得到回补成为研究基因功能的必经之路。然而目前能用于鸭疫里默氏杆菌基因回补的质粒数量有限,且酶切位点较少,接合转移效率低下,成为鸭疫里默氏杆菌基因功能研究的瓶颈。

图5 荧光定量 PCR检测 recA基因和 cfx基因的拷贝数Fig.5 Identification of the copy number of recA and cfx by real-time qPCR.The error bars represent the standard deviations of three independent experiments(n=3).

图6 E.coli S17.1 pFY02、RA ATCC pFY02和RA ATCC pFY02传10代菌落PCR鉴定图Fig.6 Identification of the E.coli S17.1 pFY02,RA ATCC pFY02 and identification after 10 generations of the RA ATCC pFY02 strains by PCR.M: DM5000 DNA marker; 1: oriT and pRA0726 ori gene(about 2 800 bp) was amplified from the plasmid pFY02; 2: oriT and pRA0726 ori gene was amplified from the individual bacterial colonies of E.coli S17.1 pFY02; 3: oriT and pRA0726 ori gene was amplified from the individual bacterial colonies of RA ATCC pFY02; 4: oriT and pRA0726 ori gene was amplified from the individual bacterial colonies after 10 generations of RA ATCC pFY02.

图7 穿梭质粒pFY02结合转移效率提高(A:结合转移后长出的菌落;B:结合转移效率)Fig.7 The shuttle plasmid pFY02 increased efficiency of conjugal transfer.(A) Growth of the bacterial colony after conjugative transfer.a: growth of the bacterial colony after ueing common shuttle plasmid pLMF03 to conjugative transfer; b: growth of the bacterial colony after ueing efficient shuttle plasmid pFY02 to conjugative transfer.(B)Conjugative transfer efficiency).
由于鸭疫里默氏杆菌的特性,普通质粒无法通过电转或者钙转导入鸭疫里默氏杆菌中,因此需要以大肠杆菌为媒介,通过大肠杆菌-鸭疫里默氏杆菌结合转移的方法将穿梭质粒导入鸭疫里默氏杆菌中。本研究构建的穿梭质粒pFY02是在质粒 pPM5的基础上进行改造的。为了提高其结合转移效率,我们将转移位点oriT序列克隆到此质粒中;为了使其能够在鸭疫里默氏杆菌中稳定存在,将鸭疫里默氏杆菌复制起始基因pRA0726 ori克隆到此质粒中;为了方便基因片段插入穿梭质粒上且提高基因的表达量,在穿梭质粒上克隆一段带有多个内切酶位点的高表达启动子序列High EXP。最终使该质粒能高效地进行结合转移并稳定存在于鸭疫里默氏杆菌中;此外该质粒还能稳定地表达回补基因,且其带有的多个酶切位点更有利于回补基因的克隆。

图8 RA ATCC ΔtonB2 pFY02::tonB2的菌落PCR鉴定图Fig.8 Identification of the RA ATCC ΔtonB2 pFY02::tonB2 strains by PCR.M: DM5000 DNA marker; 1:tonB2 gene(about 850 bp) was amplified from the genome of RA ATCC11845; 2–3: tonB2 gene was amplified from the individual bacterial colonies of RA ATCC ΔtonB2 pFY02::tonB2.

图 9 RA ATCC pFY02、RA ATCC ΔtonB2 pFY02 和RA ATCC ΔtonB2 pFY02::tonB2在TSB中的生长曲线Fig.9 Growth curves for RA ATCC pFY02,RA ATCC ΔtonB2 pFY02 and RA ATCC ΔtonB2 pFY02::tonB2 strains in TSB.

图10 Western blotting检测RA ATCC pFY02、RA ATCC ΔtonB2 pFY02 和 RA ATCC ΔtonB2 pFY02::tonB2中的TonB2蛋白Fig.10 The whole-cell extracts from RA ATCC pFY02,RA ATCC ΔtonB2 pFY02 and RA ATCC ΔtonB2 pFY02::tonB2 strains were subjected to Western blotting using an antibody against TonB2.
以前使用的鸭疫里默氏杆菌的穿梭质粒pLMF03,其多克隆位点仅有NcoⅠ、XbaⅠ、XhoⅠ和SpeⅠ四个酶切位点,满足不了鸭疫里默氏杆菌基因的回补,且酶切位点NcoⅠ的序列是CCATGG,其中存在的起始密码子ATG可能会引起回补基因的移码突变,导致回补基因的功能无法正常实现。为了防止回补基因的移码突变及改善酶切位点少的问题,我们用限制性内切酶SalⅠ和XbaⅠ将酶切位点NcoⅠ切除,且在酶切位点XbaⅠ前引进SacⅡ、NheⅠ、StuⅠ和BsshⅡ四个酶切位点,使穿梭质粒 pFY02的使用更安全和方便。
