茶树紫芽中花青素形成相关基因差异表达分析
2018-10-17向奕刘硕谦龚志华陈栋肖文军
向奕,刘硕谦,龚志华,陈栋,肖文军
茶树紫芽中花青素形成相关基因差异表达分析
向奕,刘硕谦,龚志华*,陈栋,肖文军
湖南农业大学园艺园林学院,国家植物功能成分利用工程技术研究中心,茶学教育部重点实验室,湖南省植物功能成分利用协同创新中心,湖南 长沙 410128
花青素是一类广泛存在于植物中的水溶性色素,作为一种强自由基清除剂,它具有抗炎,抗氧化,降血压,降血糖等多种保健功能。紫芽茶树作为一种高花青素含量的特异性茶树资源,其研究与利用越来越受人们的关注。为了解茶树紫芽中花青素形成的分子机理,本研究通过对湖南农业大学自选紫芽品种9803与绿芽品种9806进行转录组测序及生物信息学分析,筛选得到42条与花青素代谢相关的unigene,其中比对到参考基因组中的有34条,未在参考基因组中登录的有8条。KEGG富集分析表明这42个基因被富集到5个代谢通路中,包括类黄酮合成途径,木质素合成途径,黄酮和黄酮醇合成途径,油菜素甾醇合成途径,以及参与转录因子的编码。通过荧光定量PCR验证,差异基因荧光定量PCR变化趋势与转录组测序结果一致,转录组测序数据可靠。本次试验在转录组水平上筛选出了茶叶紫芽花青素代谢相关的差异基因,为进一步揭示茶叶紫芽产生的分子机理奠定了基础。
茶树;花青素;差异基因;转录组测序;生物信息学分析
茶树[(L.) O. Kuntze]属于山茶科(),山茶属(),茶组()植物,原产于我国云南为主的西南地区[1]。茶树是多年生植物,受外界环境影响可产生阶段性紫色芽叶,而特异性紫芽茶树品种全年新梢芽叶均为红色、紫色或红紫色[2]。作为一种特色稀有的茶树资源,紫芽茶具有较高的花青素含量。长期以来,红紫色芽叶因其饮用品质欠佳而被忽略,科学人员在选育茶树品种和制定茶树栽培技术措施时甚至把减少紫色芽叶作为目标之一[3]。但是随着花青素的医学保健功能逐渐被阐明,紫芽茶树资源的创新利用研究也逐渐深入,特色紫芽茶树品种的选育和高花青素茶叶产品的开发利用越来越受人们的关注[4]。
马春雷等[5]利用基因芯片技术对茶叶紫芽与绿芽进行分析,筛选到43个与茶树次生代谢、转录调控等生物学进程相关的差异基因。利用RT-PCR和RACE技术分离得到2个茶树转录因子(登录号:HQ660373)和(登录号:HQ660374)的基因全长,利用荧光定量PCR检测,发现遮阴处理能显著降低茶叶中的花青素含量,并提高的表达。马成英等[6]利用RT-PCR与RACE技术从茶树叶片中克隆得到了1个编码类黄酮-甲基转移酶的基因,并且构建了原核表达载体,使其在大肠杆菌中得到了高效表达。王文丽等[7]利用RT-PCR方法,从cDNA中克隆得到了茶树中编码类黄酮3′-羟化酶的基因,将其命名为。陈林波等[8]对“紫娟”茶树芽、第2叶、开面叶、成熟叶4个时期的转录组进行测序以及生物信息学相关分析,为研究茶树紫芽不同生长时期的差异基因表达奠定了基础。Sun等[9]克隆了1个在茶叶紫芽中上调表达的MYB转录因子,将其命名为,并且印证了是通过形成MBW转录复合物调控茶叶花青素结构基因的表达。
茶叶花青素代谢途径的研究起步较晚,相比于模式植物而言还不够成熟。上述研究对茶叶花青素代谢进行了初步的探讨,部分参与花青素合成的基因已被克隆验证,但是茶叶花青素代谢途径是一个复杂的网络结构,受到多个代谢途径的共同影响,由一系列的酶催化完成。
因此,为进一步揭示花青素合成的遗传机制,本试验研究选取特异性紫芽品种9803作为试验材料,其新梢芽叶全年均表现为紫色,作为一种特色稀有的茶树资源,与普通绿芽品种相比,紫芽品种9803具有更高的花青素含量,是研究花青素形成机理的天然材料。对紫芽品种9803与绿芽品种9806进行转录组测序,在转录组测序的基础上对差异表达基因进行筛选,并对差异基因进行GO(Gene Ontology)富集分析与KEGG(Kyoto Encyclopedia of Genes and Genomes)富集分析,筛选鉴定出茶叶紫芽花青素合成途径相关基因,并对其进行功能注释,为今后进行茶叶花青素代谢相关基因的克隆及功能验证奠定基础。
1 材料与方法
1.1 试验材料
采用湖南农业大学长安茶叶基地自选紫芽品种9803与绿芽品种9806(图1)作为试验材料。9803与9806由安化云台山群体品种中自然选育而得,具有相似的遗传背景。选取颜色一致,长势良好,无机械损伤与病虫灾害的一芽一叶作为试验原料,紫芽与绿芽品种各设置3个生物学重复。锡箔纸包好,液氮就地固样,–80℃超低温冰箱保存,用于转录组测序与荧光定量PCR验证。

图1 实验材料
1.2 花青素含量的测定
花青素含量测定参照陈虎等[10]方法。以0.1 mol·L-1的盐酸乙醇溶液做参比液,用分光光度计测定提取液在530、620、650 nm波长下的吸光值。
花青素光密度值:ODλ=(OD530-OD620)-0.1×(OD650-OD620)
花青素含量/nmol·g-1=ODλ/ε×/×106
ODλ:花青素在530 nm波长下的光密度,ε:花青素摩尔消光系数4.62×104,:提取液总体积(mL),:取样质量(g),106:计算结果换算成nmol的倍数。
1.3 RNA提取
使用Tri-Reagent(Invitrogen,Burlington,ON,Canada)提取茶叶中的总RNA。采用琼脂糖凝胶电泳分析RNA降解程度以及是否有污染,超微量分光光度计(Nanodrop 2000C)和生物分析仪(Agilent 2100)分别检测RNA的浓度及完整性。
1.4 转录组测序
以检测合格后的RNA构建文库,利用Illumina HiSeqTM2000测序平台对库检合格的文库进行双端测序获得原始测序数据。文库的构建及测序工作委托北京诺禾致源科技股份有限公司完成。
1.5 测序数据处理
对原始测序数据进行过滤,去除掉带接头及低质量的reads后,得到clean reads。以Xia等[11]完成的茶树云抗10号基因组作为参考基因组,将clean reads与其进行序列比对;用HTSeq软件对各样品基因表达水平进行统计,基因的表达量用FPKM表示[12];用R语言进行皮尔森相关系数的计算,以皮尔逊相关系数的平方(2)检验样本选择的合理性[13];用DESeq对基因进行差异表达分析,对差异基因的显著性值进行统计,用多重假设检验的方法对值进行校正以控制假阳性率,以校正后的值(adj)<0.05作为差异基因的筛选标准[14];绘制基因差异表达火山图,对差异基因的筛选结果进行直观表示。
1.6 差异基因富集分析
运用GO数据库对差异基因进行功能分类,利用KEGG数据库对差异基因代谢通路进行分析。
1.7 荧光定量PCR验证
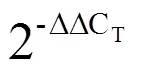
表1 荧光定量PCR引物序列
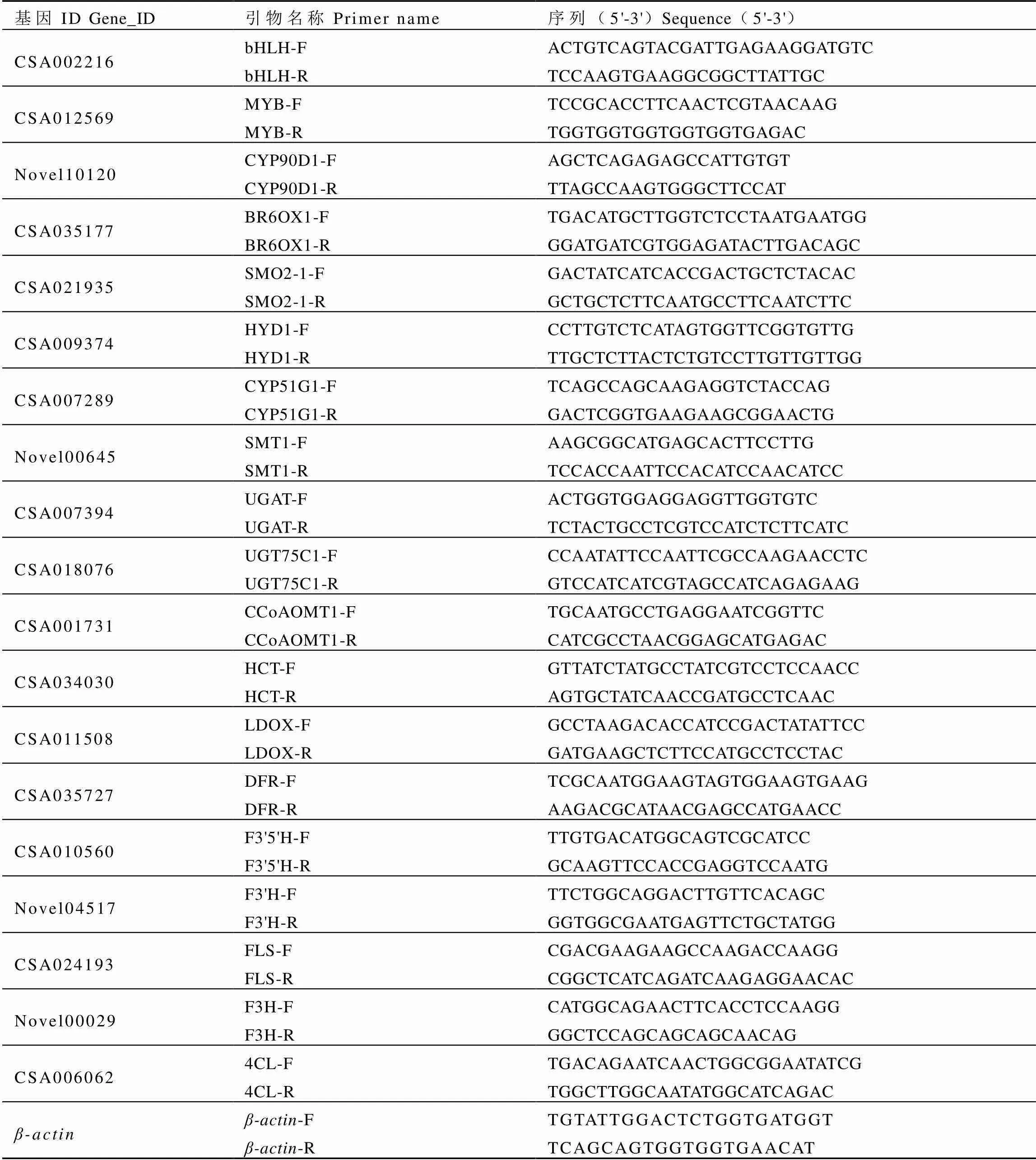
Table 1 Primers for real-time quantitative PCR
1.8 数据分析
试验数据采用Excel 2016、SPSS统计分析软件进行统计分析与差异显著性检验。
2 结果与分析
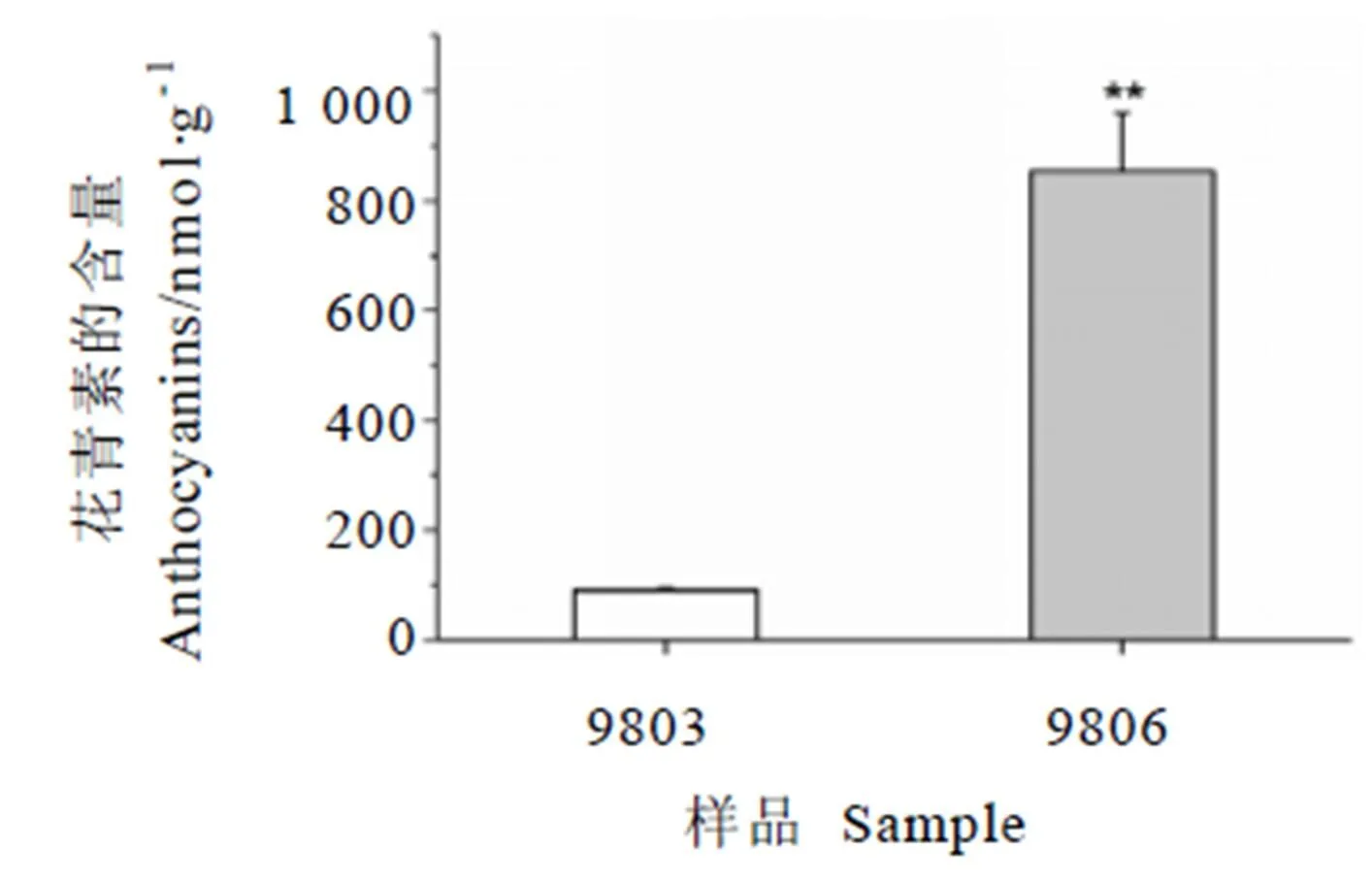
2.1 花青素含量
对紫芽品种9803与绿芽品种9806的花青素含量进行了测定,结果显示紫芽中的花青素含量为(852.82±106.26) nmol·g-1,绿芽中的花青素含量为(90.73±3.60) nmol·g-1。紫芽中的花青素含量约为绿芽中的10倍,差异显著。
2.2 转录组测序质量
本次试验构建紫芽品种9803和绿芽品种9806共6个转录组文库。去除掉带接头及低质量的reads后共获得42.83 Gb的高质量数据。由表2可知,Q30(碱基测序的正确率在99.9%以上的概率)占整个reads长度的94%以上,GC含量占43.9%,与参考基因组的比对率均在80%以上,测序情况良好,符合后续分析要求。
注:**:P<0.01。Notes: **: P<0.01.
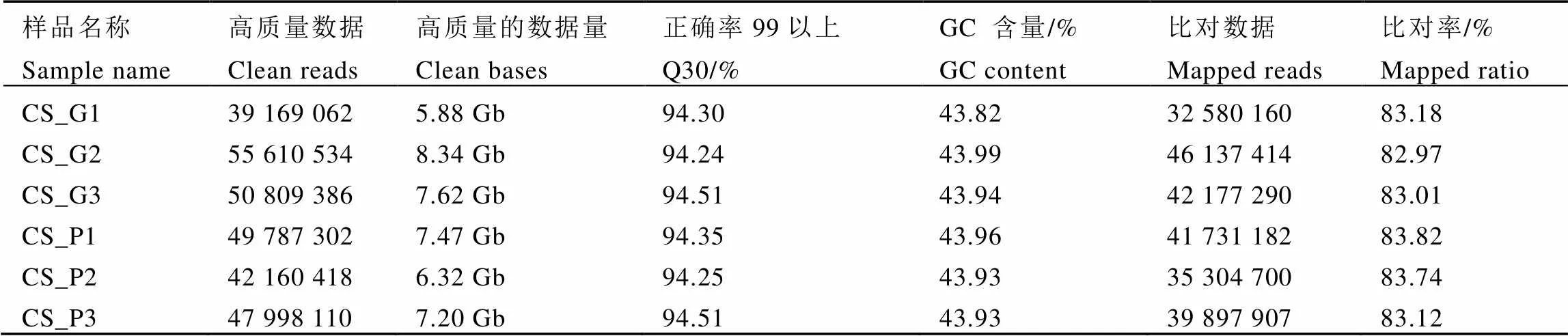
表2 测序数据总体情况
注:CS_G:绿芽品种9806,CS_P:紫芽品种9803,1、2、3:为3组生物学重复。
Note: CS_G: Green variety 9806, CS_P: Purple variety 9803. 1, 2, 3: three biological replicates.
2.3 差异基因的筛选
2(皮尔逊相关系数的平方)是检验试验可靠性和样本选择是否合理的重要指标。2越接近1,说明样品的相关性越强。由表3可知,绿芽品种与紫芽品种之间2大于0.8,生物学重复样品之间2均大于0.95,组内>组间。综上所述,样本选择合理,试验的重复性与可靠性都很高。
以校正后的值(adj)<0.05作为差异基因的筛选标准。为了更加直观地看出差异基因的筛选结果,用火山图显示差异基因的整体分布情况。在图3中,与绿芽品种相比,紫芽品种中有5 289个基因上调,5 771个基因下调,横坐标为基因在两个样本之间表达差异的倍数变化,纵坐标代表基因表达量变化差异的统计学显著性,越靠近上边的点表达差异越显著,越靠近左边与右边的点表达差异越显著。
2.4 差异基因GO富集分析
对差异基因进行GO富集进行分析,共富集出3 835个GO分类,挑选出富集最显著的30个GO分类用富集柱状图进行展示(图4),直观地反映了生物过程、细胞组分和分子功能中富集的GO分类上差异基因的个数分布情况。
这30个GO分类中,被富集到生物过程中的有22个,被富集到细胞组成中的有8个。其中小分子代谢过程(Small molecule metabolic process,GO: 0044281)和分子内氧化还原酶活性(Intramolecular oxidoreductase activity,GO: 0016860)可能包含花青素代谢相关基因。在小分子代谢过程中包含421个差异基因,其中193个上调,228个下调;分子内氧化还原酶活性中包含22个差异基因,其中14个上调,8个下调。
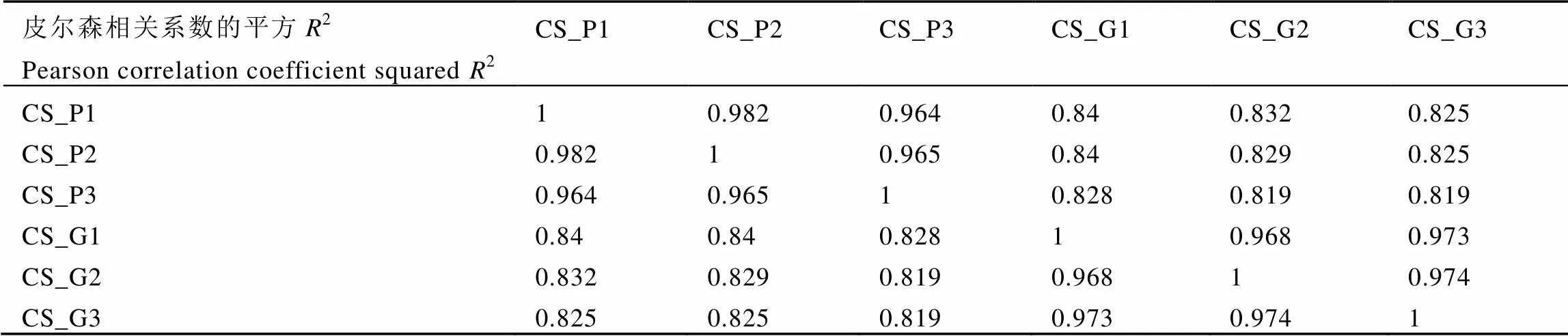
表3 样品间的皮尔森相关系数
注:CS_G:绿芽品种9806,CS_P:紫芽品种9803,1、2、3为3组生物学重复。
Note: CS_G: Green variety 9806, CS_P: Purple variety 9803. 1, 2, 3: three biological replicates.
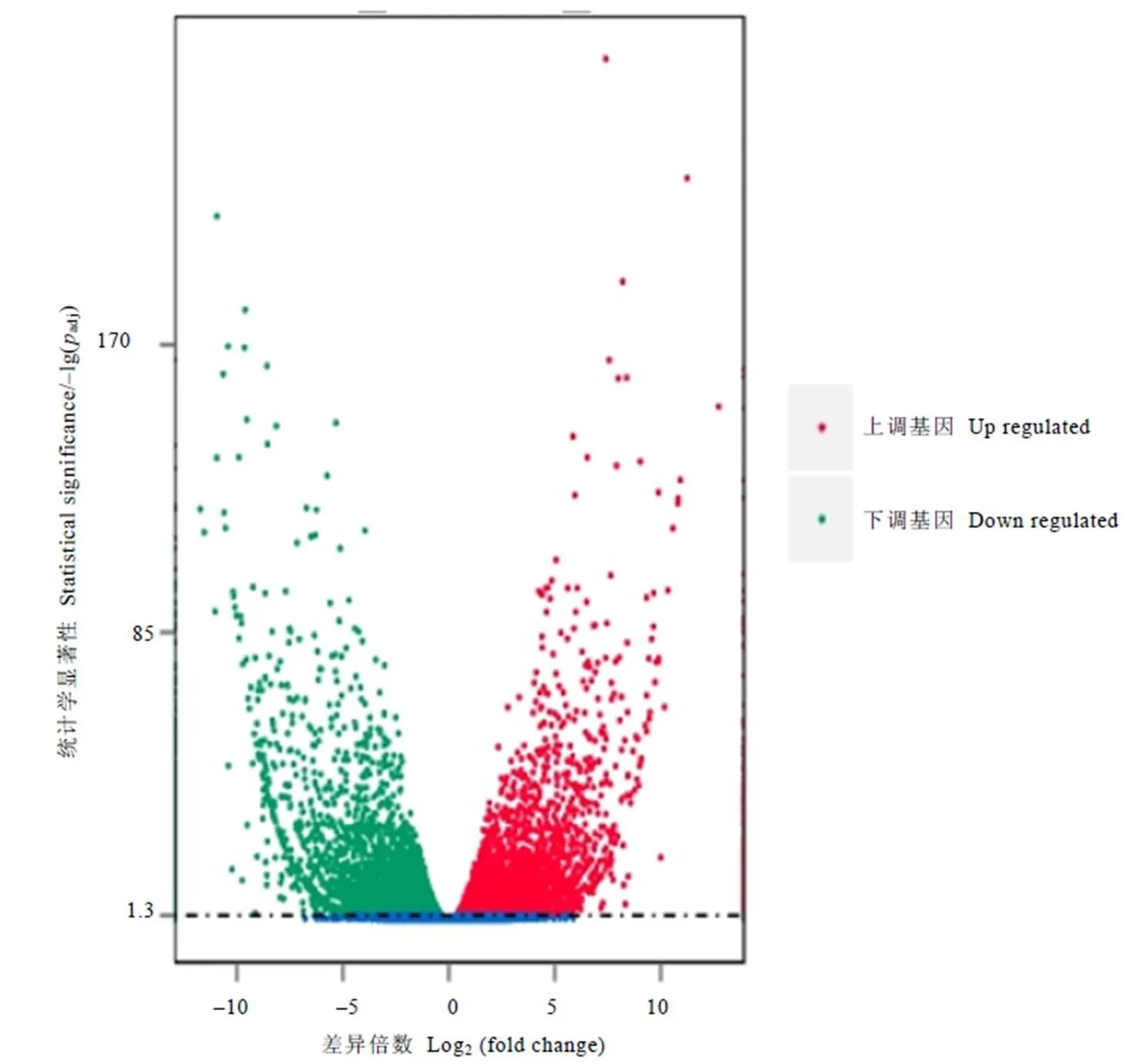
注:差异表达火山图中的每1个点表示1个基因。红色点代表显著上调的基因,共5 289个;绿色点代表显著下调的基因,共5 771个;蓝色的点代表无显著性差异表达的基因。
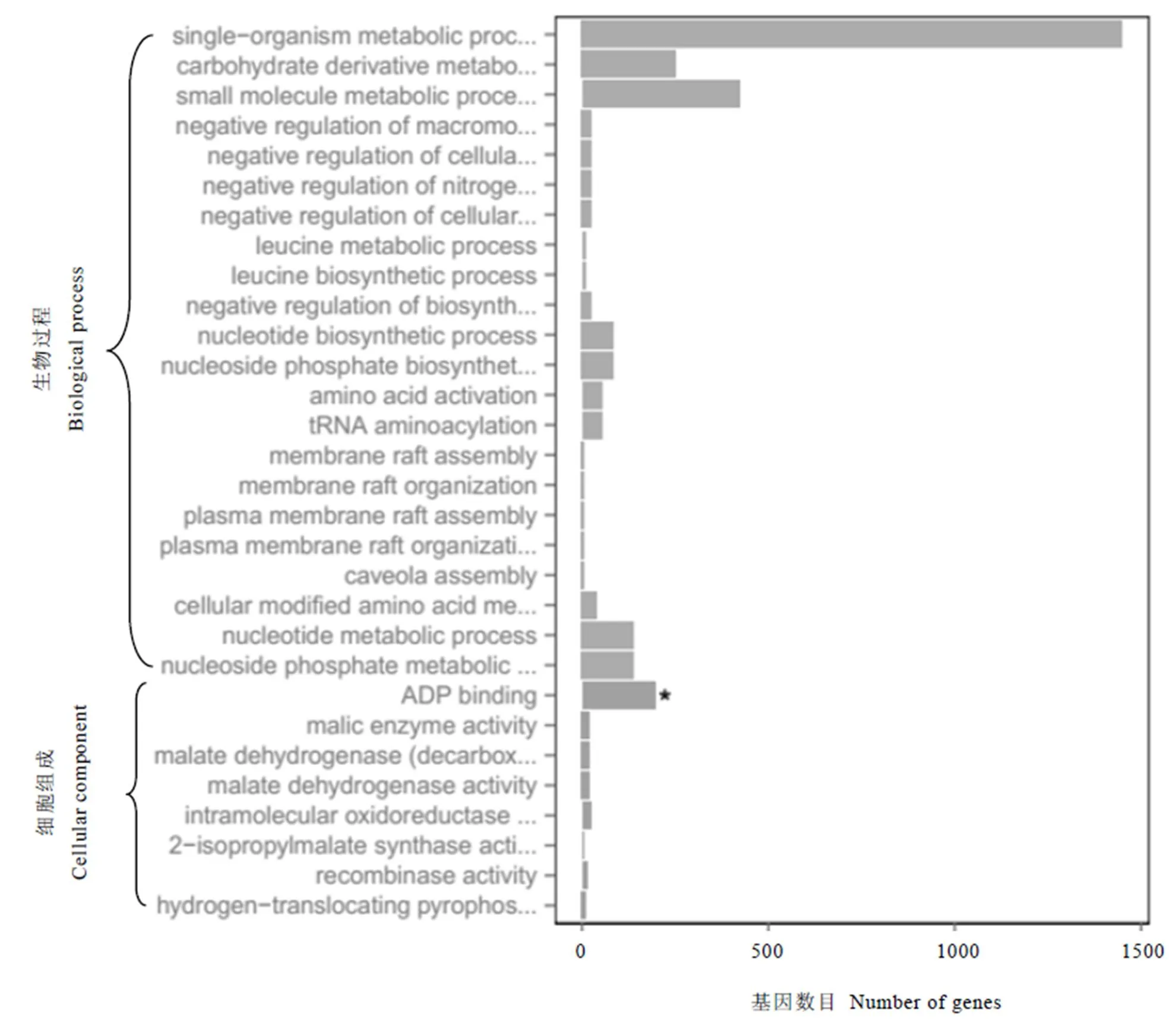
图4 30个最显著的GO分类
2.5 差异基因KEGG富集分析
利用KEGG数据库,对茶叶紫芽形成过程中的代谢途径(Pathway)进行富集分析,筛选出4条与花青素生物合成相关的代谢途径,包括类黄酮生物合成途径(Flavonoid biosynthesis)、黄酮和黄酮醇生物合成途径(Flavone and flavonol biosynthesis)、苯丙素生物合成途径(Phenylpropanoid biosynthesis)、花青素生物合成径(Anthocyanin biosynthesis)。
对上述4条途径中具有显著差异的基因进行KEGG功能注释及SwissProt数据库比对,筛选到与花青素代谢相关的19种酶,统计显示控制这些酶的基因共有42个(表4),其中比对到参考基因组中的有34个,未在参考基因组中登录的有8个。
2.6 荧光定量PCR分析差异基因表达水平
为了验证转录组测序结果的可靠性,在筛选出的花青素代谢相关的42个基因中,每一种酶随机选择1个基因,共19个基因进行荧光定量PCR验证(图5)。结果显示,被测基因荧光定量PCR变化趋势与转录组测序结果一致,说明转录组测序数据可靠。
3 讨论
花青素代谢途径属于植物次生代谢途径中的类黄酮合成途径[15]。周琼琼等[16]通过实时荧光定量PCR发现,茶树中9个类黄酮生物合成关键酶基因和在幼嫩紫叶中均为上调表达。本次研究筛选出24个参与类黄酮合成途径的基因,除外,这些基因均在紫芽中上调表达且集中在类黄酮合成途径的下游,属于花青素合成途径上游的等基因并未发现明显表达差异,推测茶叶紫芽品种9803花青素合成主要由类黄酮合成途径的下游进行调控。
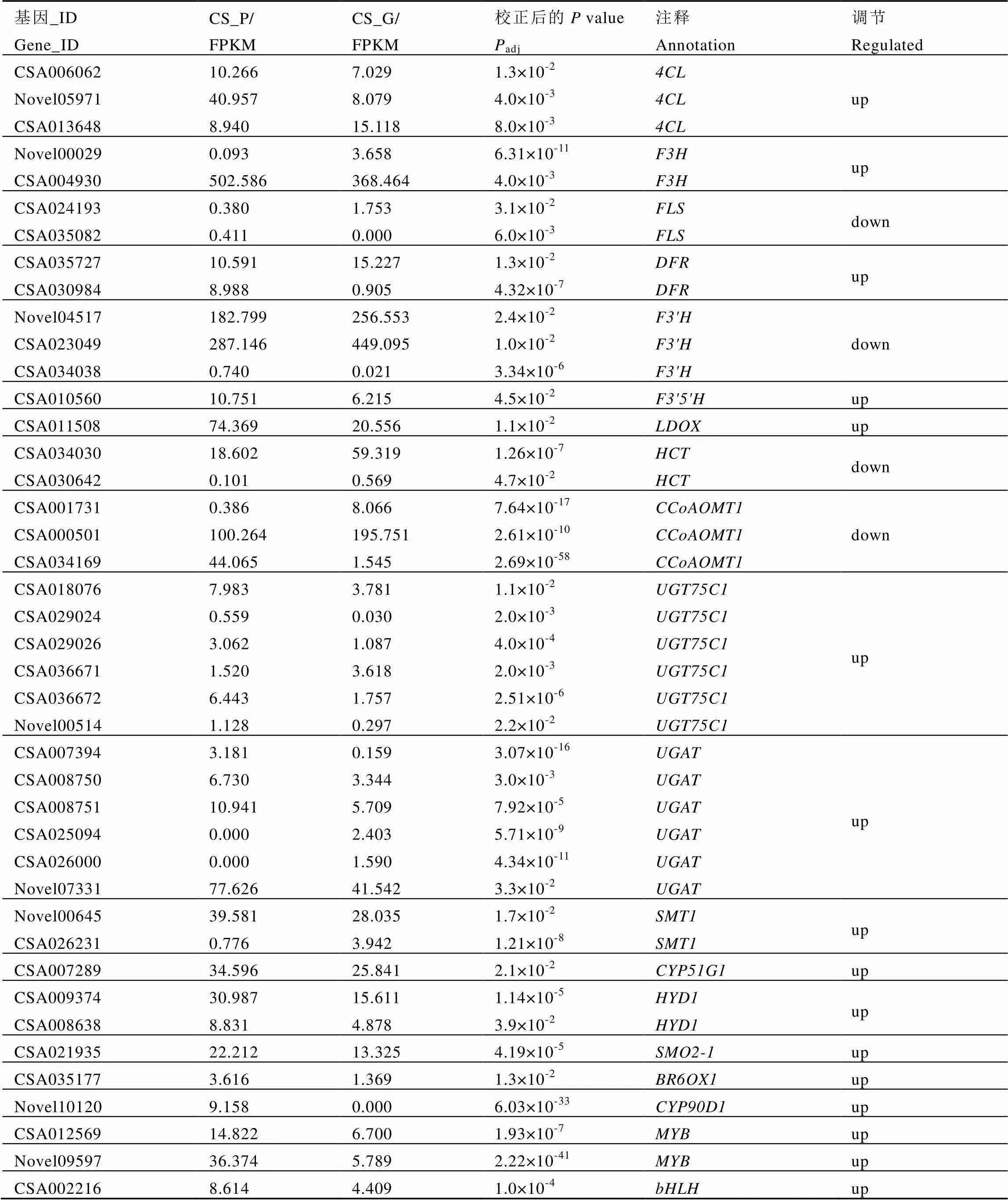
表4 茶叶紫芽中花青素合成相关基因
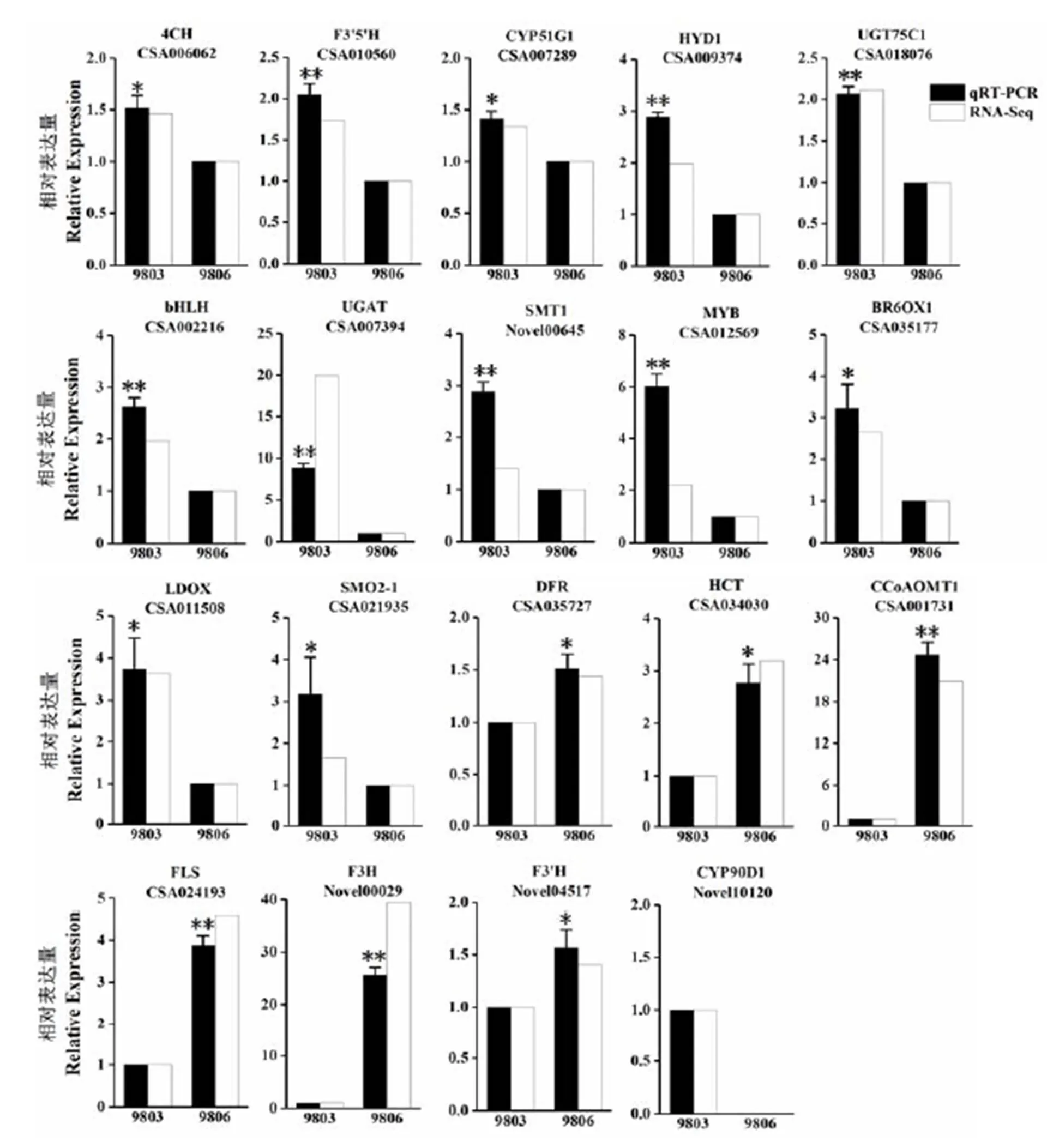
注:通过荧光定量PCR验证差异表达基因,选择13个在9803中高表达与6个在9803中低表达的基因用于荧光定量PCR验证,每个基因的相对表达水平用荧光定量PCR数据(黑色条)和转录组测序数据(白色条)之间的倍数变化表示,用β-actin作为内参基因,星号表明基因表达量在9803和9806之间差异显著,*:P<0.05,**:P<0.01。
周天山等[17]以湄潭苔茶后代的紫色芽叶茶树为材料,发现基因在紫色芽叶中的表达量显著高于绿叶。在本次研究中,在紫芽中的表达量显著高于绿芽,但在紫芽中的表达量却低于绿芽。范晶等[18]的研究表明能够决定花青素B环羟基化的类型进而决定花青素的颜色。可以催化花青素B环3、5位置羟基化最终形成紫色的飞燕草素,则催化花青素B环3位置羟基化最终形成紫红色的矢车菊素。紫芽品种9803中的上调表达及的下调表达使花青素更多地转化为紫色的飞燕草素,这可能是紫芽品种9803主要表现为紫色,而湄潭苔茶后代的紫色芽叶品种则表现为紫红色的原因。
经过类黄酮途径合成的花青素并不稳定,需经过糖基化修饰过程,才能形成具有相对稳定结构的花色苷[19-20]。催化花青素C3位的糖基化形成花青素3--葡萄糖苷(单糖花色苷),是花青素最常见的糖基化修饰方式。王晓帆等[21]成功克隆了茶树类黄酮3--葡萄糖基转移酶基因,通过荧光定量PCR分析表明,该基因在叶片中的表达量较高,根茎中表达量较低。本次研究中未发现具有显著差异的基因,但是调控花青素3--葡萄糖苷5-位置糖基化的基因,及调控花青素3--葡萄糖苷2′′-位置葡萄糖醛酸基化的基因在紫芽品种9803中上调极为显著。Nakatsuka等[22]发现蓝色龙胆中基因可以使花青素形成双糖花色苷,相比于形成的单糖花色苷更为稳定。Sawada等[23]发现红色雏菊中基因可以催化花青素形成花青素3--葡萄糖苷2′′--葡萄糖醛酸,其相比于花青素3--葡萄糖苷更易溶于水,从而促使花色苷在液泡中积累。这说明茶叶中除了外,可能还存在其他的花青素糖基化修饰方式,对完善茶叶花青素代谢途径具有重要意义。
目前,茶叶花青素代谢的分子机理研究主要集中在类黄酮合成途径的结构基因及其相关转录因子上[25, 26],其他代谢途径对花青素代谢的影响则少有报道。杜灵娟等[24]通过葡萄风信子基因与花色性状之间的关联性分析证实了基因与存在同一底物(二氢黄酮醇)的竞争,基因的表达影响黄酮醇合成,同时也影响着花青素含量的积累和花色的呈现。本次研究中在紫芽中表达量下调,使二氢黄酮醇更多地向花青素代谢途径转化,有助于花青素的累积。
同样木质素合成途径与花青素合成途径也存在底物竞争机制[25-26],4-香豆酰-辅酶A不但是花青素合成途径的底物,也是木质素合成途径的底物,与作为木质素合成途径初期的2个关键酶,在紫芽中的下调表达促使了4-香豆酰-辅酶A更多地向花青素途径转化,有利于花青素的积累。
油菜素甾醇作为近几十年来新确认的植物激素,被称为继生长素、细胞分裂素、赤霉素、脱落酸、乙烯之后的第6大类植物激素[27-28]。Peng等[29]研究表明,在拟南芥中油菜素甾醇可以通过调控花青素代谢途径下游基因的生物合成从而促进花青素的积累。本次研究发现8条参与油菜素甾醇代谢途径的基因,且这8个基因均在紫芽中上调表达,与Peng等[29]的研究结果一致。这些基因的上调表达促进了油菜素甾醇的合成,从而对花青素代谢途径下游的基因进行调控,这可能是紫芽中类黄酮合成途径下游基因表达量高的原因之一,与茶叶紫芽花青素合成主要由类黄酮合成途径的下游进行调控的猜想相符。
植物花青素合成途径受到MYB-bHLH- WD40转录复合体调控[30-31],在本次研究中,发现了2个MYB转录因子、1个bHLH转录因子在紫芽中显著上调表达,未发现有显著差异的WD40转录因子,三者可作为调控茶叶紫芽花青素合成的候选基因,其具体调控机制有待进一步验证。
[1] 虞富莲. 论茶树原产地和起源中心[J]. 茶叶科学, 1986, 6(1): 1-8.
[2] 吴华玲, 何玉媚, 李家贤, 等. 11个红紫芽茶树新品系的芽叶特性和生化成分研究[J]. 植物遗传资源学报, 2012, 13(1): 42-47.
[3] 吴华玲, 乔小燕, 李家贤, 等. “红紫芽”茶树新品系的生物学特性研究[J]. 热带作物学报, 2011, 32(6): 1009-1015.
[4] 杨霞, 王利, 李少伟, 等. 花青素抗炎机制的研究进展[J]. 山东医药, 2017, 57(18): 106-109.
[5] 马春雷, 姚明哲, 王新超, 等. 茶树2个MYB转录因子基因的克隆及表达分析[J]. 林业科学, 2012, 48(3): 31-37.
[6] 马成英, 吕海鹏, 林智, 等. 茶树类黄酮-甲基转移酶基因的克隆及原核表达分析[J]. 中国农业科学, 2013, 46(2): 325-333.
[7] 王文丽, 吴致君, 刘志薇, 等. 茶树类黄酮3′-羟化酶基因的克隆与表达特性分析[J]. 茶叶科学, 2017, 37(1): 108-118.
[8] 陈林波, 夏丽飞, 周萌, 等. 基于RNA-Seq技术的“紫娟”茶树转录组分析[J]. 分子植物育种, 2015, 13(10): 2250-2255.
[9] Sun B M, Zhu Z S, Cao P R, et al. Purple foliage coloration in tea (L.) arises from activation of the R2R3-MYB transcription factor CsAN1 [J]. Sci Rep, 2016, 6(15): 32534. DOI: 10.1038/srep32534.
[10] 陈虎, 叶英, 秦艳婷, 等. 黑果枸杞花青素在水相体系中的稳定性研究[J]. 食品工业科技, 2016, 37(19): 127-131.
[11] Xia E H, Zhang H B, Sheng J, et al. The tea tree genome provides insights into tea flavor and independent evolution of caffeine biosynthesis [J]. Mol Plant, 2017, 10(6): 866-877.
[12] TRAPNELL C, WILLIAMS B A, PERTEA G, et al. Transcript assembly and quantification by RNA-Seq reveals unannotated transcripts and isoform switching during cell differentiation [J]. Nat Biotechnol, 2010, 28(5): 511-515.
[13] MCKENNA A, HANNA M, BANKS E, et al. The Genome Analysis Toolkit: A MapReduce framework for analyzing next-generation DNA sequencing data [J]. Genome Res, 2010, 20(9): 1297-1303.
[14] ANDERS S, HUBER W. Differential expression analysis for sequence count data [J]. Genome Biol, 2010, 11(10): R106.
[15] WANG Y S, GAO L P, SHAN Y, et al. Influence of shade on flavonoid biosynthesis in tea ((L.) O. Kuntze) [J]. Sci Hortic, 2012, 141(3): 7-16.
[16] 周琼琼, 孙威江. 茶树芽叶紫化的生理生化分析及其关键酶基因的表达[J]. 生物技术通报, 2015, 31(1): 86-91.
[17] 周天山, 王新超, 余有本, 等. 紫芽茶树类黄酮生物合成关键酶基因表达与总儿茶素、花青素含量相关性分析[J]. 作物学报, 2016, (4): 525-531.
[18] 范晶, 黄明远, 吴苗苗, 等. 山茶属三个F3H基因的分子特性、系统进化及蛋白结构差异分析[J]. 基因组学与应用生物学, 2016, 35(5): 1195-1205.
[19] LI B F, HE X J, ZHANG S, et al. Efficient synthesis of 4--β-D-glucopyranosylferulic acid from ferulic acid by whole cells harboring glycosyltransferase GTBP1[J]. Biochem Eng J, 2018, 130(15): 99-103.
[20] RYU J, EOM M S, KO W, et al. A fluorescence-based glycosyltransferase assay for high-throughput screening [J]. Bioorg Med Chem, 2014, 22(8): 2571-2575.
[21] 王晓帆, 田艳维, 王云生, 等. 茶树类黄酮3--葡萄糖基转移酶基因的克隆和表达分析[J]. 茶叶科学, 2012, 32(5): 411-418.
[22] NAKATSUKA T, SATO K, TAKAHASHI H, et al. Cloning and characterization of the UDP-glucose: anthocyanin 5--glucosyltransferase gene from blue-flowered gentian [J]. J Exp Bot, 2008, 59(6): 1241-1252.
[23] SAWADA S Y, SUZUKI H, ICHIMAIDA F, et al. UDP-glucuronic acid:anthocyanin glucuronosyltransferase from red daisy () flowers enzymology and phylogenetics of a novel glucuronosyltransferase involved in flower pigment biosynthesis [J]. The Journal of biological chemistry, 2005, 280(2): 899-906.
[24] 杜灵娟, 陈凯利, 刘雅莉. 葡萄风信子1基因克隆及其表达与花色性状之间的关联性分析[J]. 西北林学院学报, 2017, 32(1): 106-113.
[25] 石海燕, 张玉星. 木质素生物合成途径中关键酶基因的分子特征[J]. 中国农学通报, 2011, 27(5): 288-291.
[26] LI H Y, YANG Y, WANG Z J, et al.gene role in lignin biosynthesis ofSuk by transcriptome analysis [J]. J For Res, 2016, 27(5): 1111-1120.
[27] 任鸿雁, 王莉, 马青秀, 等. 油菜素内酯生物合成途径的研究进展[J]. 植物学报, 2015, 50(6): 768-778.
[28] YE H X, LI L, YIN Y H. Recent advances in the regulation of brassinosteroid signaling and biosynthesis pathways [J]. J Integr Plant Biol, 2011, 53(6): 455-468.
[29] PENG Z H, HAN C Y, YUAN L B, et al. Brassinosteroid enhances jasmonate-induced anthocyanin accumulation inseedlings [J]. J Integr Plant Biol, 2011, 53(8): 632-640.
[30] XIE Y, TAN H J, MA Z X, et al. DELLA proteins promote anthocyanin biosynthesis via sequestering MYBL2 and JAZ suppressors of the MYB/bHLH/WD40 complex in[J]. Mol Plant, 2016, 9(5): 711-721.
[31] 李茂福, 杨媛, 王华, 等. 月季bHLH基因的克隆、表达及其与MYB和WD40的互作分析[J]. 园艺学报, 2017, 44(10): 1949-1958.
Differential Expression Analysis of Genes Related to Anthocyanin Biosynthesis in Purple Buds of Tea Plant ()
XIANG Yi, LIU Shuoqian, GONG Zhihua*, CHEN Dong, XIAO Wenjun
College of Horticulture and Landscape, Hunan Agricultural University, National Research Center of Engineering Technology for Utilization of Botanical Functional Ingredients, Key Laboratory of Tea Science of Ministry of Education, Collaborative Innovation Center of Utilization of Functional Ingredients from Botanicals, Changsha 410128, China
Anthocyanins are water-soluble pigments which widely exist in plants. As strong free radical scavengers, they have many health benefical functions from anti-inflammatory, anti-oxidation, blood pressure lowering to hypoglycemic effect. The purple tea plants are a kind of specific tea germplasm rich in anthocyanins. More and more attentions had been focused on research and utilization of purple tea plants. In order to understand the molecular mechanism of anthocyanin biosynthesis in purple buds of tea, RNA-seq and bioinformatic analysis were performed using purple-buds cultivar 9803 and green-buds cultivar 9806 bred by Hunan Agricultural University, Changsha, China. Totally 42 unigenes were identified to be involved in anthocyanin biosynthetic pathway, including 34 genes registered in the GenBank database and 8 genes not reported. KEGG pathway analysis showed that differentially expression genes annotated to five metabolic pathways, including flavonoid biosynthetic pathway, lignin biosynthesis pathway, flavone and flavonol biosynthesis pathway, brassinosteroid biosynthesis pathway and encodingtranscription factors. The expression profiles of differentially expressed genes by qRT-PCR were consistent with transcriptome sequencing results, demonstrating the sequencing results were reliable. In summary, many differentially expressed genes related to anthocyanin biosynthesis in the purple buds of tea were identified, which laid the foundation for further investigation of the molecular mechanism of purple bud formation in tea plants.
tea plant, anthocyanin, differentially expressed genes, transcriptome sequencing, bioinformatics analysis
S571.1;Q52
A
1000-369X(2018)05-439-11
2018-02-05
2018-04-01
国家自然科学基金(31670689)
向奕,男,硕士研究生,主要从事茶树栽培育种及分子生物学研究。
gzh041211@163.com
