骨髓基质细胞中MGAT3催化的平分型N-糖链对血液细胞黏附和迁移的影响
2018-10-15张鑫庞星辰李想
张鑫, 庞星辰, 李想,2
(1. 江南大学 生物工程学院, 无锡 214122; 2. 西北大学 生命科学院, 西安 710069)
骨髓造血微环境(hemopoietic bone marrow microenviorment, HBMM)是由骨髓中邻近造血干细胞的特殊细胞群组成,在干细胞调节、自我更新和分化中起重要作用[1]。骨髓基质细胞是造血微环境的重要组成之一,在促进造血干细胞生成血细胞的各个环节中起着十分重要的作用[2]。在研究骨髓基质细胞时,人骨髓基质细胞HS5、HS27a 是最常用的细胞株,HS5成纤维状,能分泌多种细胞因子如CSF(Colony stimulating factor)、白细胞介素-6(Interleukin-6,IL-6)、IL-8 和IL-11 等,而HS27a 呈现出表皮细胞状,分泌较低水平的生长因子[3]。它们与血液细胞的共培养体系,常被用于研究造血微环境对造血干细胞增殖、分化及凋亡的影响[4-8]。
蛋白质N-糖基化是发生在内质网和高尔基体中,由多种酶的调节,糖供体转运蛋白和辅助蛋白的协同作用下的一个复杂的过程。N-聚糖的特异性及其与内源性凝集素的结合对于糖蛋白的正确折叠和运输至关重要[9]。N-乙酰氨基葡萄糖转移酶3,即MGAT3,是与N-糖链合成或分解代谢相关的基因。前期研究表明,HS5比HS27a中表达高水平的MGAT3,MGAT3能催化生成以β-1,4 键连接于N-糖链β-Man上的平分型GlcNAc[10](图1)。推测HS5比HS27a表达更多的平分型N-糖链。蛋白质上的平分型N-糖链糖基化修饰对细胞内信号转导、细胞黏附、细胞迁移等生物过程都有重要影响[11]。MGAT3 催化生成的平分型N-糖链能够抑制细胞生长因子途径,如Ras 信号途径,从而抑制肿瘤的增长和迁移[12]。而MGAT3 催化生成的平分型N-糖链在造血微环境中的作用尚未有深入研究。

图1 平分型GlcNAc 结构
本文以基质细胞HS5和血液细胞KG1a和PL-21共培养体系为模型,检测HS5细胞中干扰N-乙酰氨基葡萄糖转移酶3(MGAT3)以及对应的平分型N-糖链表达。旨在将为深入研究糖链参与骨髓造血微环境对血液细胞的行为提供依据。
1 材料与方法
1.1 材料
HS5是由携带人刺瘤病毒E6/E7基因的复制缺陷型重组逆转录病毒转染人骨髓基质细胞构建,HS5和PL-21均获自美国Fred-Hutchinson Cancer Research Center (FHCRC) Dr. Deeg实验室;KG1a细胞(最初衍生自AML患者)获自American Type Culture Collection;大肠杆菌JM109及质粒pLVX、psPAX2、pMD2.G由本实验室保存。
RPMI1640培养基、胎牛血清购于美国Biological Industries 公司;细胞RNA提取试剂盒、无内毒素质粒小提试剂盒、UltraSYBR Mixture (High ROX)购于北京康为世纪生物科技有限公司;BCA蛋白浓度测定试剂盒(增强型)、增强型CCK-8试剂盒、细胞膜红色荧光探针、辣根过氧化物酶(HRP)标记山羊抗小鼠 IgG(H+L)、辣根过氧化物酶(HRP)标记山羊抗兔 IgG(H+L)购于上海碧云天生物技术有限公司;MGAT3抗体购于英国Abcam公司;PHA-E、多聚甲醛购于美国Sigma公司;Lipofectamine®2000 转染试剂购于Invitrogen 公司;限制性内切酶、DNA Ladder marker购于TaKaRa公司;反转录酶、RNase Inhibitor购于Toyobo公司。
1.2 方法
1.2.1 MGAT3干扰表达载体构建
根据RNA干扰原则设计MGAT3基因的RNA干扰序列,利用分子克隆手段构建重组质粒pLVX-shNC 、pLVX-shMGAT3-1、pLVX-shMGAT3-2。用菌落PCR方法筛选阳性转化子。电泳双酶切验证后送至上海睿迪生物科技有限公司进行测序。得到正确的重组质粒pLVX-shNC 、pLVX-shMGAT3-1、pLVX-shMGAT3-2。
1.2.2 细胞培养
细胞株均培养在含10%胎牛血清(Fetal Bovine Serum,FBS)、100 U/mL 青霉素和100 μg/mL链霉素的RPMI1640培养基中。培养条件为37℃, 5% CO2。
1.2.3 细胞稳定转染
将生长良好的293T细胞传代至T25培养瓶,待细胞生长至70%~80%时,换新鲜培养基,放于细胞培养箱等待转染。准备2个离心管,分别加入250 μL DMEM培养基,其中一管加入250 μL Lipofectamine® 2000 转染试剂,另一管加入5 μg重组质粒、3.75 μg psPAX2和1.25 μg pMD2.G混合均匀。将2个离心管混合吹匀,室温孵育5 min后转移至293T细胞培养液中摇匀。转染时间48 h。收集293T细胞上清液,过滤后于-80℃保存。
将待转染的细胞传至12孔板,生长至10%即可转染。吸入原有培养基,加入1 mL病毒液,4 h后加入1 mL完全培养基,24 h后吸去含有病毒的培养液,换成新鲜的完全培养基,培养24 h后可用含有1 μg/mL puro抗生素的培养基筛选。扩大培养后,用RT-PCR及蛋白质免疫印迹验证,得到稳定转染株。
1.2.4 实时荧光定量PCR
用细胞RNA提取试剂盒(CW0560康为世纪)提取细胞RNA,反转录成cDNA,用UltraSYBR Mixture (High ROX)试剂盒,每组数据3次平行进行PCR。反应体系为Mix buffer 7.5 μL、上游引物(10 μmol/L)0.3 μL、下游引物(10 μmol/L)0.3 μL、模板cDNA 1.2 μL、ddH2O 5.7 μL。反应条件为95℃预变性10 min;95℃变性15 s,60℃退火60 s,72℃延伸5 min,共40个循环。实验数据用2-ΔΔCT方法量化目的基因的倍性变化[13]。
1.2.5 蛋白质印迹
胰酶消化细胞并收集,预冷PBS洗涤细胞3次,加入蛋白裂解液(1 mL RIPA、1%蛋白酶抑制剂)冰上裂解30 min,14 000 r/min离心15 min。BCA蛋白浓度测定试剂盒测定蛋白浓度,加入5×loading Buffer煮沸5 min。取等量蛋白样品上样进行SDS-PAGE电泳分离,电泳后将蛋白质样品转移至0.45 μm PVDF膜。转膜结束后用5%脱脂牛奶的TBST溶液37℃封闭1~2 h,加入一抗(比例按照抗体说明)4℃过夜孵育。TBST洗涤5次,加入相同属源的二抗室温孵育1 h,TBST洗5次,用Pro-light HRP化学发光检测试剂显色,并于ChemiDocTM XRS+凝胶成像系统扫描成像。
1.2.6 凝集素印迹
样品处理、电泳及转膜步骤同蛋白质印迹,转膜后用含5%牛血清白蛋白(bovine serum albumin,BSA)的PBST封闭液37℃封闭1~2 h,加入生物素标记的凝集素4℃过夜孵育。PBST洗涤5次,用VECTASTAIN Elite ABC HRP Kit室温孵育1 h,PBST洗涤5次,Pro-light HRP化学发光检测试剂显色,并于ChemiDocTM XRS+凝胶成像系统扫描成像。
1.2.7 凝集素细胞染色
将灭菌圆形盖玻片置于24孔细胞培养板中,接种适量细胞培养至80%左右。PBS洗 3次,加入新鲜的4%多聚甲醛液室温固定15 min。弃固定液,PBS 洗3~5 次,加入2% Triton-100通透液室温通透10 min。弃通透液,PBS 洗3~5次,5% 牛血清蛋白(bovine serum albumin,BSA) 溶液4℃过夜封闭。PBS洗3次,然后用Cy3 标记好的浓度为5 μg/mL PHA-E室温避光孵育3 h,PBS洗3 遍,5 μg/mL 4′, 6-二脒基-2-苯基吲哚(DAPI) 避光染色10 min,将玻片倒扣在滴有Glycergel 固封剂的载玻片上,用leica TCS SP8共聚焦显微镜下拍照观察。
1.2.8 细胞黏附实验
将基质细胞接种于96孔板培养12~24 h使细胞单层平铺于板底。KG1a、PL-21细胞用DiI细胞膜红色荧光探针标记,于不含血清的培养基中饥饿培养4 h。将饥饿处理后的KG1a、PL-21细胞按10∶3细胞量比例加入到培养基质细胞的96孔板中,共培养2 h,使KG1a、PL-21细胞贴壁。吸出非贴壁细胞,磷酸盐缓冲液PBS洗涤3次,使用荧光酶标仪测量荧光强度。
1.2.9 细胞迁移实验
将基质细胞铺于24孔transwell板下室,KG1a、PL-21细胞用DiI细胞膜红色荧光探针标记,于不含血清的培养基中饥饿培养4 h。将饥饿处理后的肿瘤细胞按10∶3细胞量比例加入transwell板上室。37℃培养4 h,吸出上室细胞,使用酶标仪测量上室膜上细胞荧光强度。
1.2.10 细胞增殖实验
细胞铺于96孔板,每孔100 μL约2000个细胞,细胞贴壁后每孔加入10 μL CCK-8溶液。在培养箱中孵育,以无细胞空白培养基和CCK-8溶液为对照,分别在0.5、1、1.5和2 h后用酶标仪检测,选出吸光度比较合适的时间点作为后续实验的时间检测点。 接种对照组和干扰组细胞24、48、72、96 h后在450 nm测定吸光度。
1.2.11 数据分析
用Gel-pro进行凝胶电泳及荧光定量分析。采用PraphPad Prism 5进行t检验分析,P<0.05为差异具有统计学意义。
2 结果与分析
2.1 MGAT3干扰质粒的构建及验证
根据实验方法构建pLVX-shNC 、pLVX-shMGAT3-1、pLVX-shMGAT3-2。菌落PCR筛选出阳性克隆,电泳图中显示片段大小分别为150、150,符合预期(图2)。 基因测序结果表示pLVX-shMGAT3-1、pLVX-shMGAT3-2构建成功。
1:DL1000 DNA Marker;2:重组质粒pLVX-shMGAT3-1;3:pLVX-shMGAT3-2
图2重组干扰质粒pLVX-shMGAT3-1、pLVX-shMGAT3-2的菌落PCR验证
Fig 2 Verification of pLVX-shMGAT3-1, pLVX-shMGAT3-2 recombinant interference plasmid by bacterial colony PCR
2.2 干扰 MGAT3的细胞株筛选
提取HS5-shNC 、HS5-shMGAT3-1、HS5-shMGAT3-2细胞中的RNA,利用反转录试剂盒将其反转录为cDNA,采用RT-PCR定量分析3种细胞中MGAT3基因的表达差异。发现在HS5-shMGAT3-1、HS5-shMGAT3-2中MGAT3基因表达量明显降低(图3-A)。提取3株细胞株中的总蛋白,进行蛋白质印迹实验, 分析MGAT3蛋白水平上的差异。结果证实,MGAT3干扰细胞株中MGAT3蛋白质水平的表达明显降低(图3-B)。

A:MGAT3转录水平检测;B: MGAT3蛋白水平检测;C: MGAT3蛋白水平检测量化图。*:P<0.05;**:P<0.01;***:P<0.001
图3 HS5细胞中构建沉默MGAT3的验证
Fig 3 Validation the construction of HS5-shMGAT3 cells
2.3 干扰细胞株中平分型糖链的检测
通过检测干扰后细胞与凝集素PHA-E的不同结合能力分析干扰前后细胞株中平分型N-糖链的差异。结果表明MGAT3的沉默使得干扰细胞株的平分型N-糖链表达水平降低(图4)。

A:MGAT3干扰细胞株中平分型N-糖链表达检测;B:细胞凝集素染色检测平分型N-糖链表达,DIPA(蓝色)染色细胞核;连接Cy3的PHA-E(红色)染色平分型糖链;C:细胞凝集素染色量化图。*:P<0.05;**:P<0.01;***:P<0.001
图4沉默MGAT3后HS5中平分型N-糖链表达的验证
Fig 4 Validation expression of bisecting GlcNAc in HS5 cells after inhibiting MGAT3
2.4 MGAT3干扰后对基质细胞增殖的影响
以HS5-shNC为例测0.5、1、1.5、2 h时450 nm吸光度值,结果可知1 h为适宜时间点(图5-A)。将干扰MGAT3后的HS5细胞与对照组细胞进行CCK-8实验,结果显示干扰MGAT3后HS5的增殖能力无明显变化(图5-B)。

A:吸光值为0.5左右的时间为最适时间点;B:CCK-8测量细胞增殖图
图5干扰MGAT3对HS5细胞株的影响
Fig 5 Effect of silencing MGAT3 on cell proliferation of HS5
2.5 HS5中干扰MGAT3后对KG1a、PL-21细胞黏附的影响
将上述获得的稳定转染细胞、对照组细胞分别与KG1a、PL-21共培养,观察KG1a、PL21细胞的黏附,结果表明KG1a、PL-21细胞对基质细胞的黏附能力在MGAT3干扰后受到明显抑制(图6)。
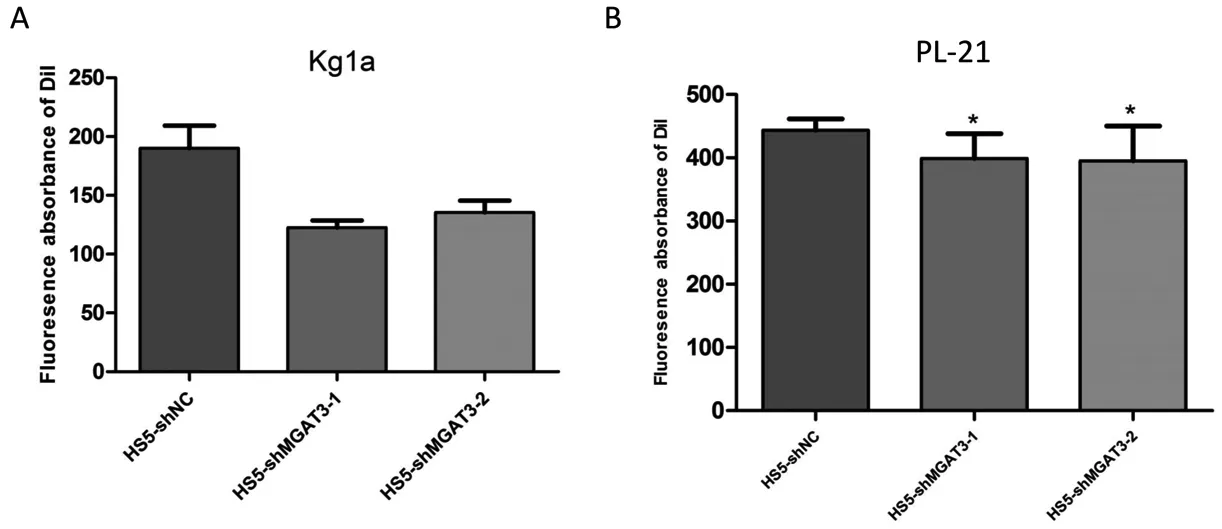
*:P<0.05;**:P<0.01;***:P<0.001
图6 HS5细胞中干扰MGAT3对KG1a和PL-21细胞黏附的影响
Fig 6 Cell adhesion of KG1a and PL-21 after co-cultured with HS5 or modified HS5 cells
2.6 MGAT3干扰后对肿瘤细胞迁移的影响
将上述获得的稳定转染细胞、对照组细胞与KG1a、PL21共培养,观察KG1a、PL21细胞的迁移,KG1a、PL21细胞对基质细胞的迁移能力在MGAT3干扰后受到明显抑制(图7)。

*:P<0.05;**:P<0.01;***:P<0.001
图7 HS5细胞中干扰MGAT3对KG1a和PL-21细胞迁移的影响
Fig 7 Cell migration of KG1a and PL-21 after co-cultured with HS5 or modified HS5 cells
3 讨论与结论
在肿瘤微环境中,糖链表达变化能使肿瘤细胞发生类似于发育过程中受体的激活,细胞黏附和细胞迁移的变化等。也有研究表明在人黑色素瘤细胞中过表达MGAT3使黑素瘤细胞迁移能力增强[9]。在乳腺癌细胞中过表达MGAT3 导致平分型N-糖链表达增强,抑制小鼠的代谢活性,可以显著延缓小鼠乳腺肿瘤的发展[14]。而平分型N-糖链在造血微环境中的作用研究尚未深入。
本实验利用基因工程技术构建了沉默MGAT3的稳定转染型细胞株HS5-shMGAT3。由于MGAT3 催化生成以β-1,4 键连接于N-糖链β-Man 上的平分型GlcNAc。利用凝集素染色和细胞染色方法检测到HS5-shMGAT3中平分型N-糖链表达下调,与预测相一致。
造血微环境的异常往往伴随着基质细胞上某些糖蛋白及蛋白上的糖链表达异常。例如,Glavey等[15]研究证明在多发性骨髓瘤细胞中干扰β-半乳糖苷α-2,3唾液酸转移酶,即ST3GAL6,能够抑制多发性骨髓瘤细胞向骨髓基质细胞的黏附和迁移。我们的研究发现基质细胞中MGAT3基因沉默改变了血液细胞KG1a、PL-21的黏附能力和迁移能力。有报道证明,分子水平上MGAT3 及平分型GlcNAc 结构通过改变黏附分子及细胞外基质,如上皮细胞钙黏蛋白(E-cadherin)、层黏连蛋白(laminin)及整合素(integrin)的N-糖基化修饰来影响细胞黏附与迁移[16-18]。而在共培养体系中,糖链在造血微环境中如何调控血液细胞的黏附和迁移能力是我们下一步研究的重点。
本实验结果证实骨髓基质细胞HS5中MGAT3催化的平分型N-糖链对血液细胞KG1a、PL-21黏附和迁移有重要作用,为进一步基质细胞表面糖链的差异对血液细胞的不同生物学功能提供了理论依据。实验构建的MGAT3干扰细胞株为研究共培养时对血液细胞增殖、凋亡等相关信号通路的变化提供良好的细胞模型,也为深入研究糖链参与骨髓造血微环境对血液细胞再生和分化的作用奠定研究基础。
