HaV01 Pol内部半胱氨酸对其剪接活性的影响
2018-10-15李佳,孟清
李 佳, 孟 清
(东华大学 生物科学与技术研究所,上海 201620)
蛋白质内含子(intein)是位于蛋白质前体中的一段多肽序列。通过蛋白质剪接,它可以从前体蛋白中自我切除,同时将两端的外显子以肽键的形式连接起来,形成成熟的蛋白质。蛋白质内含子根据其结构特点可分为3种类型:标准蛋白质内含子、微小蛋白质内含子和断裂蛋白质内含子[1-2]。每一类蛋白质内含子都有3个区域,N端剪接结构域、中间归巢核酸内切酶区域或中间连接子(Linker)和C端剪接结构域[3-4]。根据蛋白质内含子剪接过程的不同,将内含子又分为3种类型,一型、二型和三型蛋白质内含子[5]。
近年来,蛋白质内含子在分子生物学研究中得到了越来越多的应用,尤其是断裂蛋白质内含子的应用[2,6],包括蛋白质的纯化、蛋白拼接、蛋白的环化、蛋白标记等[7-12]。因此为了不同的研究目的,对蛋白质内含子的改造和修饰也越来越多。蛋白质内含子的剪接活性主要和内含子保守区的氨基酸有关,包括N端第一个氨基酸(Ser或Cys),C端外显子第一个氨基酸(Ser、Cys或Thr)以及C端倒数第一个氨基酸(Asn或Gln)。同时也和几个保守的模块相关,但是很少有和保守区外其他个别氨基酸相关。在intein的氨基酸序列中,半胱氨酸属于比较稀有的氨基酸,而半胱氨酸的巯基又具有稳定的化学特性,是连接和标记的重要基团。因此已经有文献报道利用N端、C端无半胱氨酸的断裂蛋白质内含子进行标记[13-14]。但截至目前,可利用的蛋白质内含子仍非常少。主要是因为大部分intein的N端第一位为半胱氨酸。而N端-1位至-3位的氨基酸也经常伴有半胱氨酸[15]。而保守模块氨基酸的突变大部分会影响intein的剪接活性,甚至导致剪接活性丧失。因此寻找内部无半胱氨酸、且剪接活性较好的蛋白质内含子对于intein的应用非常有利。
本文发现蛋白质内含子HaV01 Pol的N端第1位、N端外显子的3位和C端外显子的3位均不是半胱氨酸;而且内部的4个半胱氨酸均不在保守模块内[3]。因此我们想通过定点突变等方法将其内部半胱氨酸替换成其他氨基酸。最终成功获得了两个有剪接活性且内部无半胱氨酸的蛋白质内含子。为该蛋白质内含子的进一步改造和应用奠定了基础。
1 材料和方法
1.1 pMHP-CF的构建及其剪接活性的检测
HaV01 Pol全基因序列由日本东京大学Shmuel Pietrokovski教授馈赠[16]。通过PCR将其序列插入pMall载体内,然后利用Western Blot检测其原始剪接活性,原始质粒命名为pMHP[16]。HaV01 Pol含有238个氨基酸(包括N端外显子3个氨基酸、中间intein序列和C端外显子3个氨基酸,见图3),其中第一位氨基酸为Ser,内部含有4个半胱氨酸。设计4对搭桥PCR引物,将突变碱基设计到引物内部,通过PCR扩增,将突变引入到序列中(引物序列见表1)。最后通过酶切、连接等方法,将突变后的序列插入pMall载体内,通过测序得到正确的突变质粒,命名为pMHP-CF。接下来将构建好的质粒转入E.coliBL21内,诱导表达,通过Western Blot检测其剪接活性。
1.2 检测pMHP内部4个半胱氨酸对其剪接活性的影响
通过搭桥PCR的方法(引物见表1),构建4个Cys单独突变的克隆pMHP-C19/S、pMHP-C112/S、pMHP-C145/S和pMHP-C174/S。将测序正确的质粒转入E.coliBL21内,诱导表达,通过Western Blot检测它们的剪接活性。
1.3 pMHP-C112 only的构建及剪接活性的检测
同样利用搭桥PCR的方法,构建只有112位半胱氨酸存在的突变克隆pMHP-C112-only(引物见表1)。通过Western Blot对其剪接活性进行检测。
1.4 pMHP-C112 only中半胱氨酸的定点突变及剪接活性的检测
选择Gly和Thr进行定点突变(引物见表1)。将构建好的质粒pMHP-C112/T和pMHP-C112/G转入E.coliBL21内,诱导表达,通过Western Blot检测其剪接活性。
1.5 DTT浓度的改变和定点突变进一步验证pMHP的剪接类型
根据文献报道[17],在pMHP-CF上样缓冲液内添加不同浓度的DTT:0、1和2 mmol/L。通过定点突变(引物见表1)将HaV01 Pol一位的Ser突变成丙氨酸Ala。最后通过Western Blot检测其剪接活性。

表1 PCR引物列
2 结果与分析
2.1 pMHP-CF的构建及内含子剪接活性的检测
通过Western Blot 检测可以看到HaV01 Pol原始蛋白质内含子具有较高的剪接活性。在此基础上,将HaV01 Pol内部4个Cys定点突变成Ser,希望仍有较高的剪接活性,可是结果显示pMHP-CF没有任何的剪接活性。这个结果很令人吃惊,因为4个Cys都位于4个保守模块之外的非保守区域。同时我们也没有改变HaV01 Pol内部的氨基酸顺序。理论上这种改变即使会影响内含子的剪接活性,但不应该这么显著(如图1)。
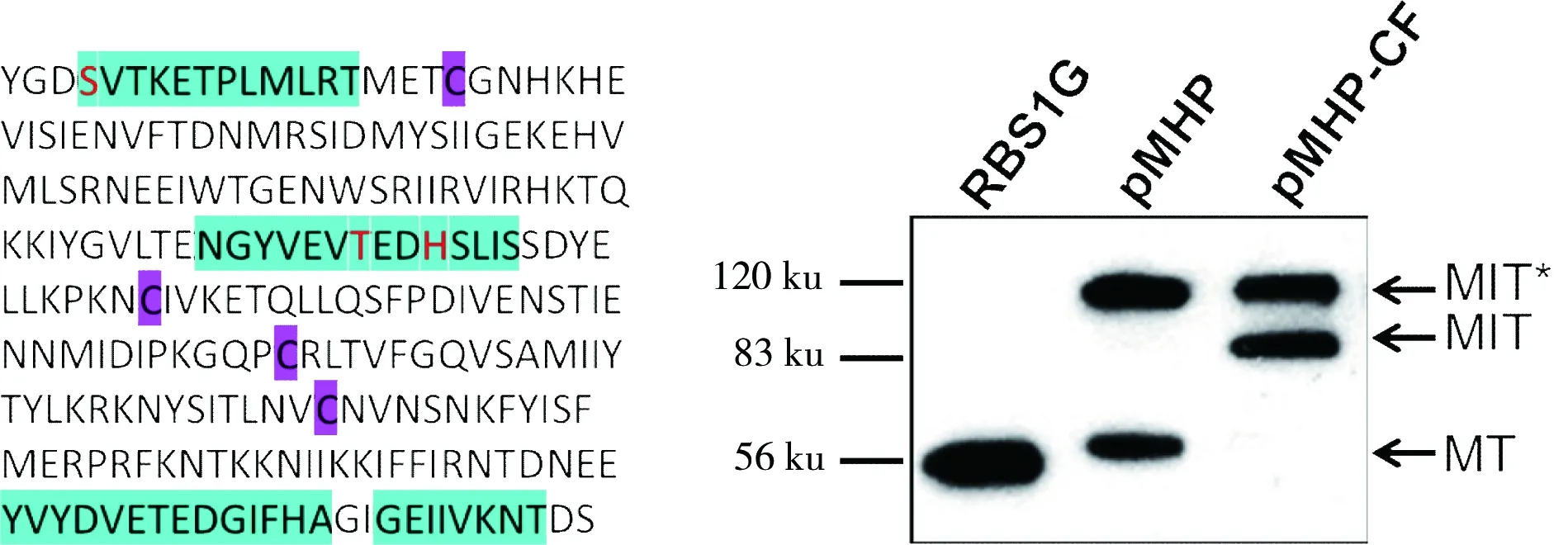
绿色:HaV01 Pol的4个保守模块A、B、F和G;紫色:内部半胱氨酸;红色:剪接必需的氨基酸。RBS1G:表达剪接的M+T蛋白(55.4 ku);MT:剪接条带;MIT:未剪接的前体;MIT*:未发生剪接的分支状中间体
图1 pMHP-CF剪接活性和Cys在HaV01 Pol中的位置
Fig 1 Splicing activity of pMHP-CF and localization of Cys inHaV01 Pol
2.2 检测pM-HP内部4个半胱氨酸对其剪接活性的影响
针对图1的结果,我们想要知道4个Cys是怎么调节HaV01 Pol的剪接活性的。因此,构建了每个Cys/Ser单突变的克隆。通过Western Blot结果(如图2)可以看出,pMHP、pMHP-C19/S、pMHP-C145/S和pMHP-C174/S均具有较高的剪接活性,但是pMHP-C112/S和pMHP-CF一样,几乎没有任何的剪接活性(某些X胶片可以看到隐约模糊的条带,但是经过扫描和后期处理,几乎看不到任何剪接条带的存在),都是以前体的形式存在,也没有任何形式的N端断裂或C端断裂[18-19]。这个结果显示112位的Cys对剪接的正常进行是非常重要的。但是该位点并不属于HaV01 Pol的几个重要模块(如图3),几个Cys均位于β折叠中间的Linker里面。通过序列比对可以看出,19位和174位Cys突变成Ser后不影响剪接活性是可以理解的,前者Ser和Thr是相似的氨基酸,后者有相似的氨基酸功能团,且都位于β片层中间不保守的位置。145位Cys前面为Pro,理论上更容易导致内含子活性的丧失或降低,而本文的突变却没有对剪接活性产生任何影响。而112Cys的位置和145Cys类似,只是更接近Linker的中间部分,另外比对结果并没有精确的给出112Cys在二级结构中的位置。因此我们猜想112Cys主要作用于蛋白质内含子完整三维结构的形成[15, 20]。
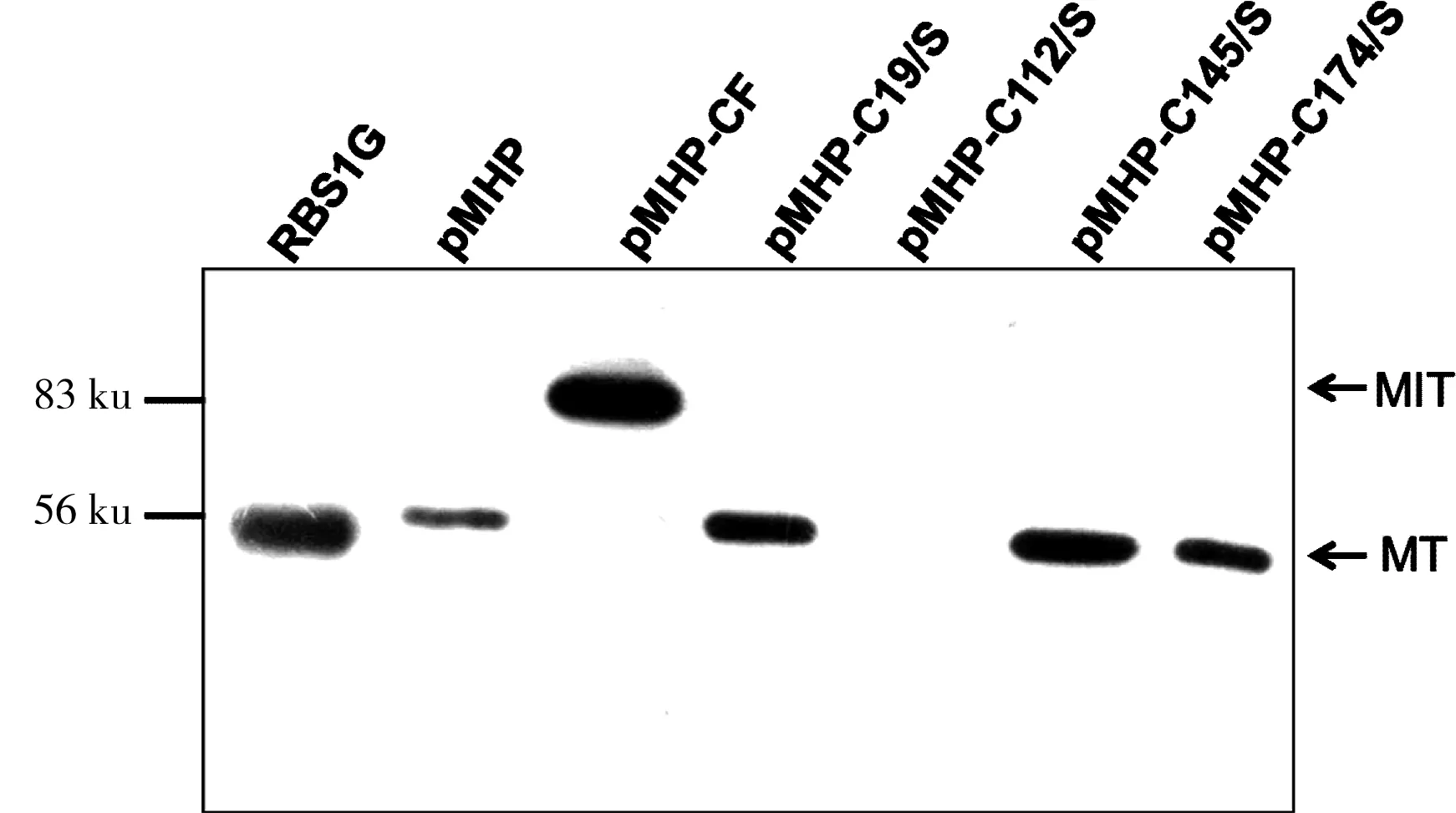
RBS1G:剪接的M+T蛋白(55.4 ku);MT:剪接条带;MIT:未剪接的前体
图2 4个半胱氨酸分别突变后的剪接活性
Fig 2 Splicing activity of 4 Cys/Ser mutations in pMHP, respectively

“-”:空缺,主要是为了优化比对结果;“*”:相同的氨基酸;“·”:相似的氨基酸;“:”:保守的氨基酸;大方框:N端和C端保留的外显子;小方框:4个Cys在序列中的位置;下划线:SspDnaB中的12个β折叠(β1~12)
图3HaV01 Pol和SspDnaB序列比对
Fig 3 Alignment of amino acid sequence ofHaV01 Pol andSspDnaB
2.3 pMHP-C112 only的构建及剪接活性的检测
既然112位的Cys可以决定内含子的剪接活性,那么当112位Cys单独存在时它的剪接情况会怎么样呢?于是将其余3个Cys突变成Ser,而112位的Cys不变。经过Western Blot发现,pMHP-C112only和pMHP一样几乎都有100%的剪接效率(如图4)。进一步说明只有Cys112,而不是Cys19/145/174对HaV01 Pol的剪接活性产生影响。
2.4 pMHP-C112 only中半胱氨酸的定点氨基酸突变及剪接活性的检测
既然丝氨酸不能挽救Cys112的功能,那么其他氨基酸是否可以呢?Cys侧链为巯基亲水性氨基酸,而Thr和Gly侧链都具有羟基也为亲水性氨基,所以首先选择这两种氨基酸进行定点突变。检测结果也显示pMHP-C112/G和pMHP-C112/T均有超过50%的剪接效率,而Thr突变后的效率比Gly突变要高一些(如图5)。
RBS1G:剪接的M+T蛋白(55.4 ku);MT:剪接条带
图4 pMHP-C112 only的构建及剪接活性的检测
Fig 4 Construction and splicing activity of pMHP-C112 only
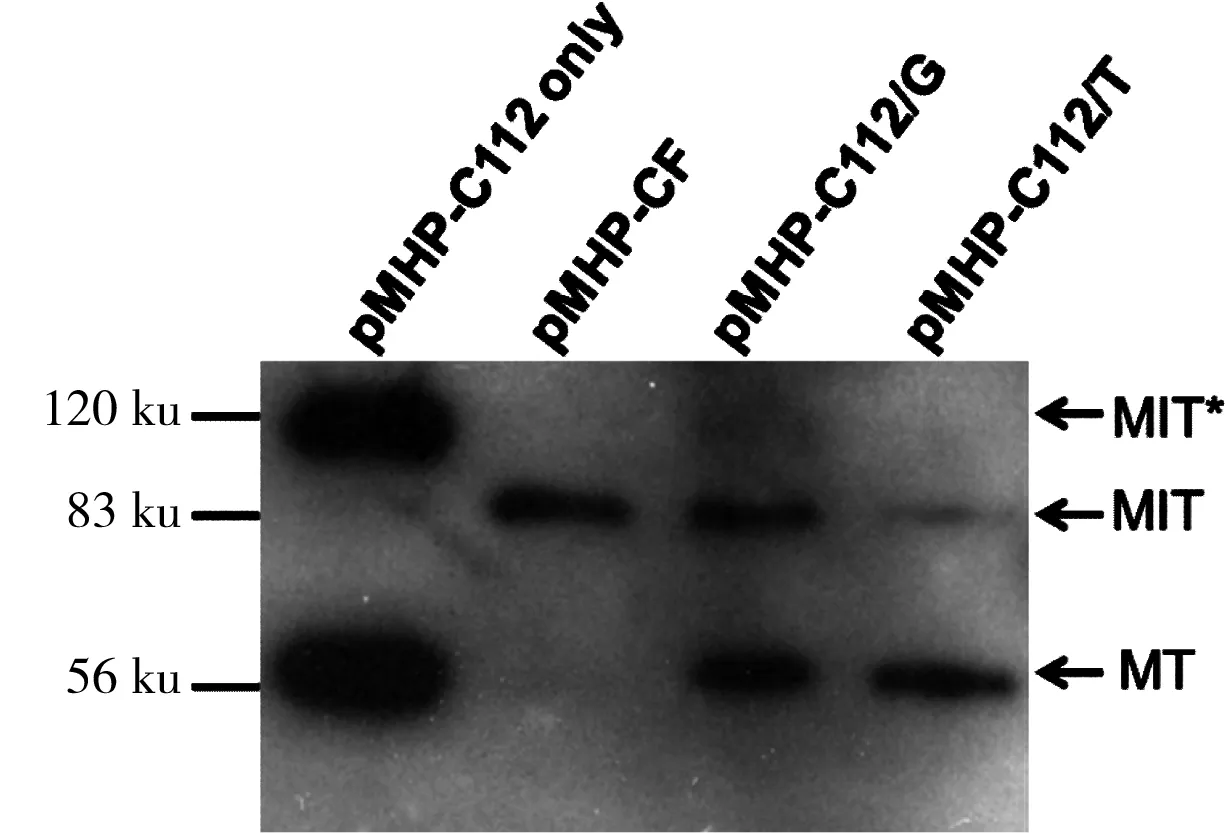
RBS1G:剪接的M+T蛋白(55.4 ku);MT:剪接条带;MIT:未剪接的前体;MIT*:未发生剪接的分支状中间体
图5 pMHP-C112/G和pMHP-C112/T的剪接活性
Fig 5 Splicing activity of pMHP-C112/G and pMHP-C112/T
2.5 DTT浓度改变和定点突变进一步验证HaV01 Pol的剪接类型
在后续的实验中发现无论是突变还是原始的内含子都会产生一个大于前体蛋白约120 ku的条带,根据内含子的剪接机制可以推测该条带是Block G分支中间物[17]。而一般这个产物是只有二型或三型蛋白质内含子才会产生的剪接条带。而剪接不充分有可能也会产生类似的条带。因此通过改变DTT浓度,看这个前体条带是否会下降,结果(如图6-A)显示前体虽有微弱的下降,但是依然存在。同时,将intein 1位的Ser突变成Ala并检测其剪接活性,Western Blot结果显示突变后的pMHP失去了剪接活性(如图6-B),表明HaV01 Pol是一型蛋白质内含子,而不是三型蛋白质内含子,因为二型和三型蛋白质内含子不需要1位的氨基酸。另外,HaV01 Pol也没有三型内含子的典型的WCT结构,氨基酸比对进一步证实了这一点(如图6-C)。

RBS1G:剪接的M+T蛋白(55.4 ku);MT:剪接条带;MIT:未剪接的前体;MIT*:未发生剪接的分支状中间体;“+”:正常的DTT浓度1 mmol/L;“++”:增加DTT浓度至2 mmol/L;“-”:没有添加DTT;cleavage:非正常的断裂产物;红色:表示三型内含子WCT模块和一型内含子Block B中的T和H两个保守氨基酸
图6 Western Blot和比对结果证明pMHP为一型蛋白质内含子
Fig 6 pMHP is type I intein by Western Blot and alignment
3 讨论
蛋白质内含子可以发生自我剪切,将两端的外显子序列以肽键的形式稳定的连接起来。这一性质使蛋白质内含子作为一个非常价值的生物学工具,被广泛地应用于蛋白质纯化、蛋白连接、蛋白环化、蛋白标记、抗体的修饰、结构解析等[21-22]。但是因为蛋白质内含子本身结构的保守性,使其在异源宿主中的表达和剪接活性受到限制。截至目前,可利用的蛋白质内含子仍然非常少。因此,对现有蛋白质内含子进行改造和修饰是扩大其应用范围的必然途径[23-24]。
将HaV01 Pol内部的4个半胱氨酸突变成相似的Ser。令人意外的是,HaV01 Pol内部112位的Cys可以决定其剪接活性,而其他3个Cys则不会影响其剪接活性。根据之前的报道,蛋白质剪接时主要形成一个马蹄形的结构,C端形成一个口袋结构,而N端进入口袋,随即发生一系列亲和反应[25]。我们推测112位Cys的突变可能间接改变了周围氨基酸的空间位阻,影响了正确空间构象的形成,最终导致HaV01 Pol的剪接效率降低[26]。Gly和Thr替换112位的Cys后,发现剪接效率都很高,尤其后者。Ser和Thr都是极性不带电荷氨基酸,且功能团相近,可是对HaV01 Pol剪接效率的贡献却完全不同。而Gly为极性氨基酸且侧链只有一个氢原子,产生的空间位阻较小,可能促进了周围其他氨基酸的重新排列组合,形成有活性的空间结构[27]。但是这些推测和具体的作用机制都还有待进一步验证。
本文研究发现蛋白质内含子HaV01 Pol内部非保守区的112位Cys可以决定其剪接效率,而其他3个则不会。在蛋白质内含子研究中,第一次发现这种现象[28]。通过定点突变进一步得到了2个没有半胱氨酸的,具有高剪接活性的HaV01 Pol突变。后续主要是通过内含子晶体结构的解析,进一步研究112Cys调节HaV01 Pol剪接活性的详细分子机制[25]。通过序列比对和计算机建模,获得对应的断裂蛋白质内含子[29]。另外,HaV01 Pol是少数真核来源的且有较高剪接活性的蛋白质内含子,在真核生物的应用中可能会优于其他原核来源的蛋白质内含子。本文的研究为进一步探索和扩大蛋白质内含子HaV01 Pol在分子生物学和化学生物学等方面的应用提供了可能。
