pH对脱脂牦牛乳中酪蛋白胶束的影响
2018-10-13张光地何兴芬杨敏马蓉杨富民王海霞
张光地,何兴芬,杨敏,马蓉,杨富民,王海霞
(1.甘肃农业大学食品科学与工程学院,甘肃兰州 730070)(2.甘肃农业大学理学院,甘肃兰州 730070)(3.甘肃省功能乳品实验室,甘肃兰州 730070)
牦牛乳在中国(尤其是在西北地区)是一种高蛋白和高矿物质含量的独特乳资源,尤其富含αs2-酪蛋白(casein,CN)、β-酪蛋白以及Ca和P[1,2]。但是牦牛乳大多被初加工成干酪素、奶酪和奶粉等传统乳产品。为了开发更多附加值高的牦牛乳相关制品,带动西北局部地区经济发展,牦牛乳酪蛋白胶束一直是众多乳品工作者的研究热点。
pH是酪蛋白胶束微观结构合理化行为最为显著的影响因素之一[3]。pH对于牛乳的影响也有大量的报道,研究表明,酪蛋白的微观结构随酸化过程的进行由松散变得致密[3,4];pH<5.4时,酪蛋白产生了复杂的聚集行为,并在pH 4.8时形成了絮凝物,胶束粒径与pH呈负相关性[5,6,7]。但是要开发大量新产品,这些研究还是远远不够的。
牦牛乳中富含Ca和P,并且以胶体磷酸钙的形式存在,胶束中的酪蛋白单体通过胶体磷酸钙的连接形成稳定的酪蛋白胶束的结构[8]。在pH变化的整个过程中,可以从矿物质在乳清和胶束相中含量的变化分析胶束的变化及矿物质的分布情况。普通牛乳在酸化过程中,胶束中Ca、Mg、P的含量下降;而Na、K的含量先下降,然后在pH 5.5或5.8急剧增加[4,9,10]。但是在不同pH水平上,目前还没有关于牦牛乳酪蛋白胶体磷酸钙的微观结构和其他矿物质解离情况的报道。同时,也有关于普通牛乳酪蛋白分子含量随 pH变化的报道[9,11],但是由于牦牛乳与普通牛乳成分和特性的差异[12~14],这些研究结果并不能应用于牦牛乳酪蛋白产品的精细加工。
通过对牦牛乳酪蛋白pH的调节,使酪蛋白胶束出现聚集或解离等变化,对胶束粒径和荧光光谱测定,确定酪蛋白胶束随pH变化时疏水微环境的变化以及酪蛋白胶束粒径的变化;对主要离子含量的测定,确定酪蛋白胶束发生解离时化学组成的变化情况;结合单体含量的变化分析pH对牦牛乳酪蛋白胶束的影响,为酪蛋白胶束的结构分析提供基础数据,为牦牛乳相关制品的精细加工提供参考。
1 材料与方法
1.1 材料与试剂
原料:新鲜牦牛(Bos grunniens)常乳采自甘肃天祝牧区。
药品与试剂:盐酸、氢氧化钠均为分析纯,标准品κ-CN(purity≥70%)、αs-CN(purity≥70%)、β-CN(purity≥98%),去离子水、大豆油等。
1.2 仪器与设备
PHS-3C pH计,上海三信仪表厂;DFⅡ集热式磁力加热搅拌器,金坛市顺华仪器有限公司;F-380荧光分光光度计,天津港东科技发展股份有限公司;ZetaSizer Nano-ZS ZEN3600激光粒度仪,英国马尔文公司;Optima L-100XP超速离心机,美国贝克曼公司;3K15台式高速冷冻离心机,德国 sigma公司;Agilent1100型高效液相色谱仪,美国;GGX-800原子吸收光谱仪,北京海光仪器有限公司;电感耦合等离子发射光谱 Perkin Elmer’Optima 7000DV,美国;FD-1-50真空冷冻干燥机,北京博医康实验仪器有限公司。
1.3 方法
1.3.1 样品采集及处理
牦牛乳样品采集后加入叠氮化钠(0.02%m/m),并在低温下6 h内送到实验室-20 ℃保存。实验前牛乳在4 ℃ 4000 r/min离心20 min进行脱脂,并用玻璃纤维过滤3次,备用。
pH处理:冷藏样品从冰箱中取出放置室温平衡2 h。用0.01~0.1 mol/L盐酸和氢氧化钠调节样品pH为4.6~8.2,以0.4为间隔。调节后的样品平衡2 h至pH保持不变,备用。
超速离心处理:取部分pH处理后的牦牛乳样品在20 ℃离心力100000 r/min条件下离心1 h,获得酪蛋白胶束变化程度不同的上清液,备用。
1.3.2 单体含量的测定
取4 mL超速离心上清液样品分散到4 mL缓冲液中(含8 mol/L尿素,165 mmol/L Tris,44 mmol/L柠檬酸钠和0.3% (V/V)二巯基乙醇),相同的方法配制10 mg/mL酪蛋白单体标品溶液。
液相色谱分析:用0.45 μm膜过滤,取50 μL进样。采用C18(150 mm×4.6 mm,300-Å pores,5 μm)色谱柱。流动相 A 液为乙腈:水:三氟乙酸(100:900:1)(体积比,下同);B液为乙腈:水:三氟乙酸(900:100:1)。进行线性洗脱。洗脱梯度为B液从20%开始,20%~31.3%洗脱13 min;31.3%~31.3%洗脱 3 min;31.3%~34.7%洗脱 3 min;34.7%~34.7%洗脱 3 min;34.7%~36%洗脱2 min;36%~36%洗脱5 min;36%~38.2%洗脱 2 min;38.2%~38.2%洗脱 5 min;38.2%~40.8%洗脱2 min;40.8%~46%洗脱6 min,总洗脱时间为45 min,柱温为25 ℃,洗脱液流速为1.0 mL/min,紫外检测器波长为220 nm[2,15~17]。
1.3.3 矿物质含量的测定
1.3.3.1 Ca、Mg、K、Na含量测定
准确移取2 mL超速离心上清液,置于消化管底部,加入适量催化剂和一定量的浓H2SO4,消化至溶液澄清。采用原子吸收光谱法测定消化液中Ca、Mg、K、Na离子含量[18]。
1.3.3.2 P含量的测定
移取3 mL超速离心上清液置于50 mL容量瓶中,加入甲醇定容至刻度,摇匀,采用0.22 μm尼龙滤膜过滤,待测。标准液制备方法同上。采用离子色谱仪测定,色谱条件:淋洗液为20 mmol/L KOH,等梯度淋洗;流速为1.0 mL/min;ASRS300循环再生电抑制模式;进样体积 25 μL;AXP辅助泵流速:0.55 mL/min[12,19]。
1.3.4 内源荧光测定
移取1 mL样品,加9 mL蒸馏水稀释,进行内源荧光光谱扫描。扫描波段设置为290~450 nm,起始波长设置为280 nm,狭缝设置为5.0 nm。
1.3.5 外源荧光测定
移取1 mL样品,加9 mL蒸馏水稀释。取8 mL稀释液加入200 μL 荧光试剂ANS(8.0×10-3mol/L),静置 3 min,进行外源荧光光谱扫描。扫描波段设置为400~650 nm,起始波长设置为390 nm,狭缝设置为5.0 nm。
1.3.6 粒径测定
移取1 mL样品,加5 mL水稀释,在5 min之内用莫尔文激光粒度仪测定,测定波长设置为632.8 nm。
1.3.7 形貌观察
将不同pH处理的牦牛乳样品稀释后滴到硅片上,再将硅片放入冷冻干燥机干燥24 h,以固定样品,然后再喷上金。用扫描电子显微镜(Scanning electron microscope,SEM)放大20000倍观察酪蛋白结构图像,并照相,操作电压为5 kV。
1.3.8 数据统计分析
全部试验数据采用Microsoft Excel 2010进行处理,采用 origin 8.0作图,并进行曲线数据拟合,用SPSS 18.0进行数据统计分析,确定结果之间是否存在显著差异,用Duncan’s法进行标准偏差(±SE)计算。
2 结果与分析
2.1 pH对酪蛋白胶束中单体含量的影响

图1 上清液中酪蛋白单体的解离含量Fig.1 The content of the dissociation of casein monomers in serum phase
图1以上清液中牦牛乳酪蛋白单体的百分含量表示pH对酪蛋白胶束的影响。随着酸化程度的增加,αs-酪蛋白、β-酪蛋白和κ-酪蛋白在上清液中的百分含量在pH 8.2~5.0随之降低,当pH继续降低到4.6时,含量又出现增加,所以在pH 5.0时出现κ-酪蛋白百分含量的最低值,含量分别为 2.30%、5.20%和 1.70%在pH 8.2~5.0上清液中β-酪蛋白的含量均高于κ-酪蛋白和αs-酪蛋白的,最高可达30.20%,此时,κ-酪蛋白和αs-酪蛋白含量分别为18.10%和22.40%。在pH 5.8~6.6时αs-酪蛋白在上清液中的含量低于κ-酪蛋白的含量。牦牛乳在pH 7.0时最为接近其自然pH,此时三种单体在上清液中的含量分别为:κ-酪蛋白,12.20%;αs-酪蛋白,13.70%;β-酪蛋白,13.80%。充分证明自然pH下酪蛋白单体并非都已胶束的形式存在,部分单体是游离存在的。
有研究表明,κ-酪蛋白位于酪蛋白胶束的表面[8]。在酸化过程中,pH 8.2~5.0时,κ-酪蛋白和β-酪蛋白含量的明显下降意味着它们随pH降低有聚合现象,αs-酪蛋白的含量并未随pH降低一致下降,这主要是由于其较高的磷酸化水平和低于其他酪蛋白分子的等电点[6]。在pH继续降低到4.6时,酪蛋白单体的含量都出现增加,说明酪蛋白胶束结构遭到破坏胶束发生解离。在pH值从6.6增加到8.2的过程中,酪蛋白单体的含量显著增加(p<0.05)。
但是在 pH 7.0时三种酪蛋白单体的含量基本相同,可能是由于酪蛋白胶束在pH 7.0附近形成稳定结构,pH>7.0时,酪蛋白胶束结构变得松散,在超速离心作用下,单体在乳清相中的含量增加;pH<7.0时,酪蛋白胶束发生团聚,单体含量降低,其合理性还需要进一步研究印证。据有关报道,在 pH 6.6~7.4,κ-酪蛋白在牦牛脱脂乳上层清液中的含量有所增加[20],也有人指出这个pH范围在6.4~7.6[21]。这可能是由于不同地区牦牛品种之间的差异引起的,但具体含量的差异还未见报道。其他乳品中可溶性蛋白含量已被广泛报道,本研究中牦牛脱脂乳的酪蛋白组分研究可与之前报道的进行比较[4,22,23],为其产品的开发提供基础数据。
2.2 pH对酪蛋白胶束中主要矿物质含量的影响
酪蛋白胶束中最主要的矿物质是钙(Ca)和磷(P),除此之外还有部分Mg、Na、K等,牦牛乳也是如此。在胶束相中三分之二的钙和三分之一的磷以胶体磷酸钙(CCP)或胶束磷酸钙(MCP)的形式存在[8],亚胶束通过胶束磷酸钙桥连接形成酪蛋白胶束[24]。也就是说,胶体状磷和钙的解离能够导致酪蛋白胶束的破坏。图2表示上清液中离子含量随pH的变化情况。由图可以看出在整个酸化过程中,随着 pH的降低,Ca和P的含量先降低后升高,在pH<6.4或pH>7.0时Ca、P的含量显著增大(p<0.05),在pH 7.0时含量最低,分别为471.06 mg/L和546.80 mg/L。Mg的含量基本保持在110 mg/L左右,Na的含量随pH的增加持续增大,K的含量在pH>7时,其含量随酸化程度降低,在pH<7时,其含量出现增加随后基本保持不变,但在pH 5.4时出现突变点。
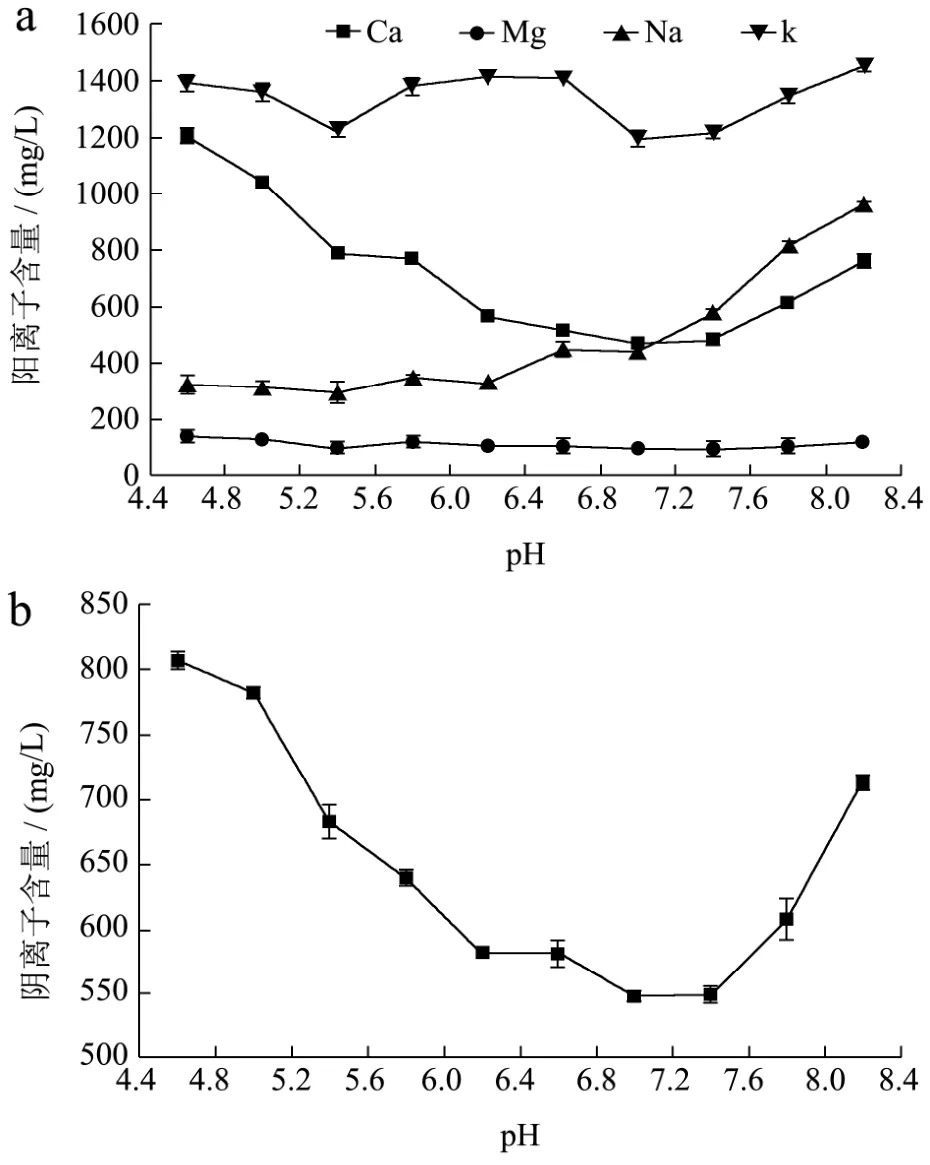
图 2 上清液中Ca、Mg、K、Na、(a),P(b)的解离含量Fig.2 The content of the dissociation of Ca, Mg, K, Na (a) and P(b) in serum phase

图3 上清液中P与Ca含量的关系Fig.3 The relationship between P and Ca content in serum phase
图3表示上清液中P与Ca含量的关系。在酪蛋白胶束中,3 M的钙和2 M的磷以胶体磷酸钙(CCP)或胶束磷酸钙(MCP)的形式存在于酪蛋白胶束中。也就是说,在胶体状磷酸钙发生解离时,解离出的 P和Ca含量应该也满足3:2的比例。但是,由上图可知,解离出的Ca含量对于P含量表现出线性关系,但并非3:2的线性关系,这可能是由于静电相互作用和酪蛋白的吸附作用所致。
大量研究表明,在pH 6.0~4.6之间酸化脱脂乳乳清相中可溶性Ca和P的含量急剧增加[4,25~27],但是在牦牛脱脂乳中pH范围有所增大。pH<7.0时,在牛乳的酸化过程中,胶束中的磷酸盐质子化,胶体磷酸钙发生溶解,导致乳清相中Ca和P的含量急剧增加;pH>7.0时乳清相中Ca和P的含量也出现增加,表明酪蛋白胶束发生解离,这一规律恰好与单体含量的规律相印证,所以在pH 7.0附近牦牛乳酪蛋白形成稳定的胶束结构。此时胶束对K的作用力最强,乳清相中K的含量也最低,在质子化和胶束解离的过程中对K的作用力都会减弱,所以K的含量会有所增加,但这种变化都比较微弱。Na含量变化主要是由于碱化过程中加入的NaOH引起的,Na的加入会影响酪蛋白胶束之间的静电相互作用[28,29]。而Mg的含量随pH基本保持不变,说明在整个酸化过程中Mg不参与酪蛋白胶束结构的形成与变化。
2.3 pH对酪蛋白胶束内源荧光光谱的影响
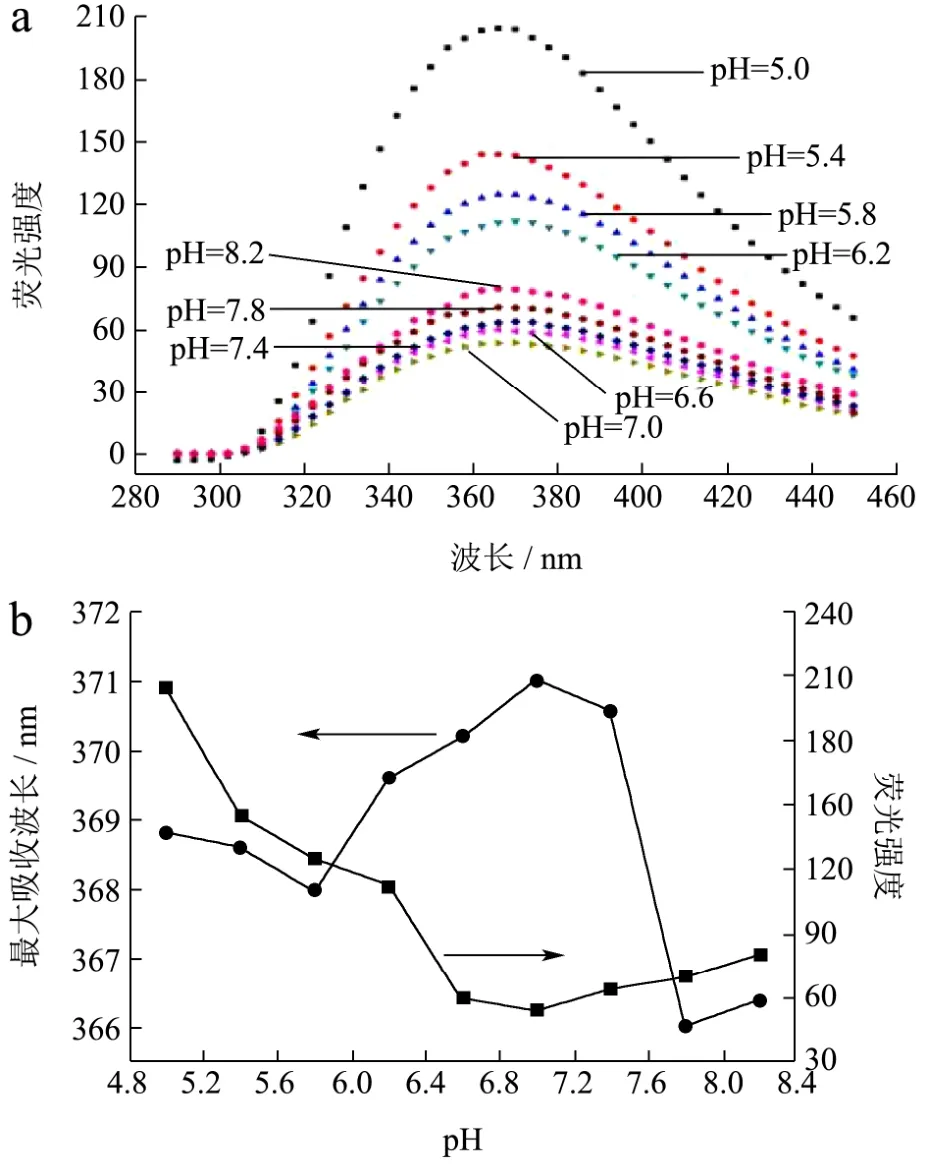
图4 牦牛脱脂乳内源荧光光谱图(a)和内源荧光强度及最大波长(b)Fig.4 Steady-state fluorescence (a), fluorescence intensity and maximum wavelength (b) of Yak skim milk
脱脂乳的内源荧光主要来自酪蛋白胶束中的色氨酸、酪氨酸和苯丙氨酸残基,αs1-酪蛋白的色氨酸残基位于第164和199位,β-酪蛋白的色氨酸残基位于第143位,这三个氨基酸皆存在于酪蛋白分子的疏水部分,负责酪蛋白分子的自组装行为,对微环境的改变十分敏感[30,31]。
根据牦牛乳内源荧光光谱的变化(图4a)以及最大荧光强度(If)和最大吸收波长(λmax)的变化(图4b),最大荧光强度(If)随pH增加先降低,之后略有增加,在pH 7.0时最大荧光强度值最小,为54.30,在pH<7.0时的If最大值远大于pH>7.0的。最大吸收波长(λmax)在pH>7.0时随pH增加发生5 nm的蓝移,在pH<5.8时也随pH增加出现蓝移,pH<7.0时随pH增加发生3 nm的红移,pH>7.8也发生红移现象。
随着酸化程度的增加,氨基酸的质子化程度的增加使胶束中的氢键不断增强。此外,酪蛋白芳香族基团侧链与阳离子之间发生了阳离子-π电子相互作用[3]。因此,在pH<7.0时,酪蛋白胶束的结构变得越紧凑,导致色氨酸残基等被埋藏在疏水区域中,If出现增大;在 pH>7.0时,酪蛋白胶束发生解离,在解离过程中酪蛋白胶束发生自组装行为,部分色氨酸残基等也被埋藏在疏水区域中,所以If随pH升高略有增大。在整个pH变化过程中,由于胶体磷酸钙的溶解,羧基的去质子化,静电排斥的增大,盐桥断裂等一系列变化[3,32],导致酪蛋白结构由低pH时的酪蛋白胶束的聚集状态随pH升高到酪蛋白胶束的形成再转变为酪蛋白胶束结构变得松散直至溶解,导致此过程中λmax随之发生蓝移或红移。
2.4 外源荧光光谱分析

图5 牦牛脱脂乳ANS荧光光谱(a)和荧光强度及最大波长(b)Fig.5 The ANS emission spectra (a), ANS fluorescence intensity and maximum wavelength (b) of Yak skim milk
牦牛脱脂乳ANS荧光光谱(图5a)变化规律与内源荧光光谱变化规律相似,荧光强度(If)(图5b)随pH也呈现先降低后升高的趋势,同样在pH 7.0时出现最小值,为 759.60。但最大吸收波长(λmax)的变化趋势与内源荧光刚好相反,在pH>7.0时随pH增加发生红移,在pH 7.8以后又发生蓝移;在pH<7.0时随pH增加发生3 nm蓝移,但在pH<5.8时又随pH增加出现4 nm红移。
ANS阴离子很容易与赖氨酸、精氨酸和组氨酸侧链的阳离子基团结合。在酸化过程中,负电荷减少,ANS与酪蛋白的结合增加,所以荧光强度(If)随之增加;pH>7.0时,pH的增加属于碱化过程,此过程中,酪蛋白胶束结构变得松散甚至出现解离,导致ANS和酪蛋白之间的空间位阻效应减弱,If同样随碱化程度增大。磷酸盐的状态变化和钠的加入使酪蛋白胶束结构发生多种变化,从而使λmax随pH发生蓝移或红移现象。
2.5 pH对酪蛋白胶束粒径的影响
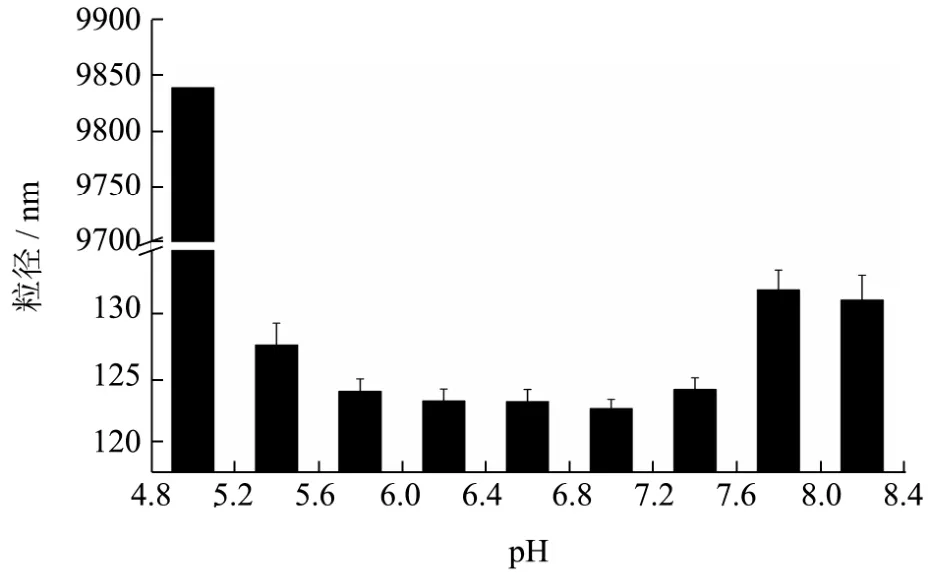
图6 牦牛脱脂乳的粒径变化Fig.6 Z-average particle size of yak skim milk
如图6,在pH 5.0时,胶束的粒径表现出最大值0.98 μm,远远大于其他pH时的胶束粒径,差异显著(p<0.05)。胶束粒径在 pH<5.4时急剧增加表明 pH接近等电点,酪蛋白胶束大量聚集,这一变化在其他种类的牛乳中已被发现[4]。在pH 5.4~7.8范围内胶束的粒径随pH增大由142.60 nm减小到122.55 nm后又增大到131.90 nm,在pH 7.0时出现最小值,在pH>7.8时又出现减小,但总体变化不大,最大相差10 nm左右。据有关报道,牦牛酪蛋白胶束的大小在自然 pH值时的范围为193~212 nm[12,21],而本次测得的粒径为122 nm,这可能与样品的产地、采集时间和测定方法有关。
pH在5.8~7.0时,胶束粒径随pH降低略有增加,在此过程中随着酸化程度的增加,胶体磷酸钙发生溶解但酪蛋白单体并未发生明显聚集,所以胶束粒径基本保持不变。pH<5.8时,酪蛋白发生聚集,胶束粒径明显增加。pH>7.0时,酪蛋白结构变得松散,粒径也明显增加,但在 pH>7.8时,酪蛋白胶束发生解离,其粒径会减小。pH 7.0时,接近自然pH值,所以酪蛋白以稳定的胶束结构存在,粒径也最小。
通常来说,酪蛋白胶束在酸化或者碱化过程中物理、化学和生化等性质的变化是相互依赖的。酪蛋白胶束粒径是由静电作用、胶束的疏水性以及酪蛋白分子和水分子之间的相互作用影响的复杂胶体性质,胶束粒径的变化是由这些因素共同作用的结果,在酸化过程中这些因素作用的强弱会发生变化,导致粒径发生相应的变化[4]。
2.6 pH对酪蛋白胶束表面形貌的影响

图7 牦牛酪蛋白胶束的形貌变化Fig.7 The morphology change of casein micelles in Yak skim milk (SEM, ×20,000)
通过扫描电镜观察牦牛酪蛋白胶束在不同pH值下的形貌变化(图7),结果表明,随着pH从5.8增加到7.0,胶束表面结构变化不大,在此变化过程中,酪蛋白胶束的完整结构基本保持不变(图7C、D、E、F)。在pH值为5.4时胶束之间有聚集行为出现(图7B),在pH值为5.0时形成了网络微团簇(图7A),表明在酪蛋白胶束发生沉淀之前彼此靠近并发生聚集。
在碱化过程中,酪蛋白胶束基本保持了其原有的形态(图7F、G、H、I)。但在pH>7.0并增加的过程中小粒径的胶束和较大粒径的胶束的比例有所增加,在pH 7.8时小粒径胶束之间有聚集行为,pH 8.2时小粒径的胶束比例增加,聚集行为消失,所以此过程中粒径有所增加,但在pH 8.2时又出现降低,该研究结果与上述粒径研究结果相一致。
3 结论
3.1 主要矿物质中Ca、K、P与酪蛋白胶束的形成相关,尤其是Ca和P组成的胶体磷酸钙是酪蛋白胶束的主要连接物质,但Mg不参与酪蛋白胶束结构的形成,Na含量的变化主要由碱化操作加入的NaOH引起。由单体含量和主要矿物质含量的分析可知,在pH 7.0附近,乳清相中三种单体含量基本相等,并且Ca和P的含量最低,说明此时酪蛋白胶束处于一个比较稳定的结构状态,也最为接近酪蛋白胶束的天然状态,荧光光谱和粒径的变化也充分说明这一点。并且,酪蛋白胶束在天然状态下,12.20%的κ-酪蛋白,13.70%,αs-酪蛋白和13.80%的β-酪蛋白是游离存在的。
3.2 根据单体含量、Ca和P的含量以及粒径和荧光光谱的分析,酸化过程中酪蛋白胶束结构的变化可分为以下几个阶段。pH在7.0~8.2时,酪蛋白胶束会随着pH增大变得松散直至发生解离,具体表现为乳清相中单体含量和Ca、P含量的显著增加以及K含量的升高,以及粒径先升高后降低的变化和荧光光谱相应的变化。pH为5.8~7.0时,随着酸化程度的增加,胶体磷酸钙发生溶解,酪蛋白单体开始发生聚集,乳清相中Ca、P含量随pH降低出现增加,酪蛋白单体含量出现降低。pH值为4.6~5.8时,在此过程中,随着酸化程度的增加酪蛋白单体发生明显聚集直至出现沉淀,胶体磷酸钙继续溶解,表现为乳清相中Ca、P含量持续增加,酪蛋白的粒径也发生明显增加。pH≤4.6时,沉淀会发生溶解,酪蛋白单体的含量出现升高。
