紫檀芪对Ⅱ型糖尿病大鼠血脂的改善及对PPARγ的调控作用
2018-10-13刘欣欣孙华磊葛惠娜王腾李文杰
刘欣欣,孙华磊,葛惠娜,王腾,李文杰
(郑州大学公共卫生学院营养与食品卫生教研室,河南郑州 450001)
Ⅱ型糖尿病(type Ⅱ diabetes mellitus,T2DM)是由胰岛素分泌障碍或胰岛素抵抗导致的糖代谢紊乱的疾病,常伴有脂代谢异常,主要表现为甘油三酯(triglyceride,TG)和低密度脂蛋白胆固醇(low density lipoprotein-cholestelipoprotein-cholesterol,LDL-C)的升高,是糖尿病易发心血管疾病的主要原因[1,2]。目前,Ⅱ型糖尿病的治疗方法有口服降血糖药物和注射胰岛素,但这些治疗方式对机体会产生一些副作用,如高剂量胰岛素或降糖药可能引起低血糖、腹泻和肝脏损伤等。因此,寻找天然、毒副作用较小的抗Ⅱ型糖尿病防治方法,逐渐成为医药研究领域的重要课题。
紫檀芪(Pterostilbene,PTE)是紫檀中所含的一种化学成分,是一种天然多酚化合物,主要存在于蓝莓、葡萄和越橘果中。来源于天然植物的紫檀芪低毒或几乎无毒,在糖尿病治疗中具有良好的应用前景[3]。近年来的研究表明,紫檀芪能显著抑制多种肿瘤细胞的增殖、侵袭和转移,且具有抗氧化、降血脂和降血糖等作用[4~7]。Rimando等[8]人发现:与对照组相比,高胆固醇仓鼠口服紫檀芪可以使血糖水平降低14%,血浆低密度脂蛋白降低29%,高密度脂蛋白增加7%。此外,在脂肪细胞中,紫檀芪可以降低细胞增殖、脂质积聚和三酰基甘油的蓄积[9]。然而,紫檀芪改善Ⅱ型糖尿病脂代谢紊乱的机制尚未完全清楚,有待进一步研究。
本研究旨在通过高脂高糖饲料喂养联合小剂量链霉菌素(streptozotocin,STZ)注射构建Ⅱ型糖尿病大鼠,采用紫檀芪干预,观察紫檀芪对Ⅱ型糖尿病大鼠血脂的影响,检测紫檀芪对大鼠血清氧化应激水平的作用以及对大鼠脂肪组织中PPARγmRNA和蛋白的影响,初步探讨紫檀芪对脂代谢紊乱作用发生的可能机制。
1 材料与方法
1.1 试剂与仪器
链脲佐菌素,美国Sigma公司;紫檀芪,上海士丰生物有限公司;甘油三酯测定试剂盒,中生北控生物科技有限公司;总胆固醇测定试剂盒,中生北控生物科技有限公司;高密度脂蛋白胆固醇测定试剂盒,中生北控生物科技有限公司;低密度脂蛋白胆固醇测定试剂盒,中生北控生物科技有限公司;脂肪组织蛋白提取试剂盒,上海贝博生物科技有限公司;超氧化物歧化酶(SOD)测定试剂盒,南京建成生物工程研究所;丙二醛(MDA)测定试剂盒,南京建成生物工程研究所;PPARγ多克隆抗体,武汉三鹰生物技术有限公司;卓越360全自动生化分析仪,上海科华生物工程股份有限公司。
1.2 实验动物及饲料
选取SPF级健康雄性Sprague-Dawley(SD)大鼠100只,由河南省实验动物中心提供,饲养于郑州大学公共卫生学院动物实验中心。室温为18~23 ℃,相对湿度为 45~55%,通风良好,动物分笼饲养,自由饮水摄食,昼夜间隔12 h。
普通饲料由河南省实验动物中心提供,高脂高糖饲料:59.5%普通粉状饲料、20%蔗糖、10%猪油、10%蛋黄粉、0.5%胆酸钠。
1.3 实验方法
1.3.1 2型糖尿病大鼠模型的建立[10,11]及实验分组
100只4周龄雄性SD大鼠,体重170~220 g,适应性喂养1周后,随机选取10只作为正常对照组,给予普通饲料喂养,其余大鼠给予高脂高糖饲料。4周后夜间禁食12 h,按40 mg/kg剂量一次性空腹注射链脲佐菌素STZ溶液,制备Ⅱ型糖尿病大鼠模型。正常对照组大鼠腹腔注射相等体积的柠檬酸钠缓冲液。注射STZ后,尾静脉采血检测大鼠空腹血糖,若空腹血糖≥11.1 mmol/L,并且出现多饮、多食、多尿症状,一周后大鼠血糖稳定未恢复正常即为造模成功。按上述成膜标准筛选出75只大鼠,造模成功率为83.3%。随机选取造模成功的大鼠分为Ⅱ型糖尿病模型组、紫檀芪低剂量干预组(20 mg/kg)、紫檀芪中剂量干预组(40 mg/kg)、紫檀芪高剂量干预组(80 mg/kg),各10只,于每日固定时间按照体重计算灌胃剂量进行灌胃一次。正常对照组和Ⅱ型糖尿病组于每日固定时间给予羧甲基纤维素钠溶液灌胃一次。连续干预7周后,称体重,并记录大鼠尿量、摄食量和饮水量;然后水合氯醛麻醉,腹主动脉采血,测定血脂各项指标及血清中氧化应激水平的变化;分离脂肪组织,检测脂肪组织中PPARγ蛋白的表达量。
1.3.2 血脂的测定
采用全自动生化分析仪检测甘油三酯(triglyceride,TG)、总胆固醇(total cholesterol,TC)、低密度脂蛋白胆固醇(low density lipoproteincholestelipoprotein-cholesterol,LDL-C)、高密度脂蛋白胆固醇(high density lipoprotein-cholesterol,HDL-C),检测方法参照试剂盒说明,TG、TC测定采用一点终点法,LDL-C测定采用两点重点法,HDL-C测定采用过氧化氢酶清除法。
1.3.3 血清中氧化应激水平的检测
取出待测血清,采用WST-1法检测SOD活性,硫代巴比妥酸染色(TBA)法检测MDA含量,操作步骤参照试剂盒说明。
1.3.4 荧光定量 PCR检测大鼠脂肪组织PPARγmRNA的水平
提取脂肪组织的总 RNA,逆转录 mRNA为cDNA。根据Genebank中的PPARγ基因和内参基因β-actin的基因组DNA序列,应用Premier Premier5.0软件设计引物,PPARγ基因引物系列:上游GAAGAGGCCACATGAAGAGC,下游CCTTGCATCCTTCACAAGCA;β-actin基因引物序列:上游 GTGGGGCGCCCCAGGCACCA,下游CTTCCTTAATGTCACGCACGATTTC。使用荧光定量PCR进行反应,PCR扩增条件为:预变性95 ℃,5 min,95 ℃,15 s;60 ℃,30 s;72 ℃,40 s,扩增 40 个循环。以β-actin为内参基因,采用相对定量计算方法对目的基因PPARγmRNA进行荧光定量。
1.3.5 western blot测定大鼠脂肪组织中PPARγ蛋白的表达
取各组大鼠脂肪组织采用BAC法测定蛋白浓度,以β-actin作为内参,并按照western blot程序进行操作[12]。ECL显色、曝光。
1.3.6 数据分析
采用SPSS21.0进行实验数据的统计分析,以均值±标准差(±s)表示实验结果,两组间样本均数比较采用t检验,多组间均值比较采用单因素方差分析,组间两两数值比较用LSD法,检验水准为α=0.05。
2 结果与讨论
2.1 Ⅱ型糖尿病大鼠模型的建立
由表1所示,造模后,Ⅱ型糖尿病组大鼠血糖显著高于正常对照组(p<0.05)。与正常对照组相比,Ⅱ型糖尿病组大鼠体重变化不明显,但饮食量、饮水量和尿量增高(p<0.05)。结果说明,本研究中2型糖尿病大鼠造模成功。
STZ具有选择性损伤胰岛β细胞的功能,对动物的其他组织无明显的损伤作用,是较常用的化学诱导糖尿病试剂,但不同剂量的STZ会导致胰岛β细胞不同程度的损伤,较大剂量的STZ会导致动物胰岛β细胞坏死[13],且较好的动物模型需要考虑膳食因素。因此,目前国内研究用于构建Ⅱ型糖尿病及其并发症常用的方法是膳食加药物诱导[14]。有研究表明,高脂饲料喂养4周后,注射STZ剂量为30 mg/kg和60 mg/kg后,造模成功率分别为80%和25%[15]。本实验采用4周龄,雄性SD大鼠作为研究对象,采用随机分组方式,分为正常对照组和Ⅱ型糖尿病造模组,正常对照组大鼠给予普通饲料喂养,Ⅱ型糖尿病造模大鼠给予高脂高糖饲料喂养。4周后,Ⅱ型糖尿病造模大鼠腹腔注射 STZ(40 mg/kg)溶液,注射 STZ后,大鼠FBG≥11.1 mmol/L并伴有多饮、多食、多尿症状,一周后大鼠血糖稳定未恢复正常即为造模成功,造模成功率为83.3%。
表1 注射STZ1周后大鼠空腹血糖、体重、饮食量、饮水量和尿量Table 1 Fasting blood glucose, body weight, food and water consumption, urinal quantity in rats after STZ injection(±s)

表1 注射STZ1周后大鼠空腹血糖、体重、饮食量、饮水量和尿量Table 1 Fasting blood glucose, body weight, food and water consumption, urinal quantity in rats after STZ injection(±s)
注:*.与正常对照组相比,p<0.05。
组别 n 血糖/(mmol/L) 体重/g 饮食量/g 饮水量/g 尿量/mL正常对照组 10 5.52±1.20 268.80±30.97 18.51±3.14 28.20±15.24 17.77±3.67Ⅱ型糖尿病组 75 23.76±4.62* 273.35±39.67 29.69±5.06* 144.38±25.13* 122.70±28.86*
2.2 紫檀芪对各组大鼠血糖、体重、摄食量、饮水量和尿量的影响(±s)
表2显示,干预7周后,Ⅱ型糖尿病组大鼠体重低于正常对照组,血糖、饮食量、饮水量和尿量高于正常对照组。说明,Ⅱ型糖尿病组大鼠的高血糖水平、多饮、多食、多尿、体重减轻的症状仍然存在。紫檀芪干预组大鼠的体重和饮水量与Ⅱ型糖尿病组相比,无统计学差异。紫檀芪低剂量和中剂量组大鼠的血糖低于Ⅱ型糖尿病(p<0.05);紫檀芪低剂量组大鼠的饮食量低于Ⅱ型糖尿病(p<0.05);与Ⅱ型糖尿病组相比,紫檀芪低剂量组、中剂量组和高剂量组大鼠的尿量下降(p<0.05),说明紫檀芪可以改善Ⅱ型糖尿病的症状,降低Ⅱ型糖尿病大鼠的血糖、饮食量和尿量。
表2 紫檀芪对各组大鼠体重、饮食量、饮水量和尿量的影响Table 2 Body weight, food and water consumption, urinal quantity in rats after PTE intervention(±s)
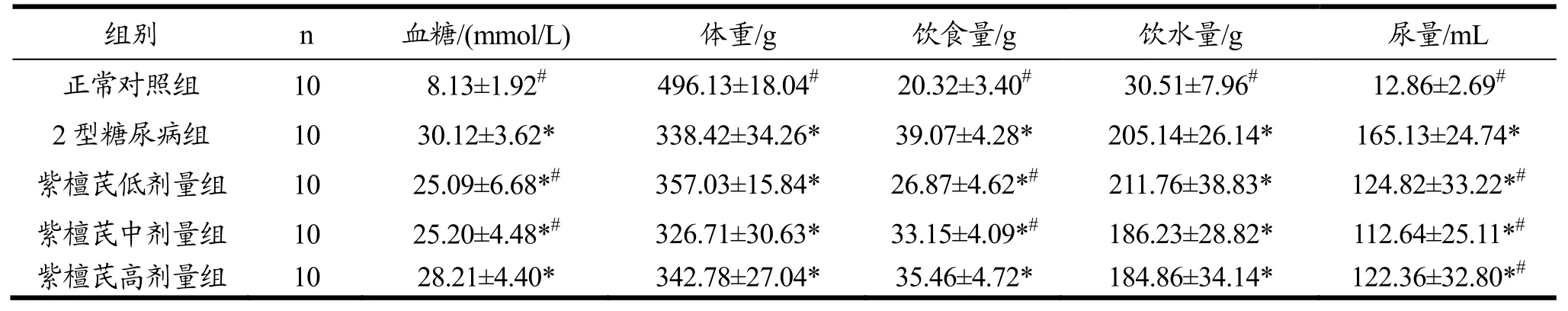
表2 紫檀芪对各组大鼠体重、饮食量、饮水量和尿量的影响Table 2 Body weight, food and water consumption, urinal quantity in rats after PTE intervention(±s)
注:*.与正常对照组相比,p<0.05;#.与Ⅱ型糖尿病相比,p<0.05。
组别 n 血糖/(mmol/L) 体重/g 饮食量/g正常对照组 10 8.13±1.92# 496.13±18.04# 20.32±3.40# 30.51±7.96# 12.86±2.69#饮水量/g 尿量/mL 2 型糖尿病组 10 30.12±3.62* 338.42±34.26* 39.07±4.28* 205.14±26.14* 165.13±24.74*紫檀芪低剂量组 10 25.09±6.68*# 357.03±15.84* 26.87±4.62*# 211.76±38.83* 124.82±33.22*#紫檀芪中剂量组 10 25.20±4.48*# 326.71±30.63* 33.15±4.09*# 186.23±28.82* 112.64±25.11*#紫檀芪高剂量组 10 28.21±4.40* 342.78±27.04* 35.46±4.72* 184.86±34.14* 122.36±32.80*#
2.3 紫檀芪对各组大鼠血脂的影响
表3所示:干预7周后,与正常对照组相比,Ⅱ型糖尿病组大鼠TG、TC、LDL-C水平升高,HDL-C水平降低,差异有统计学意义(p<0.05)。与Ⅱ型糖尿病组相比,紫檀芪低剂量组、中剂量组和高剂量组TG水平降低,具有统计学差异(p<0.05);紫檀芪低剂量组和中剂量组大鼠TC和LDL-C水平降低,差异有统计学意义(p<0.05)。紫檀芪低剂量、中剂量和高剂量组HDL-C水平与Ⅱ型糖尿病组比较无统计学差异。
近年来,脂代谢紊乱在Ⅱ型糖尿病发生发展中逐渐引起重视。脂质在肌肉组织中积聚会引起胰岛素抵抗,在胰腺组织中积聚可以损伤胰岛β细胞,影响胰岛素分泌功能。Ⅱ型糖尿病由于胰岛素受体发生缺陷,胰岛素靶细胞发生结构和功能上的改变,葡萄糖利用障碍,脂质分解作用降低,使得血糖和TG、TC、LDL-C水平升高,产生糖代谢和脂代谢紊乱,导致机体多功能损伤[16,17]。本研究结果显示,Ⅱ型糖尿病大鼠出现明显的脂代谢紊乱,即TG、TC、LDL-C水平升高,HDL-C水平降低。紫檀芪干预后,脂代谢紊乱减轻,TG、TC、LDL-C水平较Ⅱ型糖尿病组大鼠降低。说明紫檀芪可以改善Ⅱ型糖尿病的脂代谢紊乱。
表3 紫檀芪对各组大鼠血脂水平的影响Table 3 Blood lipid in rats after PTE intervention(±s)
注:*.与正常对照组相比,p<0.05;#.与Ⅱ型糖尿病相比,p<0.05。
组别 n TG/(mmol/L) TC/(mmol/L) LDL-C/(mmol/L) HDL-C/(mmol/L)正常对照组 10 0.68±0.47# 1.71±0.48# 0.31±0.14# 1.02±0.17#Ⅱ型糖尿病组 10 5.12±0.89* 2.96±0.69* 0.96±0.20* 0.51±0.10*紫檀芪低剂量组 10 2.53±0.98*# 1.95±0.63# 0.28±0.12# 0.55±0.11*紫檀芪中剂量组 10 3.76±0.92*# 2.13±0.87# 0.75±0.14*# 0.41±0.12*紫檀芪高剂量组 10 3.54±0.94*# 2.51±0.80* 0.88±0.25* 0.59±0.11*
2.4 紫檀芪对各组大鼠血清氧化应激水平的影响
表4结果所示:与正常对照组相比,Ⅱ型糖尿病组大鼠血清中SOD活性降低,MDA水平升高,具有统计学差异(p<0.05)。与Ⅱ型糖尿病组相比,紫檀芪低剂量组和中剂量组大鼠血清中 SOD活性升高,MDA水平降低,差异具有统计学意义(p<0.05)。
氧化应激(Oxidative Stress,OS)是指机体氧化和抗氧化作用失衡,组织细胞内自由基产生过多,超过内源性抗氧化防御系统对其的清除能力,从而导致机体组织细胞损伤,造成细胞功能障碍或死亡。研究表明,Ⅱ型糖尿病的发生与发展与氧化应激有密切的关系[18]。氧化应激会导致胰岛素抵抗的发生,降低胰岛素与受体的结合率,阻断胰岛素信号的转导,引起胰岛素抵抗[19]。SOD作为抗氧化酶,能够清除体内过多的自由基,抑制并修复氧自由基对机体细胞造成的伤害,可以间接反应机体抗氧化能力。MDA是降解的过氧化脂质的产物,可以间接反映机体发生氧化应激的程度及氧自由基对机体细胞损害的程度,在机体内的水平与 SOD呈负相关。本研究说明紫檀芪具有较强的抗氧化作用,能够改善Ⅱ型糖尿病血清氧化应激水平,提高SOD活性。
表4 紫檀芪对各组大鼠血清中SOD和MDA的影响Table 4 The activity of SOD and level of MDA in blood after PTE intervention(±s)
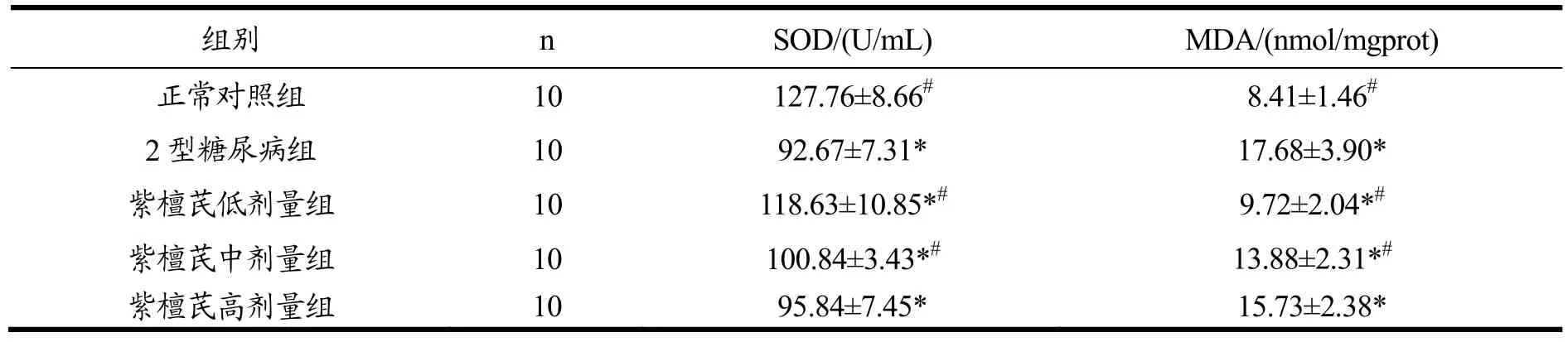
表4 紫檀芪对各组大鼠血清中SOD和MDA的影响Table 4 The activity of SOD and level of MDA in blood after PTE intervention(±s)
注:*.与正常对照组相比,p<0.05;#.与Ⅱ型糖尿病相比,p<0.05。
组别 n SOD/(U/mL) MDA/(nmol/mgprot)正常对照组 10 127.76±8.66# 8.41±1.46#2型糖尿病组 10 92.67±7.31* 17.68±3.90*紫檀芪低剂量组 10 118.63±10.85*# 9.72±2.04*#紫檀芪中剂量组 10 100.84±3.43*# 13.88±2.31*#紫檀芪高剂量组 10 95.84±7.45* 15.73±2.38*
2.5 紫檀芪对各组大鼠脂肪组织中 PPARγ mRNA和蛋白表达的影响
荧光定量PCR和Western blot检测结果显示(见表5和图1),与正常对照组相比,Ⅱ型糖尿病大鼠脂肪组织中PPARγmRNA和蛋白表达量均降低,差异有统计学意义(p<0.05)。与Ⅱ型糖尿病组相比,紫檀芪低剂量组、中剂量组和高剂量组大鼠脂肪组织中PPARγmRNA 和蛋白表达量增加,具有统计学差异(p<0.05)。
脂肪组织是胰岛素作用的重要靶点和糖脂代谢主要场所,一旦脂肪细胞出现胰岛素抵抗,将严重影响周围组织的糖脂代谢;此外,脂肪组织可以分泌多种脂肪因子即蛋白因子,通过自分泌、旁分泌和内分泌的途径参与多种复杂的代谢途径[20]。过氧化物酶体增殖物激活受体(PPAR)是一类由配体激活的核受体转录因子。根据结构不同,PPAR可分为PPARα、β/δ和γ三种类型。其中PPARγ主要在脂肪细胞、肝细胞及肌肉细胞中表达,在脂肪细胞分化、脂类代谢及胰岛素抵抗中扮演重要角色[21,22]。本研究结果显示,Ⅱ型糖尿病组脂肪组织中PPARγ表达较正常对照组低,干预紫檀芪后PPARγ表达显著增高,提示紫檀芪改善Ⅱ型糖尿病脂代谢紊乱可能通过上调 PPARγ表达实现的。然而紫檀芪对Ⅱ型糖尿病的改善可能存在多靶点、多部位、多途径,有待进一步探讨。p<0.05。
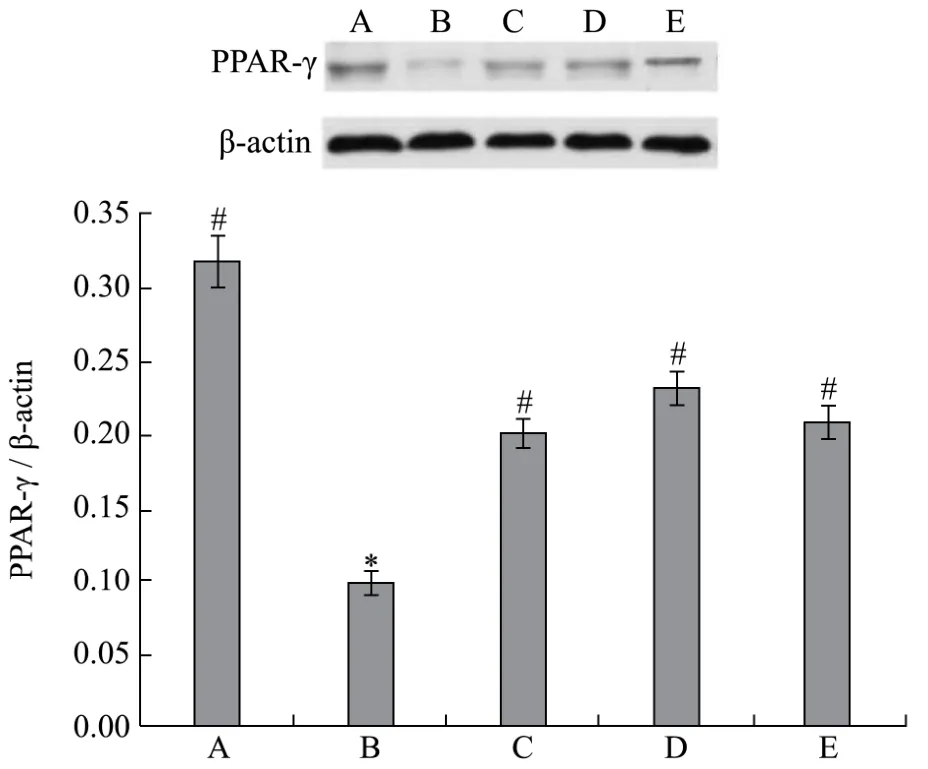
图1 各组大鼠脂肪组织中PPARγ蛋白表达的比较Fig.1 Expression of PPARγ in fat tissue
表5 各组大鼠脂肪组织中PPARγ mRNA相对表达量Table 5 PPARγ mRNA in adipose tissue(±s)
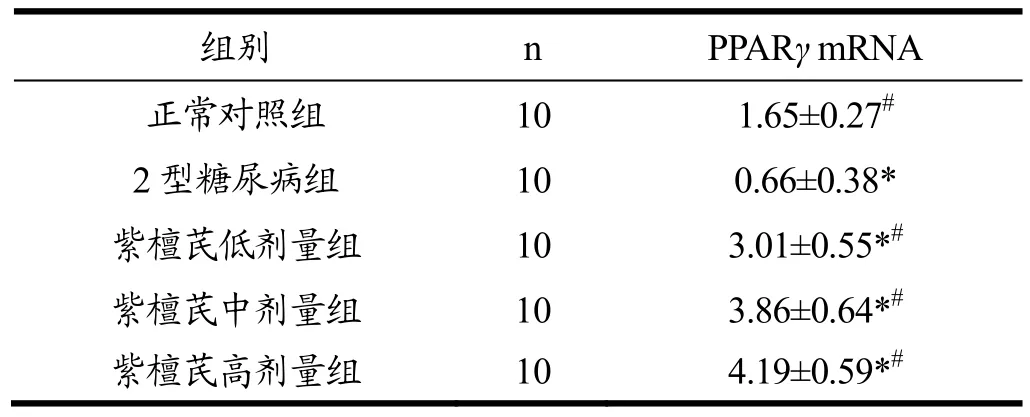
表5 各组大鼠脂肪组织中PPARγ mRNA相对表达量Table 5 PPARγ mRNA in adipose tissue(±s)
注:*.与正常对照组相比,p<0.05;#.与Ⅱ型糖尿病相比,
组别 n PPARγ mRNA正常对照组 10 1.65±0.27#2型糖尿病组 10 0.66±0.38*紫檀芪低剂量组 10 3.01±0.55*#紫檀芪中剂量组 10 3.86±0.64*#紫檀芪高剂量组 10 4.19±0.59*#
3 结论
目前,临床使用胰岛素增敏剂以噻唑烷二酮类药物(thiazolidinediones,TZDs)效果为佳,近年来许多研究确定 PPARγ是 TZDs作用的靶分子。但是,TZDs通过增加脂肪酸代谢和促进葡萄糖转运和利用的同时,导致脂肪积聚增多引起体重和体脂增加,并且有头痛、水肿等不良反应,最终,无法改善脂代谢紊乱症状。本研究证明紫檀芪可以改善2型糖尿病脂代谢紊乱以及调节血清氧化应激水平,其作用机制可能与调节PPARγ有关,这将为2型糖尿病的防治提供新思路,然而紫檀芪改善2型糖尿病脂代谢紊乱的具体分子机制有待深入研究。
