砷中毒地区女性妊娠结局及生殖系统疾病生物学标志物的研究
2018-10-11冯琳张瑗孟玉春杨静逸孙浏余雄武
冯琳,张瑗,孟玉春,杨静逸,孙浏,余雄武
(1.云南省曲靖市妇幼保健院 妇一科,云南 曲靖 655000;2.云南省曲靖市妇幼保健院产二科,云南 曲靖 655000;3.云南舜喜再生医学工程有限公司研究中心,云南 昆明650000;4.云南省曲靖市妇幼保健院 普外科,云南 曲靖 655000)
单质砷和砷的化合物已被国际癌症研究机构(International Agency for Research on Cancer, IARC)明确认定为人类确定致癌物[1]。国外流行病学研究人员通过流行病学研究发现,慢性饮水型砷暴露与全身各系统非恶性疾病及恶性肿瘤的发生密切相关[2-3]。据国内外文献报道提示长期低剂量接触砷可以引发多种疾病,如人体皮肤色素沉着、色素分布异常,皮肤角化过度或角化不全,外周神经病变、脑血管及周围血管病变,生殖功能障碍和全身各器官的肿瘤等[4-5]。本文通过测定砷暴露地区女性的生殖系统生物标志物的水平,初步探讨砷暴露对女性生殖系统的损伤。
1 资料与方法
1.1 研究对象及分组
收集2014年曲靖某砷中毒地区成年女性(18岁及以上)6424例相关资料,平均年龄(28±3)岁。纳入标准为在砷暴露地区居住超过15年的女性,排除标准为接触砷及其砷化物的相关职业人员。所有研究对象都符合纳入标准并且签署知情同意书。按照我国国家标准规定饮水砷卫生标准和我国曲靖地区地下水含砷的水平以及参考文献[6]后,将研究对象按饮水砷浓度不同,分成低砷暴露组(0.01 mg/L≤饮水砷浓度<0.1 mg/L)(1922例),高砷暴露组(饮水砷浓度≥0.1 mg/L)(1502例),非砷暴露地区的成年女性(18岁及以上)作为对照组,饮水砷浓度<0.01 mg/L(3000例)。
1.2 主要试剂和仪器设备
雌二醇(Estradiol, E2)、孕激素(Progesterone,P4)、黄体生成素(Luteinizinghormone, LH)(南京建成生物工程研究所),ER单克隆抗体、PR单克隆抗体,(福建迈新生物技术有限公司),浓缩型DAB试剂盒(北京中杉金桥生物技术有限公司),磷酸盐缓冲液(PBS)(美国Hyclone公司),中性树胶(北京索莱宝科技有限公司),无水乙醇(天津开通化学试剂有限公司),二甲苯(天津市开通化学试剂有限公司),苏木素(北京索莱宝科技有限公司),甲醇(天津市开通化学试剂有限公司),双氧水H2O2(天津市开通化学试剂有限公司)。ASA-2SP砷形态分析仪(日本岛津公司),原子吸收分光光度计(德国耶拿公司),SRAF-16C型电磁炉(日本Shimadzu公司),显微镜(德国Hund公司)。
1.3 标本的采集及检测
1.3.1 尿样、血样的采集与检测 留取研究对象尿液20 ml左右贮存于洁净试管中,冷藏运回实验室,置于-20℃冰箱冷冻待测。取研究对象的中段尿4 ml于洁净的10 ml玻璃试管中,向尿样试管中加入2 mol/L的氢氧化钠8 ml,混匀、高温(100℃)加热3 h,震荡1次/h。现场采取研究对象血液5 ml置于采血管中,冷藏运回实验室,置于-20℃冰箱冷冻待测。严格按照E2、P4、LH试剂盒说明说操作,检测相应的激素水平。原子吸收分光光度计(193.7 nm)测定待测血液和尿液中的砷含量。
1.3.2 子宫和卵巢样本的采集 通过穿刺方式采集活检标本经4%甲醛固定,常规脱水,石蜡包埋,4 μm厚连续切片,进行免疫组织化学染色。
1.4 研究方法
1.4.1 砷含量及血中雌激素水平检测 用氢原子吸收分光光度法测定尿液中和外周血中砷的含量。酶联免疫吸附试验检测血中砷含量及雌激素水平。
1.4.2 免疫组织化学法检测 子宫和卵巢中雌激素受体(ER)、孕激素受体(PR)含量采用免疫组织化学法检测:①切片:将石蜡包埋组织作4μm厚连续切片;②烤片:切片置于60℃温箱内过夜;③脱蜡:常规3级二甲苯脱蜡5min,5级梯度酒精至水1min,蒸馏水冲洗3min,冲洗3次;④阻断:3% H2O2甲醇溶液,室温孵育15min,PBS冲洗3min/次,冲洗3次;⑤抗原修复(高温高压加热法):将修复液置于不锈钢高压锅中煮开,将水化好的组织片浸没在修复液中,煮沸1~2min后,冷却;⑥封闭:切片加1滴正常非免疫动物血清,室温下孵育10min;⑦加一抗和二抗:切片加1滴一抗(ER、PR单克隆抗体)置于湿盒中4℃电冰箱中过夜,PBS冲洗3min,冲洗3次;加1滴生物素标记的二抗体,置于湿盒中4℃孵育30min,PBS冲洗3min,冲洗3次;加一滴链霉素抗生物素一过氧化物酶溶液,置于湿盒中4℃孵育30min,PBS冲洗3min,冲洗3次;⑧显色:切片1滴加新鲜配置的DAB溶液,显微镜下观察显色情况,适时终止反应;⑨复染、分化、返蓝:切片苏木素复染4min,清水冲洗,盐酸酒精分化10s,清水冲洗返蓝,直至核呈蓝色,酒精脱水,二甲苯透明,干燥,中性树脂封片,显微镜下观察结果。阳性判定标准:ER、PR免疫组织化学染色以细胞核中出现棕黄色颗粒为其阳性判定标准。
1.5 统计学方法
数据分析采用SPSS 17.0统计软件,计量资料以均数±标准差(±s)表示,采用单因素方差分析,组间两两比较用LSD-t检验,计数资料采用例(%)表示,采用χ2检验,多个率两两比较采用χ2分割法,P<0.05为差异有统计学意义。
2 结果
2.1 各组妊娠异常及生殖系统肿瘤情况比较
高砷暴露组女性妊娠期出现妊娠高血压和妊娠期不良妊娠结局的概率高于对照组,差异有统计学意义(χ2=13.698和9.394,P=0.002和0.007);高砷暴露组女性生殖系统肿瘤的发生率高于对照组,差异有统计学意义(χ2=17.324,P=0.001)。见表 1。

表1 各组妊娠异常及生殖系统肿瘤情况的比较 例(%)
2.2 各组血砷和尿砷含量比较
各组女性的血砷和尿砷含量差异有统计学意义(P<0.05);组间两两比较显示高砷暴露组和低砷暴露组的血砷和尿砷含量高于对照组(t=9.471、12.575、8.484和10.537,P=0.007、0.003、0.011和 0.005);高砷暴露组的血砷和尿砷含量高于低砷暴露组(t=7.463和11.486,P=0.012和0.004),且随着砷暴露浓度增高,女性的血砷和尿砷呈增高的趋势,存在剂量-效应关系。见表2。
表2 各组血砷和尿砷含量比较 (μg/L,±s)
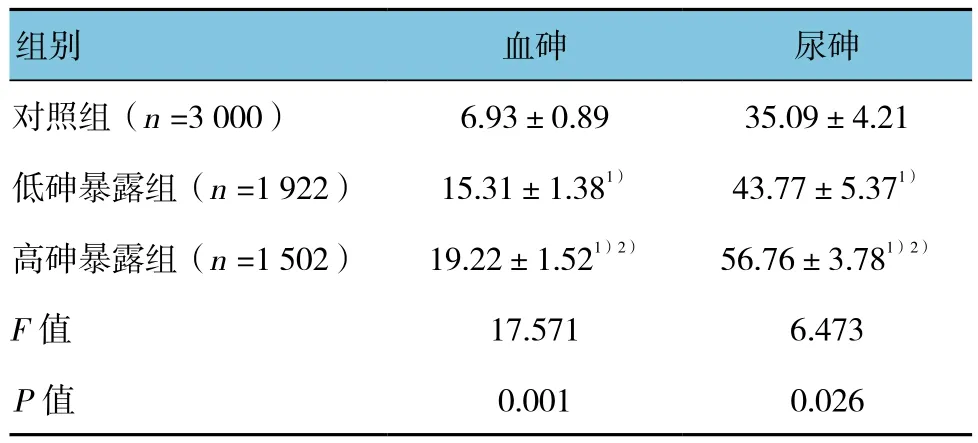
表2 各组血砷和尿砷含量比较 (μg/L,±s)
注:1)与对照组比较,P <0.05;2)与低砷暴露组比较,P <0.05
组别 血砷 尿砷对照组(n =3 000) 6.93±0.89 35.09±4.21低砷暴露组(n =1 922) 15.31±1.381) 43.77±5.371)高砷暴露组(n =1 502) 19.22±1.521)2) 56.76±3.781)2)F值 17.571 6.473 P值 0.001 0.026
2.3 砷暴露对女性雌激素E2、P4、LH的影响
各组女性的E2、P4、LH水平差异有统计学意义(P<0.05),高砷暴露组和低砷暴露组女性体内的E2、P4、LH水平低于对照组(t=17.558、8.458、8.478、12.558、9.455 和 11.948,P=0.000、0.011、0.011、0.003、0.009和0.003);高砷暴露组女性体内的E2、P4、LH水平低于低砷暴露组(t=17.561、7.982和9.482,P=0.001、0.012和0.007),且随着砷暴露浓度增高,女性体内的E2、P4、LH呈降低的趋势。见表3。
表3 砷暴露对女性雌激素E2、P4、LH的影响(pg/ml,±s)

表3 砷暴露对女性雌激素E2、P4、LH的影响(pg/ml,±s)
注:1)与对照组比较,P <0.05;2)与低砷暴露组比较,P <0.05
组别 E2 P4 LH对照组(n =3 000) 55.12±2.82 36.23±1.65 64.39±3.96低砷暴露组(n =1922) 42.04±1.851) 30.32±1.331) 32.24±2.131)高砷暴露组(n =1 502) 10.56±1.301)2) 22.45±1.311)2) 21.57±2.631)2)F值 18.218 17.656 8.473 P值 0.001 0.001 0.011
2.4 雌激素受体蛋白ER、PR在各组女性子宫和卵巢中的表达
各组女性子宫和卵巢中雌激素受体蛋白ER、PR差异有统计学意义(P<0.05);高砷暴露组和低砷暴露组女性子宫和卵巢中雌激素受体蛋白ER、PR水平高于对照组,(t=18.478、12.558、25.455、11.948、53.089、10.488、48.937 和 9.948,P=0.001、0.003、0.000、0.002、0.000、0.005、0.000和0.006);高砷暴露组女性子宫和卵巢中雌激素受体蛋白ER、PR水平高于低砷暴露组(t=12.982、11.685、39.089和36.687,P=0.003、0.003、0.000和0.000);在低砷暴露组和高砷暴露组女性的子宫和卵巢中出现ER、PR高表达的情况。见表4和图1~4。
表4 各组女性子宫和卵巢中雌激素受体蛋白ER、PR的表达比较 (±s)
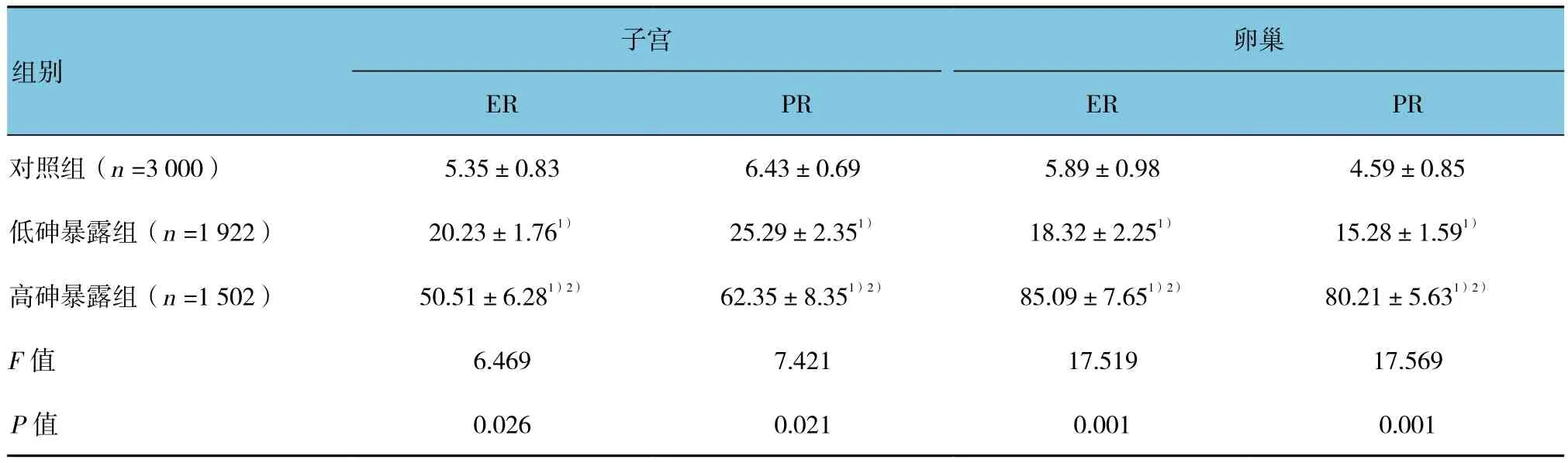
表4 各组女性子宫和卵巢中雌激素受体蛋白ER、PR的表达比较 (±s)
注:1)与对照组比较,P <0.05;2)与低砷暴露组比较,P <0.05
卵巢ER PR ER PR对照组(n =3 000) 5.35±0.83 6.43±0.69 5.89±0.98 4.59±0.85低砷暴露组(n =1 922) 20.23±1.761) 25.29±2.351) 18.32±2.251) 15.28±1.591)高砷暴露组(n =1 502) 50.51±6.281)2) 62.35±8.351)2) 85.09±7.651)2) 80.21±5.631)2)F值 6.469 7.421 17.519 17.569 P值 0.026 0.021 0.001 0.001子宫组别

图1 女性子宫ER表达 (×200)
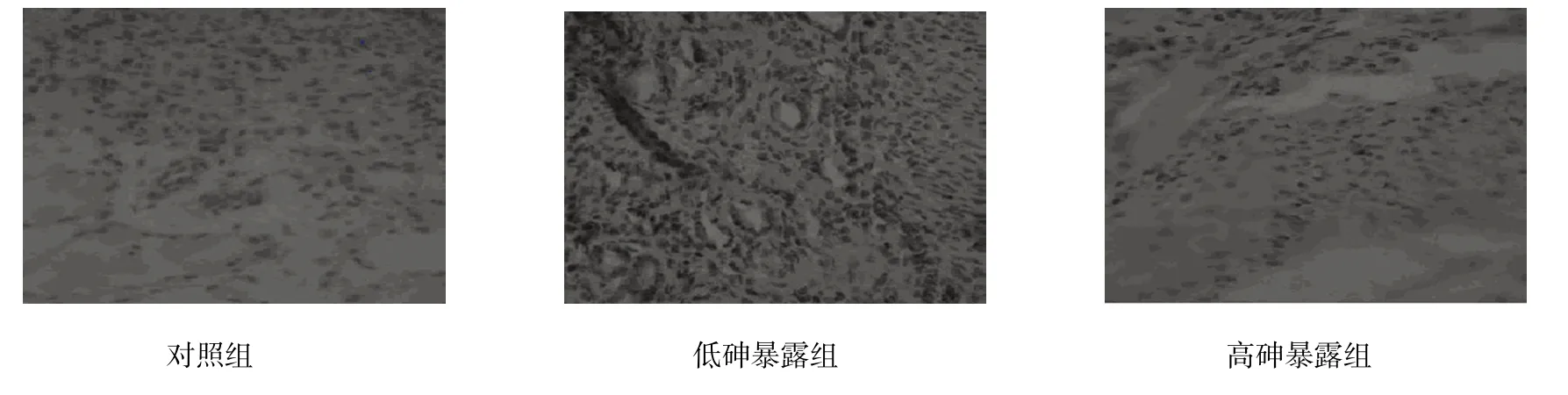
图2 女性子宫PR表达 (×200)
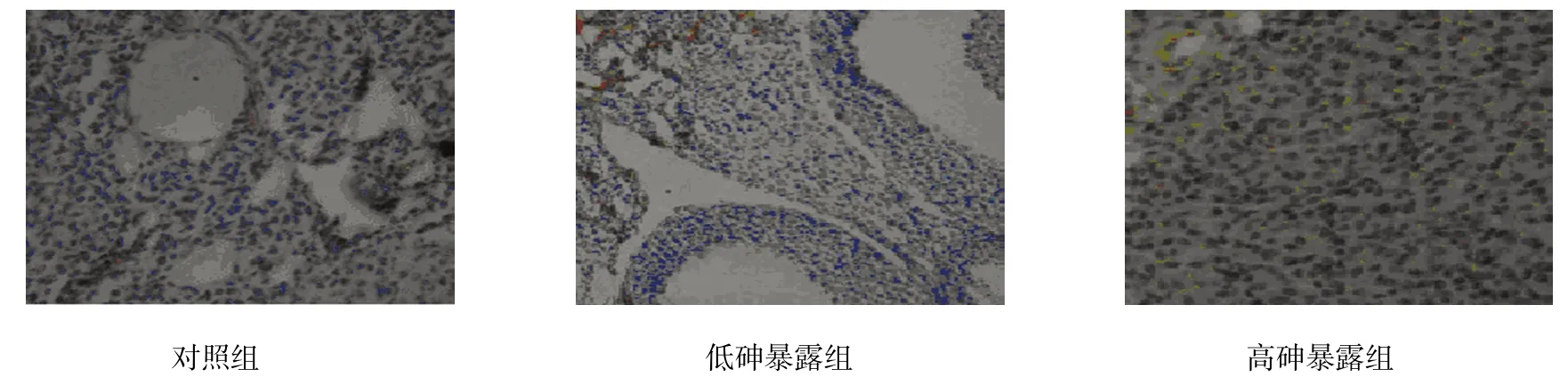
图3 女性卵巢ER表达 (×200)

图4 女性卵巢PR表达 (×200)
3 讨论
大量研究表明[7-8],砷作为内分泌干扰物可对女性的生殖系统有严重的毒性,长期砷暴露可改变女性排卵周期,使生殖系统肿瘤的发生率明显增加;长期砷暴露还会对女性妊娠造成影响,引发妊娠高血压及妊娠高血压并发心脏病的发生率明显增加,易引起早产、流产、死产等不良妊娠结局;长期砷暴露还有一定的生殖毒性,严重者还会增加胎儿畸形的发生率。动物实验也表明[9-10],砷暴露可使雌性动物的卵巢和子宫重量降低,雌激素、孕激素分泌紊乱。本研究结果提示,砷暴露均可使女性体内的血砷和尿砷有不同程度的增加,且有明显的剂量-效应关系。在同一水砷浓度暴露水平下,高暴露组中女性二甲基砷酸(DMA)、总砷(TAs)含量以及一甲基化率(SMR)水平高于男性;低暴露组和对照组无机砷(As)、DMA、TAs含量、SMR水平在不同性别间差异无统计学意义[11],这与本研究的结果具有一致性。
砷及其砷化物是一类环境雌激素物质[12],能够干扰或模拟内源性雌激素作用,竞争性的与下丘脑、卵巢、子宫等脏器上的相应雌激素受体结合,干扰体内雌激素的正常作用与水平,破坏内分泌环境的平衡,从而影响生殖系统的健康生长与正常发育,最终可导致一系列肿瘤的发生[13],对雌激素的干扰途径也各不相同[14]。破坏内分泌微环境的平衡,诱导或抑制人体自然雌激素分泌的水平。本研究显示,砷暴露地区女性的体内雌激素水平处于低水平,并且砷暴露地区生殖系统肿瘤的发生率较高。
砷作为一种潜在的环境内分泌干扰物(EDCs),低剂量即可与类固醇激素受体(SHRs)优先结合,干扰活化的类固醇激素(孕激素、雌激素)的生物学作用,并且能够作为转录因子与DNA结合,从而调控基因的表达水平[15]。砷可对ER、PR存在共同的作用途径,砷可使这些受体产生复杂的剂量依赖效应,如低剂量砷暴露(0.1~1.0 μmol/L)可增强激素依赖性基因的转录与表达;而高剂量砷暴露(1.0~5.0 μmol/L)却可以抑制激素依赖性基因的转录与表达,提示砷可通过调控基因转录与表达而发挥作用[15-17]。刘晓霞等[18]研究发现,ER与雌激素结合后活化,参与基因转录,要么直接诱导靶基因转录,要么通过其他方式诱导靶基因转录,从而通过对靶基因的调控而发挥其生物学效应。砷可通过干扰激素与激素受体的结合而扰乱激素的分泌及发挥其生物学作用。本研究结果提示,砷可以使激素受体蛋白ER、PR的表达紊乱,影响女性的生殖健康。体外实验及动物实验提示[19-20]砷具有雌激素样的作用。动物实验提示大鼠及小鼠动情周期紊乱,雌性小鼠子宫和卵巢的ER和PR mRNA表达水平降低。细胞实验提示0.5 μmol/L As2O3对Hela细胞的ERa及PR mRNA表达水平的影响与1mmol/L的雌二醇对Hela细胞的ERa及PR mRNA表达水平的影响相似,且它们的作用均可被雌二醇拮抗剂所拮抗。
血砷、尿砷可以作为砷暴露地区女性生殖系统损害的暴露标志物,E2、P4、LH、ER、PR可作为效应标志物。在今后的研究中,应该加强对砷中毒病区的流行病调查,同时还可以开展大量动物实验及体外实验,并且运用分子生物技术监测分析砷中毒发病及相关生物标志物,从遗传流行病学及分子流行病学方面分析砷中毒的生物标志物,为揭示砷中毒发病的分子机制,为防治砷中毒提供可靠的理论依据。
