Survivin-shRNA对A431皮肤鳞状细胞癌抑制作用的实验研究*
2018-10-11郝玉琴刘侠康淑霞张鑫张坤朱永蒙
郝玉琴,刘侠,康淑霞,张鑫,张坤,朱永蒙
[1.内蒙古医科大学第三附属医院(包钢医院)皮肤科,内蒙古 包头 014010;2.内蒙古医科大学,内蒙古 呼和浩特 010110;3.内蒙古医科大学第三附属医院(包钢医院)生殖中心,内蒙古 包头 014010]
皮肤鳞状细胞癌(squamous cell carcinoma, SCC)为皮肤科常见恶性肿瘤,且发病率逐年上升[1],传统治疗SCC的方法包括手术切除、放疗、光动力治疗、激光、冷冻等,然而这些方法对于发生在暴露部位、特殊部位以及较大的肿瘤疗效欠佳。靶向Survivin-shRNA有抑制肿瘤细胞增殖,促进肿瘤细胞凋亡等作用。NF-κB对肿瘤的发生、发展有重大意义,其传导通路可通过调控Bax、Survivin等多种下游凋亡基因,从而控制肿瘤细胞的凋亡[2-3]。生存素(Survivin)是近年发现的最新凋亡抑制因子,本研究通过观察SurvivinshRNA对人SCC A431细胞株裸鼠移植瘤生长情况的影响,探讨NF-κB信号通路在Survivin-shRNA诱导SCC移植瘤凋亡中的作用。
1 材料与方法
1.1 材料与动物
人皮肤鳞状细胞癌A431细胞由长沙赢润生物技术有限公司提供,Hela细胞由长沙赢润生物技术有限公司代购,rAd-EGFP、shRNA表达载体pYr-1.1由长沙赢润生物技术有限公司提供,rAd-SurvivinshRNA腺病毒由长沙赢润生物技术有限公司构建,包装细胞HEK 293购自美国ATCC公司,DMEM(高糖型)培养基、胎牛血清、胰酶、抗生素购自美国Invitrogen公司,凯基Annexin-V-FITC细胞凋亡试剂盒购自深圳晶美生物有限公司,β-acting购自美国Abgent公司,ECL化学发光试剂盒购自美国Pierce公司。SPF级BALB/c-nu裸鼠,6~8周龄,18~22 g,购自湖南斯莱克景达实验动物有限公司,动物质量合格许可证编号为:SCXK(湘)2011-0003。
1.2 实验方法
1.2.1 细胞培养 A431细胞培养在含10%小牛血清、青霉素和链霉素各100 u/ml的高糖DMEM培养液中,37℃、5% CO2饱和湿度条件下培养。当细胞生长处于对数生长期时,用0.25%胰蛋白酶消化细胞成单细胞悬液,血细胞平板计数,调整细胞密度为5×107个/ml,4 ml,备用。
1.2.2 构建Survivin-shRNA腺病毒载体,筛选最佳干扰序列 根据shRNA靶位点的选择原则,从赢润shRNA数据库中择优选取3条Survivin shRNA序列作为待筛靶序列,以便开展后续实验。靶序列1:GAGGCTGGCTTCATCCACTGC,靶序列2:GAGCCAA GAACAAAATTGC,靶序列3:GAAAGTGCGCCGTGCC AT。以上述靶序列为基础,设计Survivin-shRNA引物:正向Survivin-sh1:5'-CACCGAGGCTGGCTTCAT CCACTGCCTCGAGGCAGTGGATGAAGCCAGCCTCTTT TTTG-3',反向 Survivin-sh1:5'-AGCTCAAAAAAGAG GCTGGCTTCATCCACTGCCTCGAGGCAGTGGATGAAG CCAGCCTC-3';正向 Survivin-sh2:5'-CACCGAGCCAA GAACAAAATTGCTTCAAGAGAGCAATTTTGTTCTTGG CTCTTTTTTG-3',反向 Survivin-sh2:5'-AGCTCAAAAA AGAGCCAAGAACAAAATTGCTCTCTTGAAGCAATTTT GTTCTTGGCTC-3';正向Survivin-sh3:5'-CACCGAA AGTGCGCCGTGCCATCTTCAAGAGAGATGGCACGGC GCACTTTCTTTTTTG-3',反向 Survivin-sh3:5'-AGCTC AAAAAAGAAAGTGCGCCGTGCCATCTCTCTTGAAGA TGGCACGGCGCACTTTC-3'。shRNA表达载体构建合成上述引物,用退火Buffer分别溶解引物,然后置于沸水中,自然退火。(退火Buffer的配方为:10 mmol Tris-HCl pH8.0、50 mmol NaCl、1 mmol EDTA)。pYr-1.1原载体上有1个SacⅠ酶切位点(GAGCTC),当外源的shRNA片段成功插入,则会带入1个新的SacⅠ酶切位点,2个SacⅠ之间的片段长度约为930 bp。因此,pYr-1.1-Survivin-shRNA可以用SacⅠ来进行酶切鉴定。将培养好的Hela细胞分为5组:①KB组:空白细胞组;②NC组:转染pYr-1.1-NC质粒的Hela细胞;③Survivin-1组:转染pYr-1.1-Survivin-sh1质粒的Hela细胞;④Survivin-2组:转染pYr-1.1-Survivin-sh2质粒的Hela细胞;⑤Survivin-3组:转染pYr-1.1-Survivin-sh3质粒的Hela细胞。在转染后的48 h收集细胞用于实时荧光定量聚合酶链反应(quantitative real-time polymerase chain reaction, qRTPCR)和Western blot检测。
1.2.3 复制A431裸鼠移植瘤模型 将培养好的A431细胞混悬液以1 ml注射器分别抽取细胞悬液,接种于SPF级BALB/c-nu裸鼠,每只裸鼠接种0.2 ml,接种细胞量约为1×107个,接种部位为裸鼠右侧腋窝皮下,接种前用碘伏消毒皮肤,观察裸鼠生活状况。接种后第12天,选择肿瘤体积为100~200 mm3左右的裸鼠为实验模型。
1.2.4 实验分组及处理 将20只成瘤后的裸鼠随机分为空白对照组、阴性对照组、Survivin-shRNA转染组及Res阳性对照组,每组5只,瘤内注射相应试剂0.15 ml,1次/2 d,共6次。瘤鼠药物处理后,每4 d记录肿瘤生长情况,并于开始药物处理后的第20天颈椎脱臼法处死所有裸鼠,取瘤组织行后续实验。①空白对照组:单纯注射无血清无抗生素的DMEM培养液;②阴性对照组:rAd-EGFP;③SurvivinshRNA转染组:rAd-Survivin-shRNA;④Res阳性对照组:注射50 mg/kg Res。
1.2.5 瘤体积、瘤重测量及抑瘤率计算 用数字游标卡尺测量肿瘤体积。BALB/c-nu裸鼠腋下皮下接种人A431细胞后,第8天开始观察到肿瘤生长,随后各组肿瘤逐天增长,第12天体积基本达到100 mm3以上,根据瘤体积及接种时间绘制肿瘤生长曲线。药物处理后20 d,分离被处死的裸鼠肿瘤,称瘤重,计算抑瘤率。瘤重抑瘤率%=(阴性对照组瘤重-实验组瘤重)/阴性对照组瘤重×100%;瘤体积抑瘤率%=(阴性对照组瘤体积-实验组瘤体积)/阴性对照组瘤体积×100%。瘤体积使用如下公式计算:V=L×S2/2,V为肿瘤体积(mm3),L为肿瘤长径(mm),S为肿瘤短径(mm)。形状不规则肿瘤:L按最长直径计,S按与最长直径垂直的短径中间值计。
1.2.6 HE染色 将裸鼠成瘤组织经脱蜡、水化后,用苏木精伊红常规染色,滴加中性树胶,盖片封片,镜下观察细胞形态。
1.2.7 TUNEL检测细胞凋亡情况 荧光素(Fluorescein)标记的dUTP在脱氧核糖核苷酸末端转移酶(TdT Enzyme)的作用下,可以连接到凋亡细胞中断裂的DNA的3'-OH末端,可用荧光显微镜检测。由于正常的或正在增殖的细胞几乎没有DNA的断裂,因而没有3'-OH形成,很少能被标记。TUNEL结果判读:凋亡细胞核呈绿色,每张切片在高倍镜(400倍)下选取其中5个视野,在每个视野计数100个细胞中凋亡细胞数,取5个视野(>500个细胞),检测阳性表达率(阳性核占视野中总细胞核百分比)作为细胞凋亡指数(apoptosis index, AI)。
1.2.8 Western blot法测定Survivin、P53、IKB、P65、Caspase-3蛋白的表达水平 倒尽培养瓶中的培养液,再往培养瓶中加入适量的生理盐水,轻轻摇动培养瓶洗涤细胞,弃去洗液,根据样品数量,按50体积Solution A加1体积Solution B(50∶1)配置适量BCA工作液,经SDS-PAGE电泳及转膜,将膜移至含有5%脱脂牛奶(用TBST溶解牛奶)封闭液的平皿中,室温下脱色摇床上摇动封闭1 h,将底物A和B在EP管中等体积混合,1 min后,将膜蛋白面朝上放在杂交袋中,再将混合好的A、B底物滴加在膜上,去尽残液,包好,放入X射线片夹中,将胶片进行扫描或拍照,用凝胶图像处理系统进行灰度分析。
1.3 统计学方法
数据分析采用SPSS 19.0统计软件,计量资料以均数±标准差(±s)表示,多组间比较采用单因素方差分析,组间两两比较采用SNK-q检验,计数资料采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 酶切鉴定、测序及最佳干扰序列筛选结果
pYr-1.1-Survivin-shRNASacⅠ酶切鉴定结果见图1。由酶切结果可知,此pYr-1.1-Survivin-sh1、pYr-1.1-survivin-sh2、pYr-1.1-Survivin-sh3克隆是正确的。将上述pYr-1.1-Survivin-sh1、pYr-1.1-Survivinsh2、pYr-1.1-Survivin-sh3克隆送去测序。测序引物为:hU6-5' Sequencing primer:5'-GACTATCATAT GCTTACCGT-3'。

图1 pYr-1.1-Survivin-shRNA酶切鉴定图
pYr-1.1-Survivin-sh1测序结果见图2。Sequence 0:欲获得Survivin-shRNA-1序列,Sequence 1:pYr-1.1-Survivin-sh1.ab1测序序列,比对软件:DNAssist。
pYr-1.1-Survivin-sh2测序结果见图3。Sequence 2:欲获得Survivin-shRNA-2序列,Sequence 3:pYr-1.1-survivin -sh2.ab1测序序列,比对软件:DNAssist。
pYr-1.1-Survivin-sh3测序结果见图4。Sequence 7:欲获得survivin-shRNA-3序列,Sequence 9:pYr-1.1-Survivin-sh3.ab1测序序列,比对软件:DNAssist。

图2 pYr-1.1-Survivin-sh1测序结果

图3 pYr-1.1-Survivin-sh2测序结果

图4 pYr-1.1-Survivin-sh3测序结果
由以上结果可知,pYr-1.1-Survivin-sh1、pYr-1.1-Survivin-sh2、pYr-1.1-survivin-sh3构建成功。经qRT-PCR和Western-blot检测,Survivin-sh2干扰效果最明显,选为最佳干扰序列。qRT-PCR检测各组细胞中Survivin mRNA表达情况,见图5。Western blot检测各组细胞中Survivin蛋白表达情况,见图6。
2.2 各组肿瘤生长曲线、移植瘤体积、瘤重、及抑瘤率比较

图5 各组细胞mRNA表达
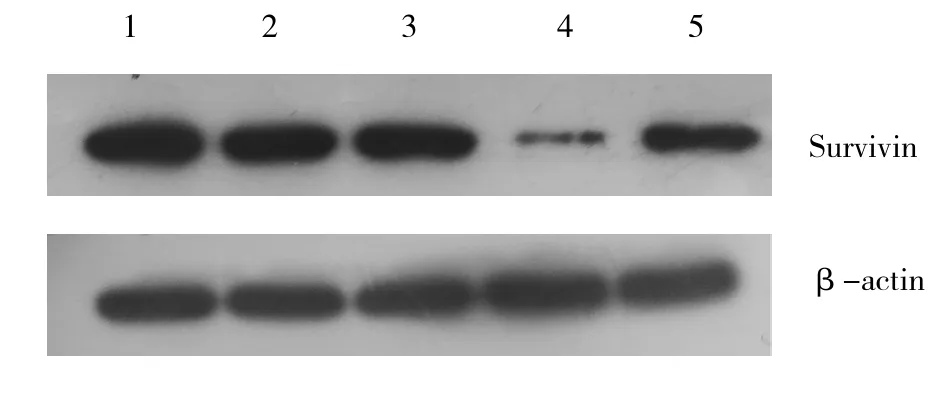
图6 各组细胞Survivin的蛋白表达

图7 各组裸鼠移植瘤生长曲线图
各组动物至实验结束无一只死亡,均全部进入指标检测。从各组肿瘤生长曲线(见图7)可以看出,与空白对照组及阴性对照组比较,Survivin-shRNA转染组及Res阳性对照组在相应干预后移植瘤生长均有不同程度的抑制。干预结束时,Survivin-shRNA转染组及Res阳性对照组与空白对照组及阴性对照组的瘤体积、瘤重比较,差异有统计学意义(P<0.05),Survivin-shRNA转染组及Res阳性对照组均有较高抑瘤率,其瘤体积抑瘤率分别为45.39%和56.55%,瘤重抑瘤率分别为41.25%和56.25%。见表1。
2.3 各组移植瘤组织HE染色结果
光镜下观察HE染色切片可见各组移植瘤组织内有坏死,坏死灶与瘤组织界限较清晰。其中空白对照组及阴性对照组每张切片仅有少许坏死,大部分为肿瘤组织,肿瘤细胞密集成群、生长旺盛、细胞多为多边形,核大深染;Survivin-shRNA转染组及Res阳性对照组坏死细胞较多,肿瘤组织较少,肿瘤细胞分布稀疏,有变性的液化坏死灶,癌细胞皱缩变圆,胞核固缩。见图8。
2.4 各组移植瘤组织TUNEL检测结果
TUNEL检测细胞凋亡阳性表达率水平,经单因素方差分析,差异有统计学意义(F=22.177,P=0.000),各组细胞凋亡阳性表达率有差异;与Res阳性对照组比较,Survivin-shRNA转染组细胞凋亡阳性表达率差异无统计学意义(t=1.569,P=0.169);与空白对照组及阴性对照组比较,Survivin-shRNA转染组细胞凋亡阳性表达率增高,差异有统计学意义(t=4.769和6.289,P=0.001和0.000)。荧光显微镜下凋亡细胞阳性表达见图9。
表1 各组瘤体积及瘤重抑瘤率比较结果 (±s)

表1 各组瘤体积及瘤重抑瘤率比较结果 (±s)
注:1)与阴性对照组比较,P<0.05;2)与空白对照组比较,P<0.05
瘤率/% 瘤重/g 瘤重抑瘤率/%空白对照组 1668.98±242.56 - 1.06±0.23 -阴性对照组 1792.36±55.10 - 1.60±0.29 -组别 瘤体积/mm3瘤体积抑SurvivinshRNA转染组 978.86±150.611) 45.39 0.94±0.321)2) 41.25 Res阳性对照组 778.73±131.801)2) 56.55 0.7±0.231)2) 56.25 F值 49.273 - 9.791 -P值 0.000 - 0.010 -

图8 各组移植瘤组织学改变 (显微镜×200)

图9 各组凋亡细胞阳性表达 (荧光显微镜×400)
2.5 各组凋亡相关因子蛋白表达
Western blot法检测各组Survivin、P65、P53、IκB、Caspase-3蛋白表达,经单因素方差分析,差异有统计学意义(P<0.05),各组 Survivin、P65、P53、IκB、Caspase-3蛋白表达有差异。与Res阳性对照组比较,Survivin-shRNA转染组Survivin、P65、IκB的蛋白表达差异无统计学意义(t=0.045、1.451和0.369,P=0.965、0.185 和 0.722);P53、Caspase-3蛋白表达降低,差异有统计学意义(t=3.476和3.041,P=0.020和0.023)。与空白对照组及阴性对照组比较,Survivin-shRNA转染组Survivin、P65蛋 白的表达均降低,差异有统计学意义(tSurvivin=16.974和 19.594,tP65=9.808和 8.385, 均P=0.000),P53、IκB、Caspase-3蛋白表达均增高,差异有统计学意义(tP53=14.645 和 15.236,均PP53=0.000;tIκB=2.795和 2.807,均PIκB=0.023 ;tCaspase-3=6.206 和 6.731, 均PCaspase-3=0.000)(见表2)。各组凋亡相关因子蛋白表达检测结果见图10。
表2 各组凋亡相关因子蛋白表达比较 (±s)
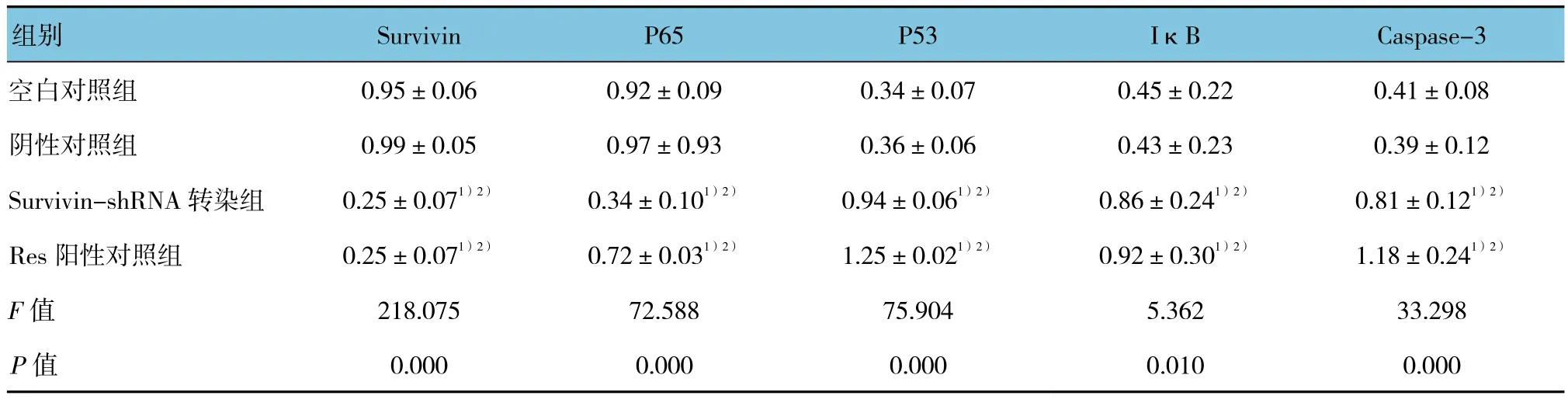
表2 各组凋亡相关因子蛋白表达比较 (±s)
注:1)与阴性对照组比较,P <0.05;2)与空白对照组比较,P <0.05
组别 Survivin P65 P53 IκB Caspase-3空白对照组 0.95±0.06 0.92±0.09 0.34±0.07 0.45±0.22 0.41±0.08阴性对照组 0.99±0.05 0.97±0.93 0.36±0.06 0.43±0.23 0.39±0.12 Survivin-shRNA 转染组 0.25±0.071)2) 0.34±0.101)2) 0.94±0.061)2) 0.86±0.241)2) 0.81±0.121)2)Res阳性对照组 0.25±0.071)2) 0.72±0.031)2) 1.25±0.021)2) 0.92±0.301)2) 1.18±0.241)2)F值 218.075 72.588 75.904 5.362 33.298 P值 0.000 0.000 0.000 0.010 0.000

图10 各组凋亡相关因子蛋白表达
3 讨论
Survivin是凋亡抑制蛋白(inhibitor of apoptosis protein, IAP)家族中分子量最小且作用最强的凋亡抑制因子,不同于IAP家族的其他成员,Survivin在多种人类恶性肿瘤中高表达,而在分化成熟的组织中不表达或低表达,这一特性使它成为研究肿瘤标记和抗肿瘤治疗的标志性蛋白[4]。
肿瘤是多种基因相互作用调控的结果,RNA干扰(RNA interference, RNAi)技术是通过小干扰RNA(small interfering RNA, siRNA)引起目的信使RNA(messenger RNA, mRNA)特异性降解,从而使基因转录后沉默的一种现象。RNA干扰技术可以同时沉默多个肿瘤相关基因,因此成为目前肿瘤治疗的研究热点。载体介导shRNA表达技术能长期和稳定地抑制目的基因的表达,可用于构建理想的实验细胞模型,因此,shRNA表达载体技术已成为肿瘤基因治疗的强大工具[5]。
P53是一种核转录因子,可通过一系列的应激因素如DNA损伤、低氧和癌基因活化后可被激活。P53的关键作用之一就是通过参与细胞周期检查点的调控来维持遗传的稳定性;同时作为肿瘤抑制基因,P53在肿瘤发生的预防中也发挥着关键作用。其对Survivin的调节也有细胞周期依赖性。Survivin作为在G2/M期特异性表达的凋亡抑制蛋白参与细胞周期和凋亡的调控,P53作为凋亡活化基因通过在细胞周期的检查点抑制Survivin的活性而发挥其生物学功能,而Survivin又可以在转录后水平对P53进行调节。二者通过调控细胞周期和细胞凋亡来参与肿瘤发生的调控[6-7]。
核因子κB(NF-κB)是一个在肿瘤的发生和发展中存在的关键转录因子,它参与多种细胞生物反应,其活化后可进入细胞核,调节编码细胞因子、生长因子、细胞黏附分子和细胞凋亡相关蛋白的表达。NF-κB家族包括5个成员:NF-κB1(P50及其前体 P105)、NF-κB2(P52及 其 前 体 P100)、RelA(P65)、RelB、c-Rel,形成不同的同源和异源二聚体。不同的信号通路导致不同的二聚体NF-κB的激活,导致不同的生物学结果[8]。其中RelA(P65)主要参与细胞增殖和有效的免疫应答。IκB(inhibitor of NF-κB)是NF-κB的抑制蛋白,在未受刺激的细胞中,NF-κB与IκB的结合被隔离在细胞质外,防止NF-κB与DNA结合,从而抑制NF-κB的生物学功能。NF-κB信号的激活是由细胞外刺激启动的,这些刺激被受体识别并传递到细胞中,将导致IκB激酶(IKK)激活,使IκB磷酸化并泛素化,最后IκB降解,释放的NF-κB蛋白被运入细胞核,结合到相应的靶序列上激活基因并启动转录[9]。在B细胞淋巴瘤、结直肠癌和T细胞白血病中,已报道了NF-κB与Survivin基因启动子区结合并增强转录[10]。
CUI等[11]研究表明,在膀胱癌中,NF-κB可以促进细胞周期进程,并且活化的NF-κB信号通路有助于Survivin表达上调,并通过上调Survivin的表达,减少细胞凋亡,从而增加细胞的增殖。ZENG等[10]在食道癌的研究发现,上调Survivin的表达可以增加P65的上游基因IKK在转录水平上表达增高,并可以促进P65的蛋白表达增加,反之则抑制P65的蛋白表达,Survivin可以与IKK的启动子区域结合。过表达的Survivin可以激活P65的活性,抑制细胞凋亡,促进细胞增殖。鲍聚喜等[12]发现,在结肠癌中,靶向沉默P65基因,可以降低Survivin基因的表达。
本实验结果显示,靶向Survivin-shRNA可以抑制裸鼠移植瘤瘤体积及瘤重的生长;在显微镜下Survivin-shRNA组移植瘤组织细胞较少,分布稀疏,有变性的液化坏死灶,癌细胞皱缩变圆,胞核固缩;通过TUNEL检测Survivin-shRNA组细胞凋亡率增高。靶向Survivin-shRNA可以抑制SCC裸鼠移植瘤的生长,并促进肿瘤细胞凋亡,再次证明靶向SurvivinshRNA对肿瘤的抑制作用。通过Western blot法检测Survivin、P53、IκB、P65、Caspase-3蛋白的表达,结果显示,Survivin-shRNA组P53、IκB、Caspase-3蛋白的表达增加,而Survivin、P65蛋白的表达降低,这与相关文献结果是一致的[10]。因此推测,SurvivinshRNA抑制SCC裸鼠移植瘤生长的机制之一,可能是靶向Survivin-shRNA抑制Survivin表达,从而抑制P65的上游基因IKK表达,促使IκB与P65的结合,抑制了P65的表达,进而促进肿瘤细胞凋亡,最终导致SCC移植瘤的生长受到抑制。其次靶向SurvivinshRNA使Survivin的表达降低,激活Caspase-3,从而促使细胞凋亡,而形成的凋亡蛋白又进一步激活P53,从而进一步扩大凋亡效应。
综上所述,靶向Survivin-shRNA对A431 SCC抑制作用机制之一,可能是通过抑制NF-κB信号通路的表达来实现的。
