不同剂量艾司洛尔对脓毒症心肌病大鼠TNF-α和IL-10的影响
2018-09-28吴莉,姜芸
吴 莉, 姜 芸
(新疆医科大学附属肿瘤医院综合内二科, 乌鲁木齐 830011)
在重症加强治疗病房(intensive care unit,ICU)里,脓毒症是最常见的死亡原因之一,人们对其发生发展的病理生理学机制及临床预防和治疗有了大量的研究,但其发病率及致死率仍居高不下[1]。脓毒症可以引发多器官功能障碍,其中引发的心血管功能障碍的患者病死率高。有研究表明,脓毒症患者中,合并心血管功能障碍的患者病死率高达70%,无心功能障碍的患者病死率仅为20%[2]。所以人们对早期脓毒症患者心肌功能的保护非常重视。选择性β1受体阻滞剂(艾司洛尔)是众多心脏病患者中常用的药物,艾司洛尔是β1肾上腺素受体阻滞剂的代表药物,艾司洛尔因对脓毒症患者血糖、细胞因子、代谢等均产生保护作用,故使用该类药物的脓毒症患者预后较好[3]。部分研究表明,艾司洛尔可以降低心肌耗氧量、降低心肌酶及肌钙蛋白水平、调节血流动力学指标等,对脓毒血症患者的心脏有明显保护作用[4-5]。
脓毒症早期,机体释放大量的炎症介质,其中肿瘤坏死因子(tumor necrosis factor-α, TNF-α)是炎症反应过程中出现最早、最重要的炎症因子,TNF-α被公认为是引起内毒素休克、多器官功能衰竭发生的主要炎症介质。白介素-10(interleukin-10, IL-10),由辅助性T细胞和单核巨噬细胞产生,具有强有力的抗炎和免疫抑制作用,在全身炎症反应综合征(systemic inflammatory response syndrome,SIRS)中发挥重要作用[6]。人们将TNF-α和IL-10作为疾病治疗中判断疾病危重及预后指标,如肺炎、缺血再灌注损伤、溃疡性结肠炎等[7-9]。本研究以TNF-α与IL-10作为脓毒症心肌病预后的指标,探讨不同剂量的艾司洛尔对脓毒症心肌病大鼠预后的影响。
1 材料与方法
1.1实验试剂脂多糖:10 mg/瓶(美国Sigma),艾司洛尔:2 mL:0.2 g/瓶(齐鲁制药有限公司生产),大鼠IL-10和TNF-α的ELISA试剂盒(上海研生生化试剂有限公司)。
1.2实验动物分组、脓毒血症建模及处理雄性大鼠月龄3个月(新疆医科大学实验动物中心提供),体质量约(220±50) g,共50只。光亮/黑暗周期14 h/10 h,环境温度为23℃左右,分隔喂养,适应周围环境1 w后开始实验。随机分为:空白对照组(10只,简称K组,尾静脉注射生理盐水)、模型组(10只,简称L组,尾静脉注射脂多糖6 mg/kg)和干预组(30只,简称T组),根据艾司洛尔用量不同分3个亚组:T1组(10只):艾司洛尔0.2 mg·kg-1·min-1加尾静脉注射脂多糖6 mg/kg/组;T2组(10只):艾司洛尔0.3 mg·kg-1·min-1加尾静脉注射脂多糖6 mg/kg/组;T3组(10只):艾司洛尔0.5 mg·kg-1·min-1加尾静脉注射脂多糖6 mg/kg/组。
具体方法:造模第一步是L组和T组使用脂多糖(6 mg/kg)稀释成0.5 mL进行大鼠尾静脉注射,K组使用0.5 mL生理盐水大鼠尾静脉注射,选取注射脂多糖后经测定血浆中脑钠肽水平高于正常的大鼠入组干预组,干预组分成3个亚组,给予不同剂量的艾司洛尔。
1.3观察指标观察K组、L组、T组(T1、T2、T3)分别用药物干预后3、6和12 h时间点各组大鼠血浆中TNF-α、IL-10的变化,观察动物的生存期。
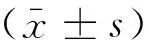
2 结果
2.1不同干预时间点各组大鼠血浆中TNF-α水平变化药物干预后3、6、12 h,L组大鼠血浆中TNF-α水平明显高于K组,差异有统计学意义(P<0.05)。干预组中3个亚组,随着艾司洛尔药物剂量增大,血浆TNF-α水平下降越明显。L组与T组3个亚组比较,组间TNF-α水平差异均有统计学意义(P<0.05),见表1。
表1 不同干预时间点各组大鼠血浆中TNF-α水平变化

表1 不同干预时间点各组大鼠血浆中TNF-α水平变化
组别3 h6 h12 hK组13.43±2.9514.47±2.9122.47±1.81L组147.27±6.07#216.85±5.44#275.58±8.77#T1组123.76±7.25*188.66±7.16*208.18±8.49*T2组119.90±6.25*173.38±6.74*192.95±7.30*T3组103.99±5.40*153.61±5.47*174.56±6.12*
注: 与L组比较,*P<0.05; 与K组比较,#P<0.05。
2.2不同干预时间点各组大鼠血浆中IL-10水平变化药物干预后3、6、12 h,L组大鼠血浆中IL-10水平明显高于K组,差异有统计学意义(P<0.05);干预组中3个亚组,随着艾司洛尔药物剂量增大,IL-10水平变化与艾司洛尔剂量变化无关。L组与T组3个亚组比较,各组间IL-10水平差异无统计学意义(P>0.05),见表2。
表2 不同干预时间点各组大鼠血浆中IL-10水平变化

表2 不同干预时间点各组大鼠血浆中IL-10水平变化
组别3 h6 h12 hK组18.43±1.1521.58±1.4122.53±1.23L组124.93±2.65*125.72±6.03*129.94±5.83*T1组122.73±3.35119.87±2.86125.85±2.65T2组120.00±2.62127.87±3.30135.31±2.74T3组126.40±2.58120.62±3.82137.74±5.78
注:与K组比较,*P<0.05。
3 讨论
严重脓毒症已成为影响人类健康的主要问题,全球每年有成千上万的人因感染、创伤、烧伤、大手术等原因而罹患脓毒症。随着人们研究的不断深入,发现脓毒症复杂的病理生理过程,最终引发多器官功能障碍。其中心血管功能障碍尤为突出,表现为心肌细胞损伤、心室功能障碍、血流动力学改变等[10]。人们将脓毒症并发心血管功能障碍称为脓毒症心肌病。在ICU中脓毒症心肌病患者死亡率较单纯脓毒症患者高[11],因此是否合并脓毒症心肌病是决定脓毒症患者转归的重要因素。脓毒症心肌病的发病机制中,“细胞因子风暴”与“交感风暴”是主要致病因素。
当感染发生时,机体会产生大量促炎因子(TNF-α、IL-1β、IL-6等),脂质介质(白三烯、前列腺素等)等。其中促炎因子募集白细胞聚集,清除病原体。同时抗菌物质与炎症因子协同作用,使得氧化应激反应产生大量的氧类物质,造成大面积组织或器官损伤,炎症反应迅速扩大,这就是所谓的“细胞因子风暴”[11-12]。本研究结果显示:脓毒症时,模型组大鼠在药物干预后3、6、12 h时血浆中TNF-α水平明显高于空白对照组,说明脓毒症时促炎反应被激发。
无论在模型组还是干预组,随着时间推移,TNF-α水平呈逐步上升趋势,这预示机体炎症反应的加重,炎症因子损害心肌细胞,心功能损伤加重。相关文献已经探讨了TNF-α引起心肌损伤的原因,发现脓毒血症中TNF-α与其受体结合,使小鼠心肌收缩力减弱[13],TNF-α对心脏的负性肌力作用,可能部分与其使肌浆网Ca2+-ATP酶活性下降有关[14]。研究发现引起心功能损伤的原因还有:TNF-α可以影响机体钙稳态,造成心功能障碍和心肌细胞死亡[15]。
本实验结果显示,在干预组的3个亚组(T1、T2、T3)中,药物干预后3、6、12 h大鼠血浆中TNF-α水平的变化,随着艾司洛尔的剂量增加,血浆中TNF-α下降明显,提示艾司洛尔可以降低脓毒症心肌病大鼠血浆中TNF-α水平,从而保护大鼠的心脏功能,改善预后。
脓毒症发生后,大量炎症因子不断释放,使得抑炎蛋白IL-10开始生成、释放,使得炎症反应减轻,从而引起免疫抑制和低炎症反应时间延长[16]。在本研究中,也发现相似的结果:药物干预后3、6、12 h,L组大鼠血浆中IL-10水平明显高于K组(P<0.05),提示脓毒症造模成功后,在促炎反应的同时抑炎反应亦被激发,IL-10的血清学水平增高,而在干预组的3个亚组(T1、T2、T3)中,随着艾司洛尔的剂量增加,血浆中IL-10水平变化不明显。其原因可能与艾司洛尔没有抑制抑炎反应的生物学效应有关。脓毒症时,机体发挥自身的调节机制,努力使得促炎与抑炎反应之间达到动态平衡,一旦这一平衡被打乱,最终患者的预后都会很差,如抑炎反应增强,抗炎作用减弱,机体免疫低下,病原菌清除能力减弱[17],最终患者死于重症感染。
“交感风暴”是指脓毒症包括脓毒症心肌病的患者,机体因为严重感染,而处于应激状态,交感神经极度兴奋,释放大量儿茶酚胺[18]。过高的肾上腺素作用在心脏,引起“正性肌力”作用,心肌收缩力加强,心率加快,心脏耗氧量增加,氧供需失衡;同时释放大量儿茶酚胺,使α和β肾上腺素能受体持续激动,有研究表明,激活α和β肾上腺素能受体可以增加促炎因子的生成,并抑制抗炎因子的生成,导致心肌细胞抑制,线粒体功能障碍,心肌细胞凋亡[19]。Suzuki等[20]、Hagiwara等[21]和Ackland等[22]分别使用艾司洛尔、兰地洛尔和美托洛尔,共同发现在脓毒症大鼠中使用了选择性β1-受体阻滞剂后,心率明显减慢,TNF-α和IL-6水平明显降低,本实验结果与此相符。选择性β1受体阻滞剂可以降低TNF-α,且TNF-α降低幅度与选择性β1受体阻滞剂剂量大小呈正相关性,表明应用选择性β1受体阻滞剂可以改善脓毒症心肌病的心脏功能。
综上所述,在脓毒症心肌病的治疗中,因选择β1受体阻滞剂(艾司洛尔)能抑制炎症介质的产生,降低心率,降低心肌细胞的氧耗,抑制心肌细胞凋亡,从而发挥心脏保护功能,改善预后,故对于脓毒症心肌病患者的治疗,应采取保证机体循环稳定的前提下,早期、足量给予β1受体阻滞剂的治疗策略。
