黄精多糖对大强度运动后人体外周血淋巴细胞凋亡的影响
2018-09-28王文迪许苏旸苏全生
付 玉,王文迪,许苏旸,苏全生
大强度急性运动可引起动物、人体出现淋巴细胞凋亡[1]。细胞凋亡是一种生理性细胞程序化死亡,通常对机体有积极影响。在剧烈运动时,机体内自由基水平会随着运动强度增大而增加,易诱发运动性疲劳,出现免疫力及运动能力下降。
黄精(polygonatum sibiricum Red)是我国中医传统常用药物之一[2]。黄精多糖为黄精的主要生物活性成分,具有增强免疫力、延缓衰老、调血脂、抗缺氧性细胞坏死和抗菌等作用[3]。然而,目前在运动领域涉及黄精多糖的相关研究较少,且极少见人体实验报道。因此,本实验拟通过观察黄精多糖对一次大强度运动前后被试外周血淋巴细胞凋亡率及凋亡相关因子凋亡相关蛋白B淋巴细胞瘤-2 (B-cell lymphoma-2, Bcl-2)、Bcl-2相关X蛋白Bax (Bcl-2 Associated X Protein)、凋亡相关因子(Fas)、凋亡相关因子配体(FasL)的变化,探讨其对大强度运动后淋巴细胞凋亡的影响,并分析其作用机制,为黄精多糖有效合理利用理论支持。
1 材料与方法
1.1 实验对象
于成都体育学院招募健康状况良好、无系统专业运动训练经历、无吸烟史的男性大学生作为被试,并要求其在实验期间避免服用任何药物和进行剧烈运动。受试者签署知情同意书后纳入实验。
1.2 实验分组及处理因素
将14名被试随机分为对照组(A组)和实验组(B组)。基本情况见表1。
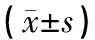
表1 两组被试基本情况
黄精多糖肠溶胶囊(90%纯度,陕西慈缘生物技术有限公司)。实验组1 g/d剂量口服黄精多糖(实验剂量以《中华人民共和国药典》为参考依据计算得出[4]),对照组口服同等剂量的安慰剂(填充糊精的胶囊),连续4周。
1.3 一次大强度运动[5]
适应性运动:受试者在坡度为0°的跑台上以5 km/h速度运动5 min后休息3 min。
正式运动:维持跑台坡度为0°,运动全程监控受试者心率,运动时间及距离。将5 km/h作为运动起始速度,以后每3 min速度增加2 km/h,提速同时测量受试者RPE等级,直至速度达到15 km/h或受试者心率达170 /min不再增加,保持该运动强度至力竭(大汗,呼吸困难,动作出现明显不协调,心率保持180 次/min以上,运动强度自觉量表RPE达19~20,反复鼓励仍不能坚持)即终止。
1.4 测试样本采集
分别于运动前与运动后即刻于肘正中静脉抽取受试者血液样本5 mL,接入肝素抗凝管。
1.5 指标检测与方法
1.5.1 仪器与试剂
BD公司的流式细胞分析仪(CoulterEPICS ELITE ESP),Fas-PE、FasL-PE试剂,南京凯基生物科技发展有限公司Annexin-V-FITC/PI双染法细胞凋亡检测试剂盒,北京博奥森生物技术有限公司Anti-bcl-2/FITC、Anti-bax/FITC试剂。
1.5.2 淋巴细胞凋亡率与Fas、FasL测定
淋巴细胞悬液制备:①将装于肝素抗凝管内的5 ml血液样本取4 ml肝素钠抗凝血,通过4 ml Hank’s液(pH 7.2~7.6)稀释1倍;②将8 ml淋巴细胞分离液预先置于另一20 ml无菌离心管内,毛细吸管取稀释血液,分离液面上1 cm处,沿管壁徐缓加入,使稀释血液在分离液面上形成清晰界面,1 000 r/min离心10 min;③离心后,用毛细吸管轻轻将呈白色云雾状的集中于血浆层和分离液层间的淋巴细胞吸出,移进另一无菌EP管内,1 000 r/min离心10 min,弃上清,RPMI1640洗涤2次,每次1 500 r/min离心10min,弃上清;④RPMI1640(含5%小牛血清)重悬沉淀,调制成1-2×106个/ml淋巴细胞悬液待用。
淋巴细胞凋亡率:加入Annexin V-FITC 5 μL 标记,再加入 Propidium Iodide(PI)5μL 标记,混匀,进行避光反应10 min(室温条件下),加入400 μL Binding Buffer液,并使用流式细胞仪检测。
Fas、FasL:将20 μL 1:50稀释的Fas-PE、FasL-PE荧光标记抗体加入淋巴细胞悬液中,进行遮光30 min反应,流式细胞术分析每管样本10 000个细胞中Fas、FasL蛋白表达率。
1.5.3 Bcl-2、Bax测定
淋巴细胞分离后,1 000 rpm/min离心10 min,PBS洗涤2次,加入2%多聚甲醛固定40 min,之后以相同转速再离心5 min,弃上清,PBS洗涤一次,加入破膜剂后再离心5 min,弃上清,PBS重悬细胞,加入20 μL 1:50稀释的Anti-bcl-2/FITC、Anti-bax/FITC荧光标记抗体,遮光30 min反应,用流式细胞仪分析每管样本10 000个细胞中Bcl-2、Bax蛋白表达率。
1.6 数据统计与处理
使用SPSS 17.0软件对组间数据进行分析,数据以“均数±标准差”表示。采用独立样本和配对样本T检验法。P<0.05为差异有统计学意义。
2 结果
2.1 2组被试运动距离、运动时间、最大心率比较
如表2所示,两组被试运动距离、运动时间及最大心率比较无显著性差异。

表2 两组被试运动距离、运动时间、最大心率比较
2.2 细胞凋亡率比较
如表3所示,两组淋巴细胞凋亡率在运动前组间差异无统计学意义。与运动前相比,两组凋亡率在运动后即刻均显著升高(P<0.01),但B组凋亡率升高幅度明显低于A组(P<0.05)。

表3 两组运动前后淋巴细胞凋亡率变化情况
注:与运动前相比,▲,P<0.01;与A组相比,◆,P<0.05。

图1两组运动前后细胞凋亡率表达
Figure1ExpressionoflymphocyteapoptosisinGroupAandB
2.3 Bcl-2、Bax、Bcl-2/Bax比较
如表4所示,运动前两组间Bcl-2、Bax、Bcl-2/Bax表达均无统计学意义。运动后即刻,两组Bcl-2表达、Bcl-2/Bax比值显著降低(P<0.01),但B组Bcl-2/Bax降低幅度明显低于A组(P<0.05),Bax表达显著增加(P<0.01);此外,与A组相比,B组Bcl-2、Bax水平虽无明显差异(P>0.05),但Bax水平有降低趋势,Bcl-2水平有升高趋势。

图2两组运动前后Bax表达
Figure2ExpressionofBaxinGroupAandBbeforeandafterthetraining

图3两组运动前后Bcl-2表达
Figure3ExpressionofBcl-2inGroupAandBbeforeandafterthetraining
2.4 Fas、FasL比较
如表5显示,运动前两组间Fas、FasL表达均无统计学意义(P>0.05)。运动后即刻,两组Fas表达较运动前均显著升高(P<0.01),但B组升高幅度明显低于A组(P<0.05),而FasL水平变化较运动前并不显著(P>0.05);此外,与A组相比,B组FasL水平虽无明显差异(P>0.05),但FasL水平有降低趋势。

图4两组运动前后Fas表达
Figure4ExpressionofFasinGroupAandBbeforeandafterthetraining
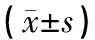
表4 两组运动前后Bcl-2、Bax、Bcl-2/Bax变化情况
注:与运动前相比,▲P<0.01; 与运动后A组相比 ,◆P<0.05
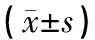
表5 两组运动前后Fas、FasL变化情况
注:与运动前相比,▲P<0.01;与运动后A组相比 ,◆P<0.05

图5两组运动前后FasL表达
Figure5ExpressionofFasLinGroupAandBbeforeandafterthetraining
3 分析与讨论
3.1 一次大强度运动诱导人体外周血淋巴细胞凋亡
细胞凋亡亦称程序性细胞死亡,区别于细胞坏死,细胞凋亡是一种主动过程,通常对机体有积极影响,但大强度运动易导致机体出现程度不一的损伤,并和细胞损伤以及机体运动性疲劳紧密相关[6]。有动物研究表明[7],无论2次力竭、1次力竭、还是中等强度训练,Wistar大鼠胸腺细胞DNA均呈现梯带电泳这一典型的凋亡特点,丁海丽报道了一次性大负荷游泳后大鼠心肌细胞凋亡率较安静时显著升高[8]。汤静[9]报道了普通大学生完成一次大强度运动后即刻淋巴细胞凋亡率显著升高。本实验对受试者连续给药4周后进行一次大强度递增跑台运动干预,结果显示,与运动前相比,安慰剂组与黄精多糖组运动后即刻凋亡百分比均显著增加(P<0.01),与前人研究结果一致,这一结果也就佐证了本研究关于30 min大强度运动显著诱导凋亡相关蛋白Bax、Fas上调;Bcl-2下调这一实验结果。但黄精多糖组凋亡率明显小于安慰剂组(P<0.05),提示黄精多糖可明显抑制大强度运动导致的细胞凋亡。
3.2 黄精多糖对大强度运动后Bcl-2、Bax的影响
Bcl-2是调节凋亡的基因家族的基本成员之一,其家族成员根据结构和功能分为两类:一是抑制凋亡的蛋白,如Bcl-2、Bcl-xl等;二是促进凋亡的蛋白,包括Bax、Bcl-xs、Bak、Bid、Bad和Bim等,而Bcl-2和Bax是其中最为重要的成员[10,11]。研究显示,抗凋亡类蛋白与促凋亡蛋白通过形成同源或异源二聚体调节细胞凋亡,若形成异源二聚体则实现抑制细胞凋亡的目的,有研究认为细胞是否发生凋亡在相当程度上是抗凋亡蛋白与促凋亡蛋白的相对表达水平决定的,若Bcl-2和Bax二者比值升高则促进细胞存活,反之则促进细胞凋亡[12-13]。另有研究报道,急性力竭运动后大鼠心肌细胞Bax表达增加,Bcl-2表达减少,Bcl-2/Bax比值降低[14]。Park等[15]发现12名受试者在急性离心运动后即刻白细胞凋亡率显著升高,而运动后2 h、24 h、48 h凋亡率逐渐降低,但较运动前仍处于较高水平;另外,白细胞Bcl-2蛋白表达无明显减少,而Bax蛋白表达和Bax/Bcl-2比值均显著升高。李艳[16]研究了急性力竭运动后即刻小鼠肾细胞Bax、Bax/Bcl-2明显增加,而Bcl-2无明显降低。李园等[17]等报道了一次大负荷运动后即刻大鼠脾细胞Bax显著升高,Bcl-2/Bax显著降低。本研究结果显示,与运动前相比,安慰剂组与黄精多糖组运动后即刻Bcl-2、 Bcl-2/Bax显著降低(P<0.01),Bax蛋白表达显著增加(P<0.01)。这与之前大多数研究结果一致。此外运动后即刻黄精多糖组较安慰剂组Bax表达水平下降,Bcl-2水平升高,表明黄精多糖能促进Bcl-2蛋白表达,并抑制Bax表达,从而减少凋亡的发生。本研究结果提示黄精多糖调节Bcl-2和Bax蛋白之间的比例可能是其减少凋亡以保护机体的机制之一。
3.3 黄精多糖对大强度运动后Fas、FasL的影响
细胞凋亡相关蛋白Fas和FasL均属于神经生长因子和肿瘤坏死因子家族成员[18]。目前已证实,Fas作为死亡受体,其与配体FasL相结合是Fas在体内发挥作用的唯一途径,二者结合后向表达Fas的细胞内传递死亡信号,从而诱发细胞凋亡,因此Fas/FasL系统是细胞凋亡的主要途径之一[19-20]。研究发现[21],一次性大负荷运动后SD大鼠腓肠肌Fas表达较运动前显著增加,且安慰剂组增加幅度明显高于用药组(P<0.05)。钱帅伟等人的研究显示[22],急性跑台运动使小鼠骨骼肌Fas/FasL基因表达水平在90 min时显著增加。Walhin等[23]选取了26名经常锻炼的男性受试者,随机分为非运动超量消耗组和运动超量消耗组,结果发现运动超量消耗组的Fas表达显著升高。耿潇等[24]报道了一次性大负荷运动后大鼠心肌细胞Fas蛋白显著增高。本实验结果与以上文献报道基本一致,一次大强度运动能够诱导Fas表达水平升高,本研究结果显示,与运动前相比,两组在运动后即刻Fas蛋白表达均显著增加(P<0.01),但黄精多糖组增加幅度明显低于安慰剂组(P<0.05),而FasL水平无明显变化(P>0.05);此外,在运动后即刻,两组FasL水平虽无显著性差异(P>0.05),但黄静多糖组Fas水平仍表现出降低的趋势,提示黄精多糖可能主要通过调控Fas蛋白的表达从而保护机体,抑制淋巴细胞凋亡。
3.4 黄静多糖抑制细胞凋亡的可能机制
细胞凋亡是由系列酶参与、由基因调控的一个主动的高度有序的死亡过程。目前,引起细胞凋亡有3条途径介导:线粒体、死亡受体和内质网途径,前两种为引起细胞凋亡的主要途径,线粒体途径中,Bcl-2与其家族成员共同形成一个极其复杂的互相作用的网络,家族成员之间可形成同源或异源二聚体,从而调控细胞凋亡,其中Bax和Bcl-2是最重要的代表[25]。死亡受体通路也称外源性凋亡通路,Fas、FasL为该途径中的重要蛋白,两者相互识别、结合,可启动细胞凋亡信号的转导,使靶细胞发生程序性死亡,从而引起细胞凋亡[26]。实验结果如图2、3、4、5显示,运动后即刻,黄精多糖组Bcl-2/Bax水平降低幅度明显低于安慰剂组,Fas表达水平增加幅度明显低于安慰剂组,两组组间Bax、Bcl-2、FasL虽无统计学意义,但黄精多糖组在运动后分别表现出水平降低、升高、降低的趋势。说明黄精多糖可能通过影响凋亡相关蛋白的表达抑制淋巴细胞凋亡,由于Bax 和 Bcl-2为细胞凋亡线粒体途径的重要蛋白,Fas和FasL为细胞凋亡死亡受体途径的重要蛋白,分析实验结果可以推测黄精多糖可能是通过介导线粒体途径和死亡受体途径抑制细胞凋亡。
4 结论
黄精多糖可有效抑制大强度运动所致人体外周血淋巴细胞凋亡,其机制可能与黄精多糖通过内外源2条途径调控凋亡相关蛋白Bcl-2、Bax、Fas、FasL表达水平有关。
