谷胱甘肽合成酶StGCS-GS对甜菜遗传转化的研究
2018-09-19刘大丽马龙彪
刘大丽 ,马龙彪
(1.黑龙江省高等学校甜菜遗传育种重点实验室/黑龙江大学农作物研究院,哈尔滨150080;2.中国农业科学院北方糖料作物资源与利用重点实验室/中国农业科学院甜菜研究所,哈尔滨150080)
甜菜是我国主要的产糖作物,我国的甜菜大部分种植在没有灌溉条件的旱地上,依靠自然降水维持甜菜生长。近几年来,由于甜菜生长长期受春季干旱、夏秋高温等严重天气的影响,其产量及含糖都会受到一定的损失[1-2]。干旱严重地制约了甜菜的生产水平和发展,为此,如何改良甜菜的抗旱特性已成为目前倍受国内外专家关注的研究内容[3-5]。传统的常规抗旱育种由于受到时间以及种质资源等因素的限制,很难筛选出具有较优良抗旱特性的甜菜品种[6]。然而,随着抗旱分子机制研究的不断深入,人们通过挖掘一系列与抗旱胁迫相关的功能基因,利用转基因技术将与抗旱胁迫相关的关键酶转化到植物体内[7],为培育高效抗旱、抗高温的甜菜新品种开创了一条崭新的途径。
谷胱甘肽(Glutathione,GSH)通过谷胱甘肽-抗坏血酸还原系统清除ROS,是植物体内抗氧化耐旱机制之一,并被广泛应用到植物的抗干旱分子育种中。GSH的生物合成经历两个ATP参与的反应步骤:在γ-GCS(EC6.3.2.2)和GS(EC6.3.2.3)酶编码基因先后调控着植物体内GSH的合成,进而调控着植物体内GSH抗氧化耐旱性[8]。而在革兰氏阳性菌中,存在着一类新型的具有双重功能的谷胱甘肽合成酶StGCS-GS(γglutamylcysteine ligase-glutathione synthetase)。研究表明,该酶既不受氧化还原调控,又对GSH的反馈抑制不敏感,这与以往被报道的谷胱甘肽合成酶作为限速酶受到产物GSH的抑制有了质的不同[9]。
本研究正是综合了以上研究进展以及甜菜分子育种的发展趋势,将嗜热链球菌谷胱甘肽合成酶(StGCSGS)——这种新型非限速酶,通过Gateway系统构建到具有潮霉素抗性的植物表达载体pGWB2上,进而遗传转化到甜菜植株中;通过基因组DNA的PCR鉴定,获得阳性转基因甜菜植株,为下一步甜菜耐干旱胁迫研究奠定基础。
1 材料与方法
1.1 实验材料及培养条件
供试甜菜US-8916,由中国农业科学院甜菜研究所提供。甜菜种子通过0.1%的升汞杀菌8 min,无菌水冲洗后,接种于MS培养基中,2周后获得无菌苗。利用甜菜分化培养基(MS+0.5 mg/L 6-BA)对所得到的无菌苗进行分化再生;利用生根培养基(MS+1.5 mg/L NAA)对甜菜幼芽进行生长和生根培养。
1.2 p ENTR/SD/D-TOPO-StGCS-GS入门载体的构建
根据嗜热链球菌谷胱甘肽合成酶 (StGCS-GS)(Genbank accession no.GQ848551)的碱基序列,以及Gateway植物表达载体系统中其入门载体pENTR/SD/D-TOPO(Invitrogen)的要求,利用Primer primier 5.0设计起始密码子前端带有CACC接头的上下游引物 (5’-CACC ATG ACA TTA AAC CAA CTG CTT-3’;5’-TTA AGT TTG ACC AGC CAC TAT TTC T-3’)。
以实验室保存的pMD 18-T-StGCS-GS[9]为模板,利用Trans Start FastPfu DNA Polymerase(Trans Gen)高保真 Taq 酶扩增目的基因。 反应条件为:95℃(2 min);95°C(20 s),52℃(20 s),72℃(2 min),30 个循环;72℃培育5 min。
按照摩尔比1∶1,将胶回收目的片段连接到载体pENTR/SD/D-TOPO上。通过PCR及BamHI酶切鉴定阳性入门重组质粒,产物于1%Agarose凝胶电泳,并利用GeneSnap 6.08(f)来进行检测。
1.3 pGWB2-StGCS-GS植物表达载体构建
利用限制性内切酶XhoI对植物表达载体pGWB2进行线性酶切;将100 ng Entry clone(pENTR/SD/DTOPO-StGCS-GS)和 150 ng Destination clone(pGWB2)进行 LR反应,连接产物转化到Trans DH5α(Trans Gen)感受态细胞中,经过PCR及HindIII酶切鉴定的Kana抗性克隆pGWB2-StGCS-GS被转化到农杆菌EHA105中,备用。
1.4 甜菜遗传转化
以甜菜无菌苗的叶柄为转基因的外植体,接种于MS+0.5 mg/L 6-BA中2 d;分别用浓度为OD600=0.4、0.6、0.8的pGWB2-StGCS-GS农杆菌EHA105侵染甜菜叶柄外植体,侵染时间为5 min、10 min、15 min;将侵染后的甜菜外植体叶柄置于含有100μmol/L AS和0.5 mg/L 6-BA的MS培养基中,暗培养2 d、4 d、6 d;然后转入到筛选培养基(MS+0.5 mg/L 6-BA+50 mg/L Hygromycin)中进行抗性芽的分化和筛选。
1.5 甜菜基因组DNA的提取及转基因甜菜的分子鉴定
利用CTAB法提取甜菜基因组DNA。以未转基因甜菜为对照,PCR扩增StGCS-GS基因,同1.2。取20 μL PCR产物,于1.2%的琼脂糖凝胶上进行电泳,并利用GeneSnap 6.08(f)进行检测。
2 结果与分析
2.1 入门载体pENTR/SD/D-TOPO-StGCS-GS的构建
根据Gateway克隆系统中TOPO entry clone对于目的基因的要求,以及Streptococcus thermophilus StGCS-GS基因的序列信息,设计上游引物前端带有CACC的碱基序列。通过高保真Taq酶扩增带有平末端的基因片段,获得了2.26 kb的目的片段(图1)。
将定量为50 ng/μL的StGCS-GS PCR扩增片段,与TOPO入门载体pENTR/SD/D-TOPO按照1∶1的摩尔比例进行连接,并转化到大肠杆菌感受态细胞中。如图2A所示,通过提取重组大肠杆菌质粒DNA,并以其为模板进行PCR扩增,在pENTR/SD/D-TOPO-StGCS-GS待测质粒中得到了预期大小——2.26 kb的片段。BamHI限制性内切酶酶切鉴定结果显示,在4.86 kb左右的位置获得了单一条带(图2B)。由于pENTR/SD/D-TOPO载体本身大小为2.5 kb左右,而BamHI在StGCS-GS基因内部有单一酶切位点,在TOPO载体上没有酶切位点,所以酶切后会获得单一目的条带。因而,酶切结果进一步证明了重组质粒pENTR/SD/D-TOPOStGCS-GS的正确性。
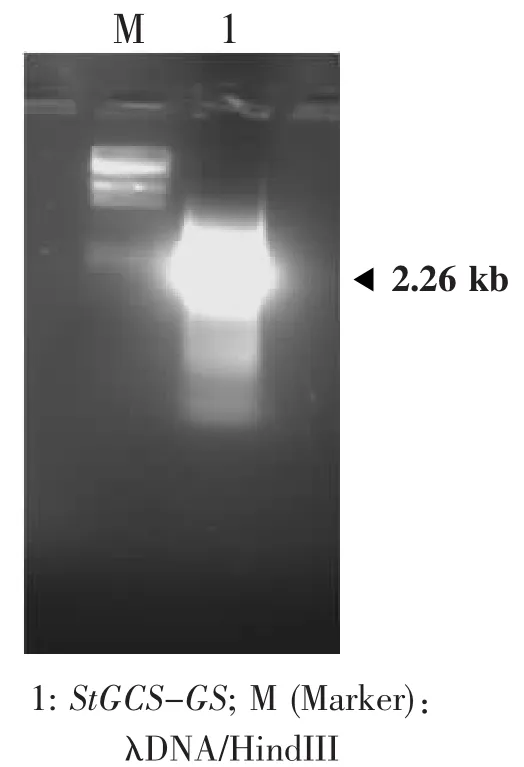
图1 带CACC接头的嗜热链球菌StGCS-GS的PCR扩增Fig.1 PCR amplification of Streptococcus thermophilus StGCS-GS with CACC tag

图2 p ENTR/SD/D-TOPO-StGCS-GS重组质粒鉴定Fig.2 Identification of recombinant plasmids of pENTR/SD/D-TOPO-StGCS-GS
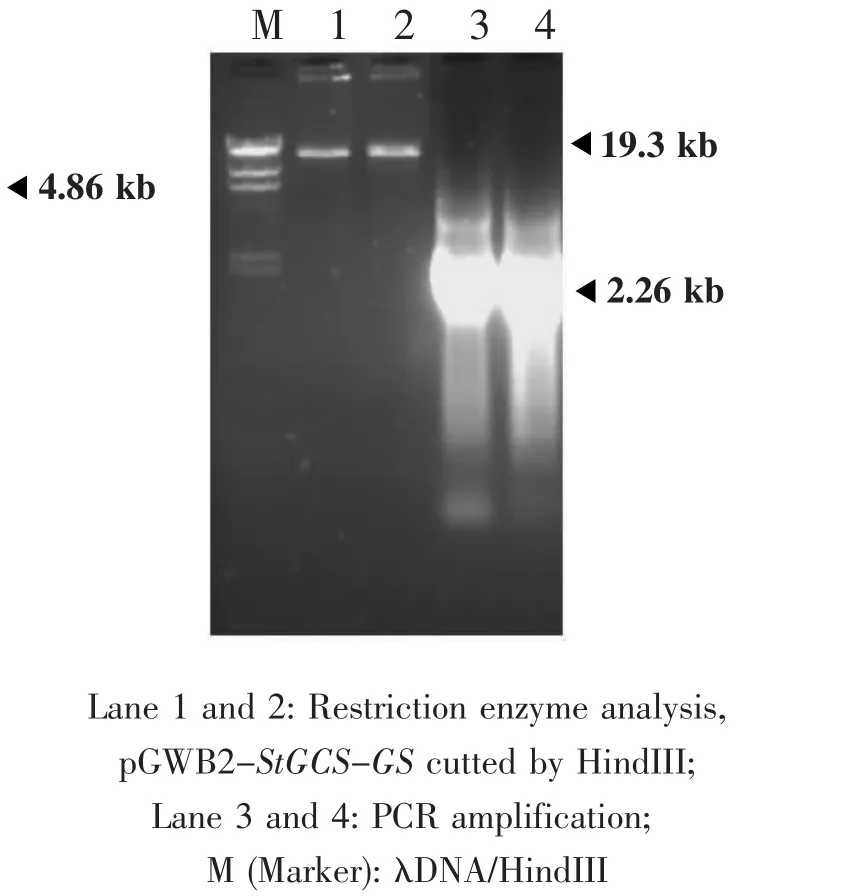
图3 pGWB2-StGCS-GS重组质粒鉴定Fig.3 Identification of recombinant plasmids of pGWB2-StGCS-GS
2.2 pGWB2-StGCS-GS植物表达载体的构建
将100 ng pENTR/SD/D-TOPO-StGCS-GS入门载体与150 ng pGWB2线性化植物表达载体分别进行LR反应。研究结果显示,PCR扩增阳性重组质粒在预期大小的位置获得了目的条带——2.26 kb。利用限制性内切酶HindIII酶切pGWB2-StGCS-GS,在19.3 kb左右的位置获得了单一条带。由于在pGWB2体内,HindIII是单一的酶切位点,并且在StGCS-GS基因内部没有HindIII酶切位点,因而所获得的片段长度应该是载体(17 kb)和目的基因片段的总长。所得结果与预期一致,表明实验正确构建了植物表达载体pGWB2-StGCSGS(图 3)。
利用电击法,将重组的植物表达载体pGWB2-StGCS-GS分别转化到农杆菌EHA105中。
2.3 StGCS-GS基因对甜菜的遗传转化
甜菜种子经过升汞消毒处理后,培养于MS培养基中,一周后,种子萌发出幼芽(图4A);经过分化、生根获得的甜菜组培苗叶柄段,被用于甜菜转基因研究(图4B~D)。
通过农杆菌介导的甜菜叶柄转化操作,将StGCS-GS遗传转化到甜菜体内。研究结果表明,当农杆菌侵染浓度OD600值为0.6,侵染时间10 min,共培养4 d后,甜菜叶柄外植体经过农杆菌侵染,在筛选培养基上所获得的抗性芽(图4E)比率相对最高;而侵染浓度和时间过高或过长,都会由于农杆菌生长频率较快而导致甜菜叶柄死亡。所获得的具有Hygromycin抗性的抗性芽,通过诱导分化和生根,获得了抗性植株(图4F)。

图4 甜菜再生体系建立及StGCS-GS基因转化过程Fig.4 Regeneration of Beta vulgaris and genetic transformation of StGCS-GS
2.4 转基因StGCS-GS甜菜植株的分子鉴定
CTAB法提取8个具有Hygromycin抗性的转基因甜菜基因组DNA,如图5所示,在对照甜菜植株体内,未检测到StGCS-GS基因的表达;而在转基因甜菜株系中,分别不同程度地检测到StGCS-GS基因的大量表达;其中,St3、St5和St7转基因株系的StGCS-GS基因表达量相对较大;St8呈假阳性。这些结果表明,在转基因甜菜植株体内,35S启动子可以大量地正确表达StGCSGS基因,并且由于该基因在甜菜基因组内的整合位点不同,所以表达量也有所不同。
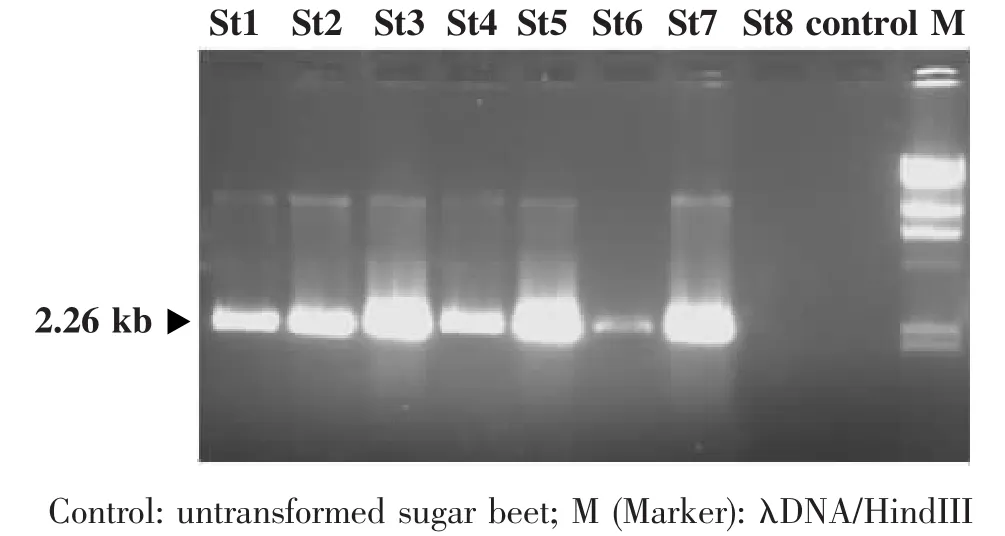
图5 StGCS-GS转基因甜菜植株基因组的PCR鉴定Fig.5 Detection of StGCS-GS in transgenic Beta vulgaris genome by PCR
3 讨论
甜菜转基因方面的研究已经取得了一定的进展,但大多数研究主要集中在抵御病害或提高甜菜含糖率等方面[10];而对于如何利用转基因技术提高甜菜抗旱特性的研究鲜有报道。本研究应用Gateway基因克隆系统,把目的基因StGCS-GS克隆到入门载体(Entry vector)——pENTR/SD/D-TOPO上,该载体的最大特点是不用依赖于限制性内切酶,而靠载体自身存在的特定重组位点和重组酶,高效、快速地将目的基因克隆到植物表达载体(Destination vector)——pGWB2上。同时,由于甜菜本身对Kana中度敏感,所以选择具有潮霉素抗性的植物表达载体可避免由于假阳性所带来的麻烦。
嗜热链球菌非限速谷胱甘肽合成酶StGCS-GS的独特之处在于它可以不受任何因素 (包括底物在内)的影响而高效地催化植物体内GSH的合成,以清除由于干旱逆境胁迫所导致的有害活性氧物质的毒害。本研究通过分子生物学手段鉴定获得稳定、高效表达该基因的转基因株系。由于目的基因在甜菜基因组内的整合位置和拷贝数等的不同,其表达量也存在一定差异。试验结果也为下一步甜菜抗旱逆境胁迫的研究,获得具有优良抗旱特性的甜菜品种奠定了基础。
