丛枝菌根真菌对NaCl胁迫下紫花苜蓿的生理指标 及光合参数的影响
2018-09-18张永志高文俊郭艳妮郝鲜俊
张永志,高文俊,郭艳妮,郝鲜俊
(山西农业大学 动物科技学院,山西 太谷 030801)
盐渍化土壤是世界大面积存在的土壤类型,也是我国分布较为广泛的土系之一。联合国教科文组织调查结果显示,世界约有95.44×107hm2的土壤为盐渍化土壤,而我国就拥有3.67×107hm2的盐渍化土壤。盐渍土由于各类盐含量过高,造成土壤板结、土壤肥力低下、植物生长困难及土壤可利用条件苛刻等问题[1-2]。由于盐渍土在我国覆盖面积较广,地域跨度较大,盐渍化土壤严重制约着我国农业的发展与耕地的使用效率[3]。
对盐渍土施用土壤改良剂是目前土壤改良常用的手段,如利用燃煤烟气脱硫废弃物对土壤进行改良,或者是在土壤改良剂中加入腐殖质和有机肥等原料[4-6],施用土壤改良剂后的土壤磷元素含量增加,植物的生长发育得到优化,土壤养分的储存量也逐步增加[5]。但是利用土壤改良剂进行土壤改良经济消耗较大[6-7],且容易受到地理条件、生态环境和自然气候等因素影响,因而利用微生物的手段进行土壤改良逐渐被研究人员所重视,利用微生物进行土壤改良主要包括硫氧化细菌、放线菌、光合细菌和丛枝菌根真菌(AMF)等。研究表明,AM真菌可与植物联合共生,在植物根际土壤微环境中,通过AM真菌的作用,使宿主植物的耐盐性和抗逆性得到有效提高,促进了宿主植物在贫瘠板结等条件下的生长发育[8]。微生物菌剂的使用可以增加土壤中的速效磷、速效钾以及氮元素的含量,同时还可以降低土壤的pH和NaCl浓度,缓解各类不利因素对植物生长发育的抑制作用[9-10],从而提高土壤的利用价值,创造土壤改良再利用的新方法。
紫花苜蓿(Medicagosativa)是豆科苜蓿属多年生草本植物,又名紫苜蓿、苜蓿。紫花苜蓿中苜一号(Medicagosativacv.Zhongmu No.1)根系生长发育优良,并且根系较为粗大,入土程度较深,吸收营养能力显著[11-12]。通过对紫花苜蓿品种中苜一号接种3种不同的AMF真菌,幼套球囊霉(Glomusetunicatum)、摩西球囊霉(Glomusmosseae)、根内球囊霉(Glomusintraradices),以验证在不同的NaCl浓度条件下,3种AM真菌对中苜一号的影响。通过试验,论证AM真菌对紫花苜蓿的耐盐机制,以及不同的AM真菌对中苜一号在盐胁迫下生长的影响,为盐渍土壤利用及中苜一号的推广提供理论指导和实践验证。
1 材料和方法
1.1 试验材料及处理
AM真菌购买自北京市农林科学院植物营养与资源研究所BGC菌种库,包括幼套球囊霉(Glomusetunicatum,简称Ge) 编号BGC NM03F、摩西球囊霉(Glomusmosseae,简称Gm)编号BGC NM03D、根内球囊霉(Glomusintraradices,简称Gi)编号BGC JX04B。在温室条件下(温度20℃~25℃,相对湿度65%~80%),利用玉米(Zeamays)种子进行菌根真菌扩繁,在玉米生长3个月后,将含有真菌孢子、根外菌丝和真菌侵染根段的土壤作为接种菌剂。
试验所用的苜蓿种子为中国农业科学院畜牧研究所的中苜一号。试验时选取颗粒饱满的种子,置于培养箱中过夜进行催芽处理,将催芽的种子进行播种。基质为土壤和河沙混合物,混合比例为1∶3,在121℃进行蒸汽灭菌。基质层分布为灭菌基质、接种菌剂、灭菌基质,接种菌剂每个盆栽20 g。
1.2 试验设计
试验采用盆栽的方式,在山西农业大学草学实验室进行,苜蓿种子出苗后,进行间苗定株,每个盆栽20株,间苗后生长两周开始进行不同NaCl浓度的胁迫处理。由于较高的NaCl浓度会对植株造成损伤,在进行胁迫时,NaCl浓度采取逐日递增的方式,每日递增50 mmol/L,直至最终试验浓度。试验的NaCl浓度设为0、50、100、150、200 mmol/L 5个梯度,每组4次重复。盐胁迫30 d时,进行光合特性的测定,待苜蓿收获后进行其他相应指标的测定。
1.3 测定内容及方法
1.3.1 菌根侵染率 采用Phillips和Hayman染色法及根段频率法。
1.3.2 光合特性的测定 在盐胁迫处理30 d时,用CI-340光合仪,测定胞间二氧化碳浓度(Ci)、净光合速率(Pn)、气孔导度(Gs)、蒸腾速率(Tr)。测定时间为上午10∶00~12∶00。
1.3.3 生理生化指标的测定 脯氨酸含量测定用Bates等[13]的方法;可溶性糖含量测定采用蒽酮比色法测定;可溶性蛋白含量测定采用考马斯亮蓝G-250染色法测定[14]。
1.4 数据分析
采用SPSS 16.0以及Excel 2007对试验数据进行分析。
2 结果与分析
2.1 不同浓度NaCl胁迫下AM真菌对中苜一号侵染的影响
在不同浓度NaCl胁迫下,3种不同的AM真菌菌种对中苜一号的侵染率不同(图1),随着盐浓度的不断升高,AM真菌对中苜一号的侵染率逐渐降低。Ge在0、50、100、150 mmol/L浓度下,对中苜一号的的侵染率极显著低于Gm和Gi对紫花苜蓿的侵染率(P<0.01),在200 mmol/L浓度下,Ge和Gi对紫花苜蓿的侵染率无显著差异(P>0.05),均显著低于Gm对紫花苜蓿的侵染率(P<0.05),AM真菌对宿主植物的亲和力不同,侵染率可能受到宿主植物的抗胁迫能力和新陈代谢能力的影响。而Gm,Gi和Ge对中苜一号的侵染率变化基本一致,但对同一盐浓度下的紫花苜蓿的侵染率不相同,表明AM真菌与宿主植物之间具有双向选择性。
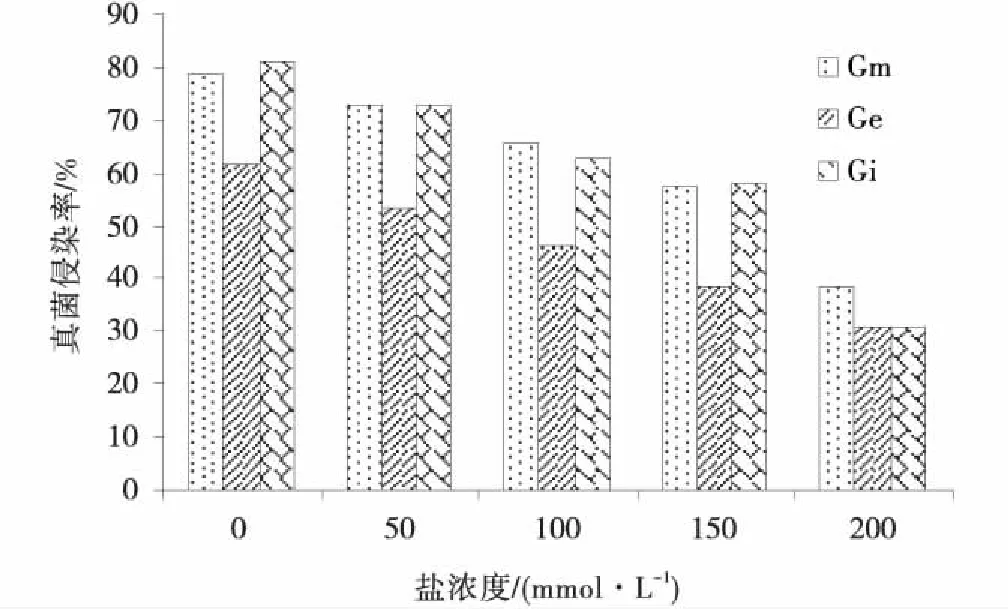
图1 盐胁迫下AMF对紫花苜蓿侵染率的影响Fig.1 Effects of AMF on the infection rate of Medicago sativa under Salt Stress
2.2 不同浓度NaCl胁迫下接种AM真菌对中苜一号生理生长的影响
2.2.1 不同浓度NaCl胁迫下接种AM真菌对中苜一号脯氨酸含量的影响 在不同浓度NaCl胁迫下,中苜一号的地上部分与地下部分的脯氨酸含量均呈现出逐步上升的趋势,且未表现出下降的趋势(表1),在200 mmol/L NaCl处理下,中苜一号的脯氨酸含量达到最高,试验表明中苜一号的渗透调节机制在高浓度的盐处理下仍未失去作用。接种不同AM真菌的中苜一号的脯氨酸在各个浓度的盐处理下均极显著低于未进行接种的空白对照组(P<0.01),表明中苜一号在接种AM真菌后,有效的缓解了盐胁迫对其造成的伤害。接种Gm的中苜一号的脯氨酸含量在0、50、100、150、200 mmol/L NaCl处理下均显著低于接种Ge、Gi的中苜一号的脯氨酸含量(P<0.05),植物的抗逆性越强,植物体内的脯氨酸含量越低,抗逆性越弱,植物体内的脯氨酸含量越高。变化趋势表明,AM真菌虽然有效的缓解了盐胁迫对中苜一号的损伤,提高了中苜一号的抗逆性,但是,由于宿主植物与AM真菌之间的双向选择性,不同的AM真菌对中苜一号的抗逆性影响不同(表1)。
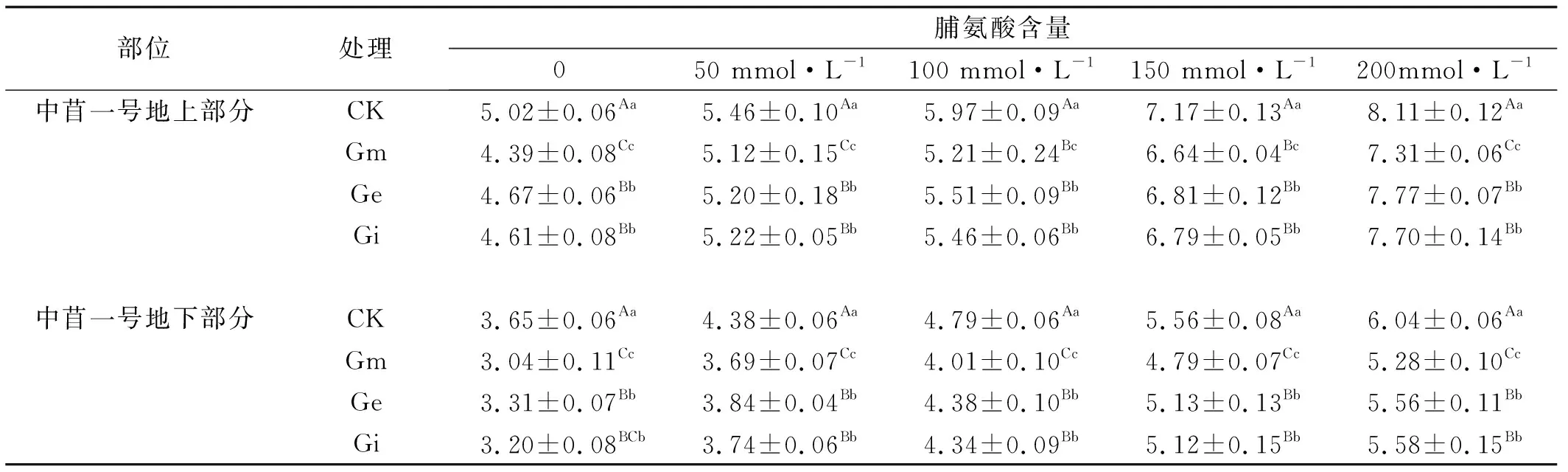
表1 接种AM真菌与NaCl胁迫处理下紫花苜蓿的脯氨酸含量
注:同列不同大写字母表示差异极显著(P<0.01),不同小写字母表示差异显著(P<0.05),下同
2.2.2 不同NaCl浓度下接种AM真菌对中苜一号可溶性蛋白含量的影响 不同浓度的NaCl对中苜一号的可溶性蛋白含量有显著的影响(表2),中苜一号在受到盐胁迫时,接种AM真菌与未接种AM真菌的可溶性蛋白含量在0、50、100、150、200 mmol/L NaCl处理下都呈现出上升的趋势,地上部分的变化与地下部分的变化相一致,且随着NaCl浓度的增加,可溶性蛋白含量不断增加。接种AM真菌的中苜一号的可溶性蛋白含量显著高于未接种AM真菌的中苜一号(P<0.05)。
试验表明在盐胁迫下接种不同AM真菌均能够有效的提高植物的渗透调节能力,增加植物的抗逆性,在一定程度上缓解盐胁迫对植物体造成的损害。接种Gm的中苜一号的可溶性蛋白含量显著高于接种Ge、Gi的植株(P<0.05),而接种Ge、Gi的中苜一号可溶性蛋白含量则差异不显著,表明Gm菌种对中苜一号的作用在各个浓度的盐处理下都要优于Ge和Gi菌种对中苜一号的作用。
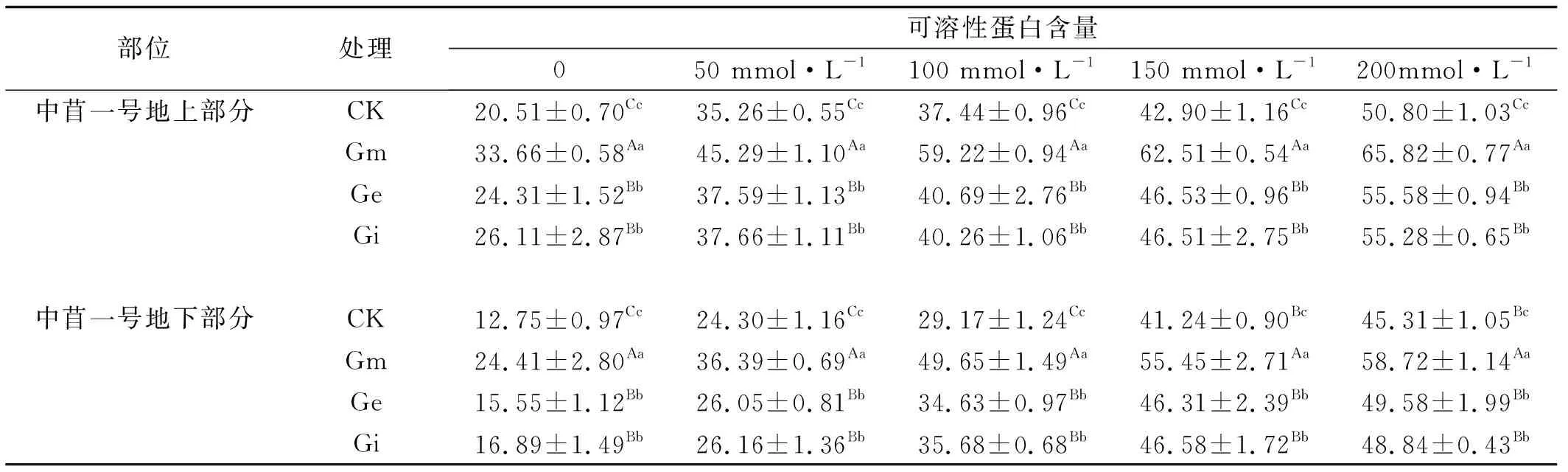
表2 接种AM真菌与NaCl胁迫处理下紫花苜蓿的可溶性蛋白含量
2.2.3 不同NaCl浓度下接种AM真菌对中苜一号可溶性糖含量的影响 随着NaCl浓度的不断增加,接种AM真菌与未接种AM真菌的中苜一号的可溶性糖含量也随之增加(表3),中苜一号地上部分的可溶性糖的变化趋势与地下部分的变化趋势相一致,未接种AM真菌的中苜一号可溶性糖含量在0、50、100、150、200 mmol/L NaCl胁迫处理下显著低于接种AM真菌的中苜一号(P<0.05)。接种Gm的中苜一号可溶性糖的含量要高于接种Ge和Gi的含量,且Gm显著高于Ge和Gi(P<0.05),而Ge和Gi之间差异不显著,3种不同的AMF 菌种都能有效的增加中苜一号的可溶性糖的含量,由于宿主植物与AM真菌之间的选择性导致了接种不同AM真菌后中苜一号可溶性糖含量的差异。
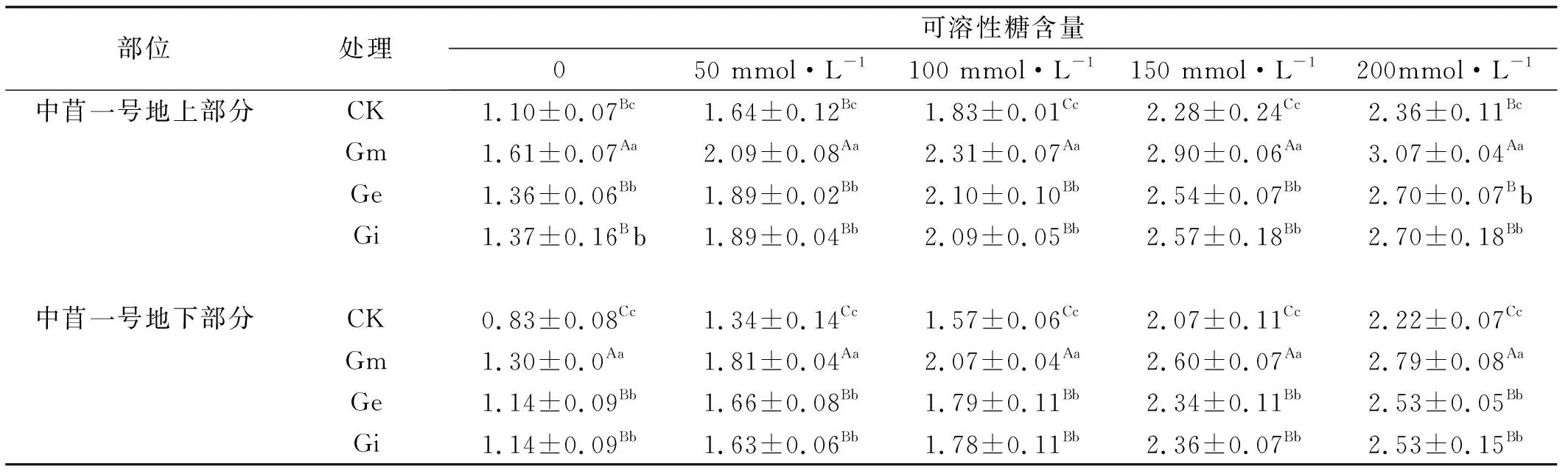
表3 接种AMF与盐胁迫处理下紫花苜蓿的可溶性糖含量
2.3 不同NaCl浓度下接种AM真菌对中苜一号抗氧化系统的影响
2.3.1 不同NaCl浓度下接种AM真菌对中苜一号超氧化物歧化酶(SOD)的影响 植物体在受到盐胁迫时,随着NaCl浓度的不断增加,接种AM真菌与未接种AM真菌的中苜一号SOD活性均呈现出上升的变化趋势(表4),且随着NaCl浓度的增加,SOD活性不断增加,各个盐浓度之间差异显著(P<0.05)。在NaCl胁迫条件下,接种AM真菌的植物SOD活性显著高于未接种的植株。接种Gm的中苜一号SOD活性高于接种Ge和Gi的植株,且差异显著(P<0.05),而Ge和Gi之间差异不显著。中苜一号地下部分的SOD活性的变化与地上部分变化相一致,且地上部分的SOD含量高于地下部分。
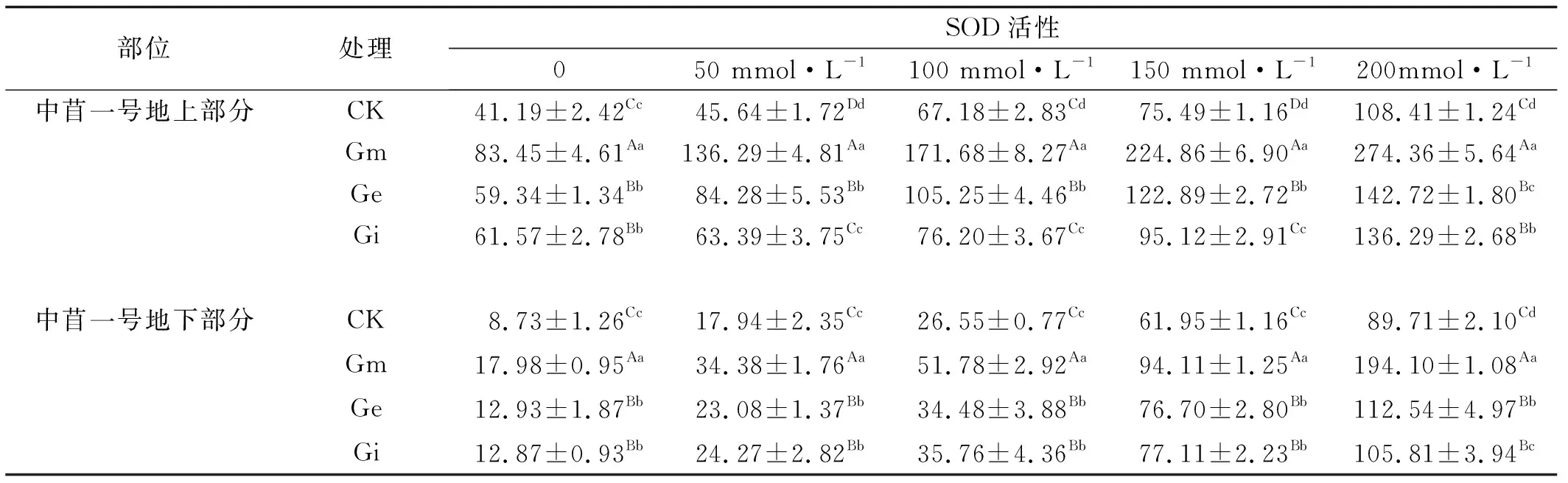
表4 接种AM真菌与NaCl胁迫处理下紫花苜蓿的SOD活性
2.3.2 不同NaCl浓度下接种AM真菌对中苜一号过氧化物酶(POD)的影响 随着NaCl浓度的增加,中苜一号的POD活性在接种AM真菌与未接种AM真菌下都呈现出上升的变化趋势(表5),地下部分与地上部分的变化一致。在NaCl胁迫条件下,接种AM真菌的中苜一号的POD活性显著高于未接种的植株,相同浓度NaCl胁迫下,接种Gm的中苜一号的POD活性显著高于接种Ge和Gi的POD活性(P<0.01),而Ge和Gi之间差异不显著。
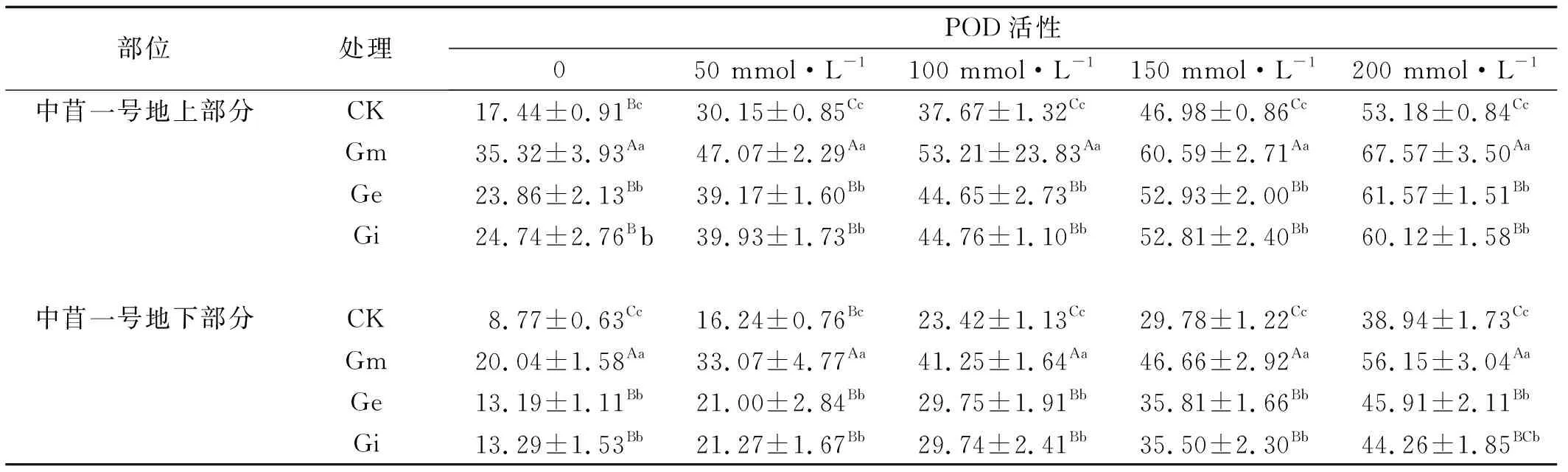
表5 接种AM真菌及NaCl胁迫处理下紫花苜蓿的POD活性
2.3.2 不同NaCl浓度下接种AM真菌对中苜一号丙二醛(MDA)含量的影响 随着NaCl浓度的增加,中苜一号的MDA含量也随着盐浓度的增加而增加(表6),在各个盐浓度处理下,接种AM真菌的紫花苜蓿MDA含量显著低于未接种的植株(P<0.05),相同NaCl浓度胁迫下,接种Gm的植物体内MDA含量显著低于接种Ge、Gi的植株(P<0.05),而Ge和Gi之间差异不显著。地下部分与地上部分变化一致,且地下部分的MDA含量高于地上部分,说明植物在受到盐胁迫时,根部受到的胁迫程度大于地上部分。
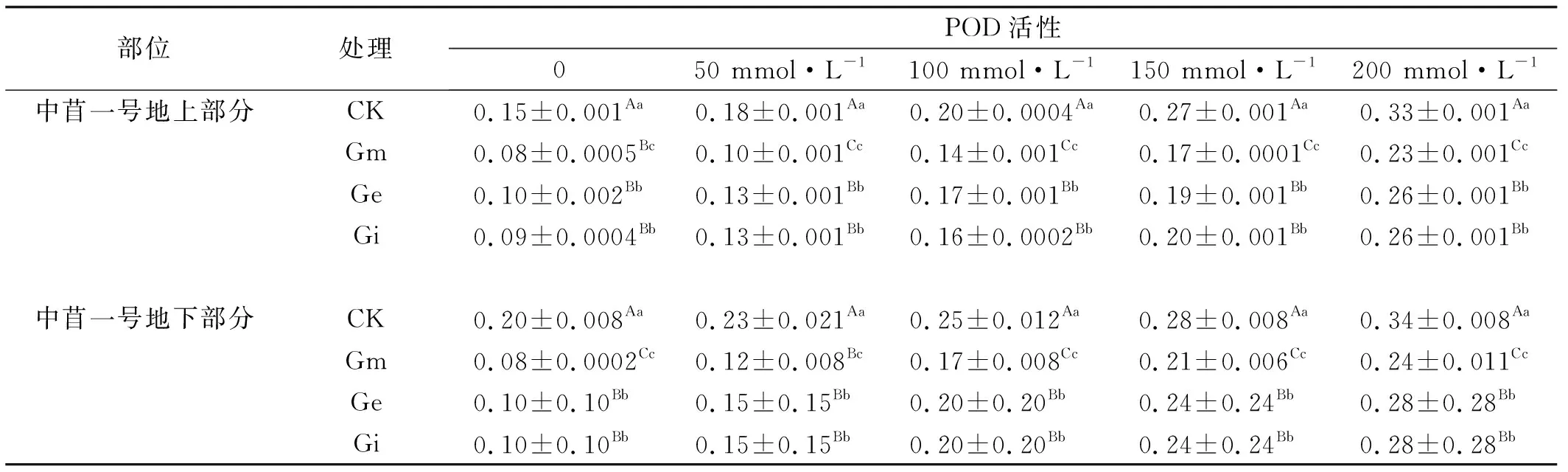
表6 接种AM真菌及盐胁迫处理下紫花苜蓿的MDA含量
2.4 不同NaCl浓度下接种AM真菌对中苜一号光合特性的影响
随着NaCl浓度的升高,中苜一号的光合速率(Pn),蒸腾速率(Tr)和气孔导度(Gs)呈下降趋势,胞间二氧化碳浓度(Ci)呈上升趋势。未接种AM真菌的中苜一号的Pn显著低于接种AM真菌的Pn(P<0.05),接种Gm的Pn显著高于接种Ge和Gi(P<0.05),且Ge和Gi二者之间差异不显著。接种Gm的则在0和50 mmol/L NaCl胁迫下,Pn差异不显著,但在100、150和200 mmol/L的NaCl胁迫下差异显著(P<0.05),接种Gm可以使植物耐受低盐胁迫,降低盐胁迫对植物造成的伤害;接种Ge和Gi以及未接种AM真菌的植物的Pn在各个浓度之间差异显著(P<0.05)。在50 mmol/L处理下,接种Gm,Ge和Gi的中苜一号的Pn分别为14.22,12.95和13.0 μmol/(m2·g),分别小于0 mmol/L处理时的15.24,14.04,14.11 μmol/(m2·g),但是高于未接种AMF的0 mmol/L处理下的12.47 μmol/(m2·g),此变化趋势表明在50 mmol/L NaCl处理下,AM真菌对NaCl的影响大于盐胁迫对植物的影响;当盐浓度增加到在100 mmol/L时,接种Gm,Ge和Gi的Pn分别为12.21,10.86和10.47 μmol/(m2·g),低于未接种AM真菌的12.47 μmol/(m2·g),表明此时的盐浓度对植物的影响大于接种AM真菌对植物的影响,植物在此盐浓度下遭受到盐胁迫的损害。
不同的NaCl浓度下,Tr与Gs的变化规律相同(表7),都是随着NaCl浓度的增加而减弱,同时各个NaCl浓度之间差异显著,接种AM真菌的中苜一号的Tr和Gs显著高于未接种的中苜一号(P<0.05),而接种Gm的显著高于接种Ge和Gi(P<0.05),Ge和Gi之间差异不显著。Ci的含量随着NaCl浓度的增加而增加,且接种AM真菌的中苜一号的Ci含量显著低于未接种AM真菌的中苜一号(P<0.05)。接种不同AMF的中苜一号0和50 mmol/L NaCl处理下,Ci之间差异不显著,与100、150、200 mmol/L则盐处理下差异显著(P<0.05)。
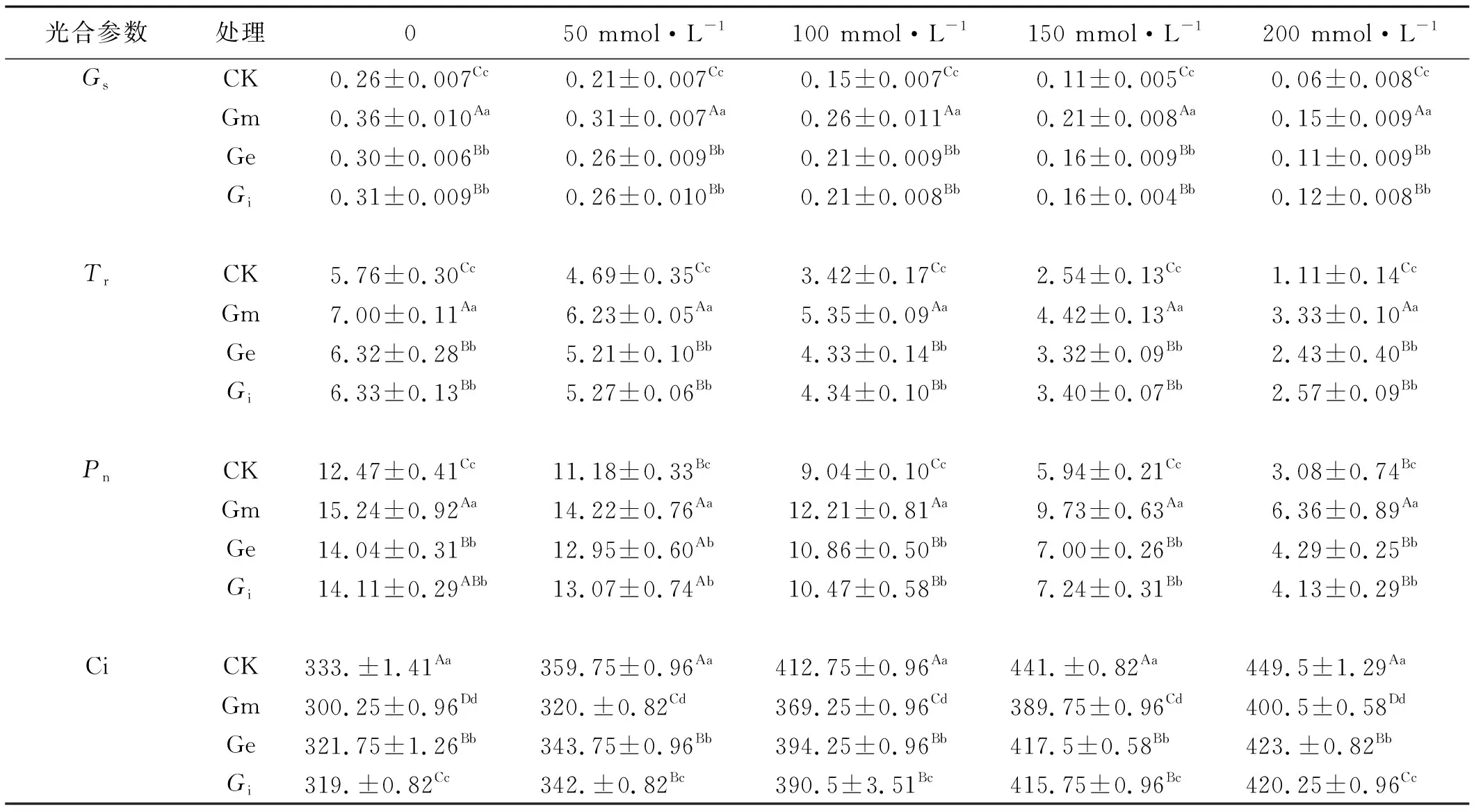
表7 接种AM真菌及NaCl胁迫处理下紫花苜蓿的光合参数
3 讨论
3.1 不同NaCl浓度下AM真菌对中苜一号根系侵染的影响
侵染率是AM真菌与宿主植物亲和力的体现,AM真菌与宿主植物之间存在着双向的选择性,两者之间亲和力较好,则侵染率较高,两者之间亲和力较低,则侵染率较低。从试验结果可以看出,Gm与Gi对紫花苜蓿的侵染率要高于Ge对紫花苜蓿的侵染率,这表明Gm与Gi和紫花苜蓿的亲和力要相对好于Ge对紫花苜蓿的亲和力,通过对比在不同NaCl浓度条件下的AM真菌对紫花苜蓿的侵染率可以看出,侵染率随着NaCl浓度的增加而呈现出下降的趋势,并且各个NaCl浓度之间的侵染率差异显著。研究表明,相对于受到盐胁迫的植株,未受到盐胁迫的植株更容易与AM真菌形成共生体[15],杨海霞等[16]在利用AM真菌对高羊茅进行接种时,亦发现摩西球囊霉能够显著的提高高羊茅的耐盐性。
由于植物受到盐胁迫而导致AM真菌与植物共生体的菌丝分支受到影响[17],丛枝数及泡囊数也相对减少[18],因而AM真菌的侵染能力下降,使得AM真菌对植物抗逆性的影响减弱,植物体受到盐分的伤害程度增加,与张义飞等[19]研究不同浓度盐胁迫下AM真菌对羊草生长的影响结果相一致,AM真菌对牧草的侵染率受到盐胁迫的影响。
3.2 不同NaCl浓度下接种AM真菌对中苜一号渗透调节物质的影响
试验结果发现,中苜一号的渗透调节物质,脯氨酸、可溶性蛋白、可溶性糖含量都随着NaCl浓度的增加而增加,且未呈现出下降的变化趋势。研究表明,植物体内的脯氨酸和可溶性蛋白的含量受到NaCl浓度的影响,NaCl浓度越高,植物体内的脯氨酸和可溶性蛋白含量亦会随之增加[20],当NaCl浓度超过植物所能耐受的最高盐浓度时,由于植物受到盐离子的伤害,其细胞膜结构受到破坏[21],植物基本生理代谢能力也遭到破坏[22],植物体内的脯氨酸和可溶性蛋白含量会出现下降的变化趋势。中苜一号在最高的盐浓度处理下,其脯氨酸、可溶性蛋白以及可溶性糖含量表现为上升的变化趋势,说表明中苜一号具有较强的耐盐能力,能够在高浓度的盐胁迫环境中维持生长发育。
试验结果还表明,接种AM真菌后的中苜一号在脯氨酸、可溶性蛋白和可溶性糖的含量均显著高于未接种AM真菌的空白对照组,且接种AM真菌与未接种AM真菌的植物的变化趋势相同,说明AM真菌对中苜一号在NaCl胁迫处理下的影响与植物自身的生长调节机制有关,在不同的NaCl浓度下,AM真菌均有效的发挥作用,以满足植物为维持生长发育和抗盐胁迫的需要而积累的渗透调节物质,这与陆爽等[23]人的研究结果一致。由于接种的AM真菌菌种不同,接种AM真菌处理后中苜一号的脯氨酸、可溶性蛋白和可溶性糖的含量也不相同[24-25]。因此,在盐渍化土壤种植植物时,仍需要根据不同的植物种类选择与之匹配的最佳AM真菌菌种,以提高植物的抗逆性,缓解植物的生长发育中受到的损伤。
3.3 不同NaCl浓度下接种AM真菌对中苜一号抗氧化系统的影响
植物受到盐胁迫时,MDA含量增加随着膜脂过氧化程度的增加而增加[26]。植物为了改变盐环境对植株体造成的损伤,不断增加抗氧化系统酶活性,SOD和POD等抗氧化酶活性增加,减弱膜脂过氧化作用,从而减轻盐离子对植株造成的损伤。试验结果表明,5个盐梯度的处理下,接种AM真菌的中苜一号的SOD和POD活性逐渐增加,这与王继华等[27]研究结果一致,柱花草和苜蓿在热胁迫和冷胁迫时,SOD和POD增活性加。SOD在植物抵抗盐胁迫的过程中,起防止、中断膜脂过氧化,对细胞膜系统损伤起保护作用。植物在受到逆境胁迫时,产生的氧自由基数量增加,SOD 的活性也增加,以便清除氧自由基,减少膜脂过氧化作用[28]。同样的POD活性的变化与SOD在盐胁迫环境下的变化一致。
3.4 不同NaCl浓度下接种AM真菌对中苜一号光合特性的影响
由于高浓度的盐环境会导致植物的水分流失,因而在NaCl胁迫状态下对植物的光合特性影响较大。植物由于自身的调节作用,在失水状态下会关闭气孔以减少水分的蒸腾,由于叶片气孔的关闭,其气体交换率减弱,相对应也导致其光合作用的的减弱[29-30]。试验发现,在对中苜一号进行NaCl胁迫时,其Pn,Tr和Gs等光合特性都发生了变化,Pn,Tr和Gs等在不同NaCl浓度条件下都呈现出下降的趋势,且随着NaCl浓度的增加而下降,接种AM真菌的植物的Pn,Tr和Gs显著高于未接种AM真菌的植物。Ci则随着NaCl浓度的增加而增加,且接种AM真菌的中苜一号的Ci含量显著低于未接种AM真菌的中苜一号。a其变化趋势证明了AM真菌对植物的生长期间的光合特性有着显著的影响,接种的AM真菌菌种不同也会呈现出不同的作用。
4 结论
NaCl胁迫显著影响了AM真菌对紫花苜蓿中苜一号根系的侵染,且随着NaCl浓度的增加,侵染率逐渐下降。不同的NaCl浓度胁迫下,AM真菌均有效的促进中苜一号的SOD活性、POD活性、丙二醛、脯氨酸、可溶性蛋白、可溶性糖含量的增加。接种AM真菌后,中苜一号的Pn,Tr和Gs随着NaCl浓度的增加而下降,Ci则随着NaCl浓度的增加而增加,AM真菌对中苜一号生长期间的光合特性有着显著的影响。
