网箱养殖对刘家峡水库浮游细菌群落组成及 影响因素分析
2018-09-18杜岩岩娄忠玉张艳萍
杜岩岩,娄忠玉,张艳萍,李 文,王 太
(甘肃省水产研究所,甘肃省冷水性鱼类种质资源与遗传育种重点实验室,兰州 730030)
网箱养殖模式具有高密度、高产量、高收益等特点,是水产养殖的主要养殖方式之一,然而在投喂饲料中仅有28%的氮和30%的磷被养殖对象吸收利用[1,2],大量的投喂残饵和鱼类排泄物等外源有机质进入养殖水体,加剧水体营养物质富集程度,直接影响养殖水域功能的正常发挥。在淡水生态系统中,浮游细菌既是有机物质的分解者和转化者,又是能量的贮存者,细菌群落结构与养殖环境的变化密切相关。由于只有很少的浮游细菌可以进行常规分离培养,这制约了对浮游细菌多样性和生态功能方面的研究。基于免培养的变性梯度凝胶电泳、末端限制性片段长度多态性分析和分子克隆文库等分子生物学方法被应用到对水体浮游细菌多样性的研究中,特别是近年来,基于16S rRNA的高通量测序技术的出现,能更加全面反映出细菌群落结构的基本特征。陶玲等[3]采用高通量测序技术比较了施用生石灰前后精养池塘浮游细菌群落结构和多样性变化,为生石灰调控池塘水质和疾病预防提供可能的理论解释。胡常巨等[4]对象山港网箱养殖区与非养殖区的细菌群落进行分析得出网箱养殖区增加的磷酸盐和铵盐是驱动浮游细菌群落变异的主要环境因子。Yan等[5]采用高通量测序技术分析了三峡大坝建设对香溪河浮游细菌群落结构和生态功能的影响。
刘家峡水库作为西北重要的冷水鱼类养殖基地和周边城市重要的核心水源地,其生态环境状况直接关系到养殖安全和饮水安全。以往的研究主要是水环境[6]、浮游动植物[7]和渔业资源[8]等方面,有关浮游细菌生物多样性和群体结构方面的研究还未见有报道。本研究采用基于16S rRNA高通量测序技术分析了网箱养殖对刘家峡水库浮游细菌群落多样性的影响,探讨群落结构与环境因子之间的关系,以期阐明刘家峡水库网箱对水环境影响的机理,为水环境保护提供依据。
1 材料与方法
1.1 样品采集与水质理化指标测定
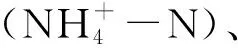

图1 刘家峡水库采样点分布图Fig.1 Distribution of the sample sites in Liujiaxia Reservoir
1.2 DNA提取与高通量测序
分别用0.22 μm孔径无菌滤膜抽滤1 L水样,将滤膜剪碎,用Water DNA kit(Omega)提取总DNA,将提取到的细菌总DNA通过微量紫外分光光度计(NanoDrop ND-1000,wilmingtong,DE,USA)测定DNA浓度和纯度。采用通用引物对浮游细菌16S rRNA基因的V3-V4区进行扩增,将PCR产物送至上海派森诺生物科技有限公司利用Illumina Miseq平台对群落DNA进行高通量测序。
1.3 数据处理与分析
利用QIIME软件(quantitative insights into microbial ecology,v1.8.0)对原始序列进行过滤,剔除嵌合体序列,得到优化序列,调用UCLUST序列比对工具,将优化序列按97%的序列相似度进行归并和OTU划分,选取每个OTU中丰度最高的序列作为该OTU的代表序列[9],通过与Greengenes数据库的模板序列相比对,获取每个OUT所对应的分类学信息。利用软件mothur计算丰富度指数Chao1和ACE,以及多样性指数Simpson 和Shannon 指数进行Alpha 多样性分析[10]。应用冗余分析方法(redundancy analysis,RDA)分析浮游细菌群落与环境因子之间的关系。
2 结果
2.1 浮游细菌群落丰度、多样性
6个样品的高通量测序共得到178 176条高质量序列,序列平均长度为393 bp,测序结果能完全反映不同样品浮游细菌群落组成。按97%的序列相似度进行划分后与数据库进行比对,共得到1 310个OTUs。各采样点的OTU数量见表1。其中水库上游A1采样点的OTU最高为700,下游A3采样点的OTU最低为505。Chao1和ACE指数主要用于估计群落中实际存在的物种数,数值越大,表明群落丰富度越高。水库上游A1采样点的Chao1和ACE指数最高,分别为509和644.72,A3采样点的Chao1和ACE指数最低,分别为383和383.00。Simpson指数对群落均匀度和群落中的优势OTU更敏感,而Shannon指数对群落均匀度和群落中的稀有OUT更敏感。位于养殖区的A1采样点的Simpson和Shannon指数最高,其次为位于水库上游的A2采样点,位于养殖区A6采样点的Shannon指数最低。
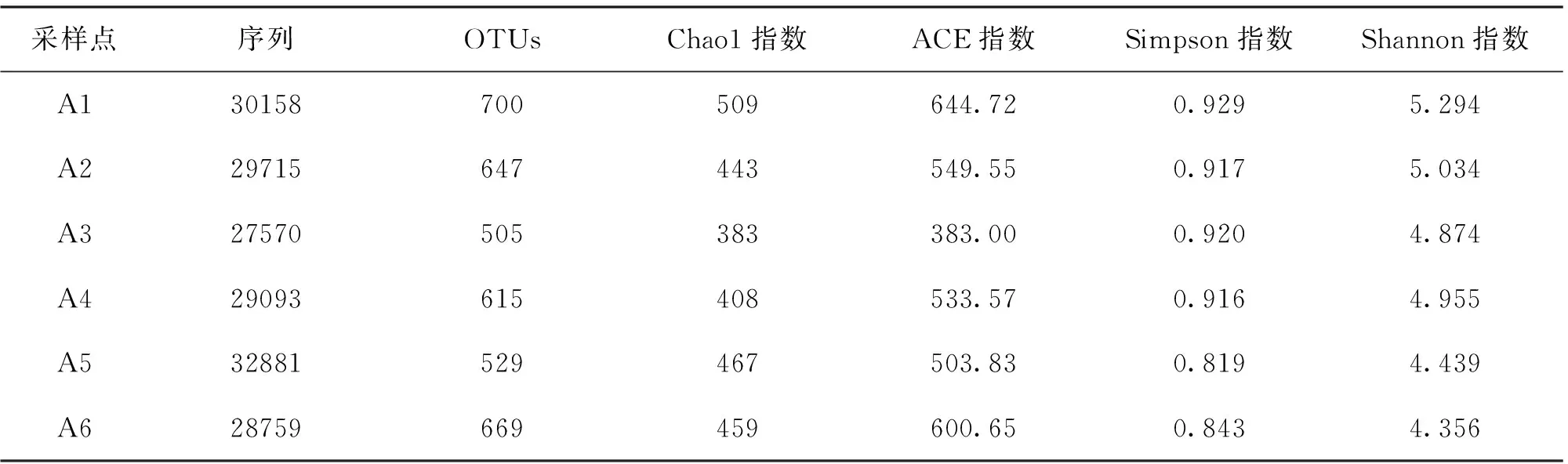
表1 刘家峡水库浮游细菌群落丰度与多样性Tab.1 The community abundance and diversity of bacterioplanktonic in Liujiaxia Reservoir
2.2 浮游细菌群落组成和结构分析
刘家峡水库6个采样点的1 310个OTUs分属于11个门25个纲41个目62个科73个属。在浮游细菌门分类水平上(图2),主要浮游细菌群落为变形菌门(Proteobacteria)占总浮游细菌OTUs的30.9%~59.2%,放线菌门(Actinobacteria)总浮游细菌OTUs的23.4%~34.1%,蓝藻门(Cyanobacteria)总浮游细菌OTUs的4.8%~20.6%,拟杆菌门(Bacteroidetes)总浮游细菌OTUs的5.3%~19.8%,这4个菌门的浮游细菌占总OTUs数的92.5%~96.2%,是刘家峡水库浮游细菌的优势菌群。此外还检测到了疣微菌门(Verrucomicrobia)、厚壁菌门(Firmicutes)、绿弯菌门(Chloroflexi)、绿菌门(Chlorobi)、酸杆菌门(Acidobacteria)、装甲菌门(Armatimonadetes)和浮霉菌门(Planctomycetes)。
由图2可以看出,刘家峡水库上游采样点A1和A2具有相似的浮游细菌群落结构,4种优势菌落群落相对丰度比例基本相似。养殖区A5采样点的浮游细菌群落与A1和A2差异较大,变形菌门(Proteobacteria)的相对丰度达到59.2%,是所有采样点中所占比例最大的。放线菌门(Actinobacteria)、蓝藻门(Cyanobacteria)和拟杆菌门(Bacteroidetes)的相对丰度都降低,分别为23.4%、4.6%和5.3%,厚壁菌门(Firmicutes)的相对丰度明显提高,达到3.4%。养殖区A6采样点与刘家峡水库上游A1和A2采样点相比,拟杆菌门(Bacteroidetes)的相对丰度明显提高,达到19.8%。A3和A4采样点由于分别位于两个养殖区的下游,呈现出一种水库上游来水与养殖用水混合后的浮游细菌群落结构。受网箱养殖的影响刘家峡水库上游至下游的浮游细菌群落中,变形菌门(Proteobacteria)的相对丰度升高,蓝藻门(Cyanobacteria)的相对丰度降低。
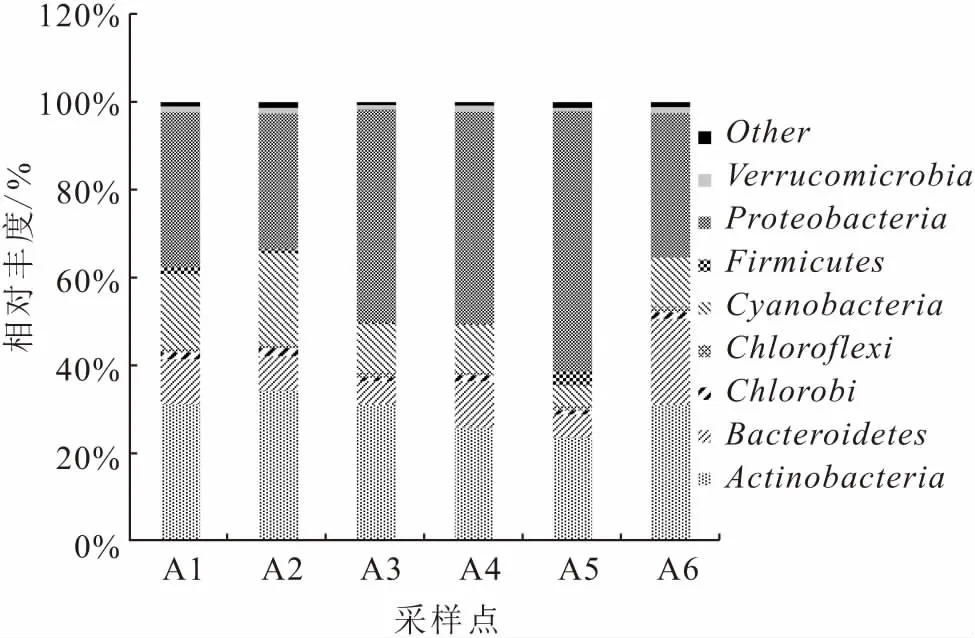
图2 刘家峡水库各采样点浮游细菌门水平组成变化Fig.2 Relative abundances of bacterial phyla in Liujiaxia Reservoir
在属水平上对6个采样点浮游细菌优势属的变化进行分析(图3),将平均丰度低于1.5%的属合并为Others。ACK-M1-norank是浮游细菌群落平均丰度最大的属,为18.1%,其次为聚球藻属(Synechococcus)平均丰度为12.2%。相对刘家峡水库上游A1和A2采样点,在养殖区A5采样点鞘氨醇单胞菌属(Sphingomonas)的相对丰度达到最大,为40.6%,红球菌属(Rhodococcus)和黄杆菌属(Flavobacterium)相对丰度也升高,分别达到5.3%和1.2%,其余各属相对丰度降低。养殖区A6采样点β变形菌Limnohabitans属和黄杆菌属(Flavobacterium)的相对丰度升高,分别达到12.1%和9.7%,其中黄杆菌属的一些种类可引起虹鳟幼鱼患细菌性并发症,聚球藻属(Synechococcus)和Pelagibacteraceae-uncultured的相对丰度降低,为10.8%和6.8%。在A3和A4采样点中,除上游来水与网箱养殖水混合后所表现出的群落组成特征外;A3采样点中Caulobacteraceae-uncultured的相对丰度显著增加,达到19.70%;A4采样点的不动杆菌属(Acinetobacter)的相对丰度显著增加,达到22.4%。
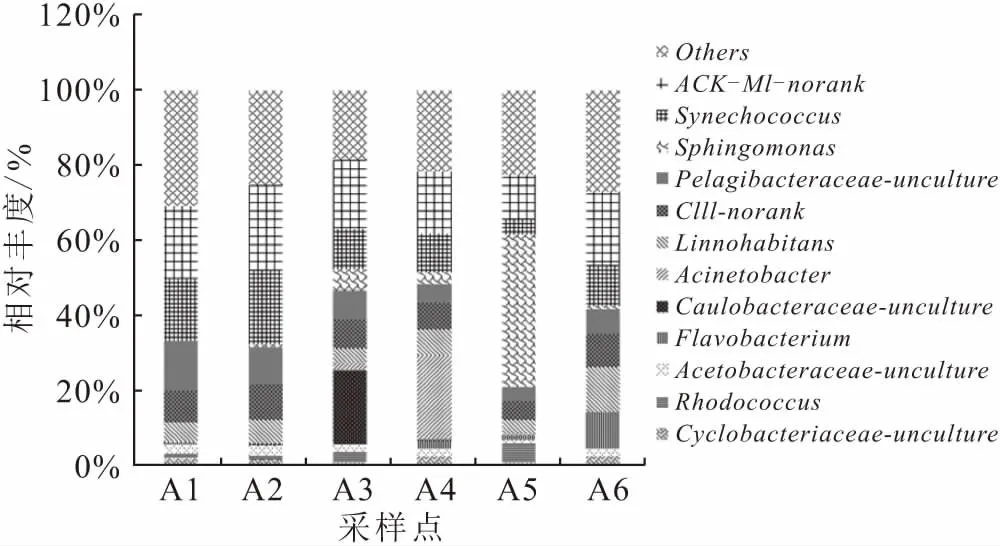
图3 刘家峡水库各采样点浮游细菌属水平组成变化Fig.3 Relative abundances of bacterial genera in Liujiaxia Reservoir
2.3 浮游细菌群落与环境因子的关系

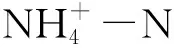
3 讨论
3.1 网箱养殖对刘家峡水库浮游细菌多样性影响
本研究利用基于Illumina Miseq平台的高通量测序分析了网箱养殖对刘家峡水库浮游细菌多样性的影响分析,共得到了平均长度为393 bp的178 176条高质量序列,发现主要有变形菌门、放线菌门、蓝藻门、拟杆菌门等11个门,ACK-M1-norank、聚球藻属、鞘氨醇单胞菌属、红球菌属、β变形菌属和Pelagibacteraceae-uncultured等73个属组成,表现出丰富的浮游细菌群落多样性。与滇池[11]和丹江口水库[12]等淡水湖库的优势细菌门组成基本相似,但是在属水平上刘家峡水库浮游细菌种类数量较少,这可能与刘家峡水库位于高原地区,水温较低不利于浮游菌类的生长繁殖有关。养殖区域(采样点A5和A6)浮游细菌的多样性指数低于非养殖区,这可能是由于网箱养殖区域的营养盐和有机污染物浓度较高,对水体浮游细菌有选择作用,导致养殖区域的浮游细菌多样性较低[13]。在养殖水体中维持浮游细菌的多样性可以增强水环境生物群落稳定性,当多样性指数由高向低转变后,就会增大养殖病害的爆发风险[14]。

表2 刘家峡水库采样点水化学指标Tab.2 Chemical parameters of sample sites in Liujiaxia Reservoir

图4 刘家峡水库浮游细菌属分类群落与水化学 指标的冗余分析Fig.4 Redundancy analysis of bacterial genus and chemical parameters in Liujiaxia Reservoir
3.2 网箱养殖区域浮游细菌群落结构变化
浮游细菌在水域生态系统中发挥着重要的生态作用,不同菌群有其独特的生态功能。由结果分析可知,放线菌门为刘家峡水库浮游细菌的优势菌群,在网箱养殖区A5采样点中相对丰度有所降低,但是该门中的红球菌属相对丰度是所有采样点中最高的,该属具有较强的降解碳水化合物和含氮化合物等有机物的能力[15],这可能是由于网箱养殖区岸边有大量农田,部分农药随地表径流进入水体,导致该区域红球菌属相对丰度升高。拟杆菌门在网箱养殖区A6相对丰度最高,由图3可以看出主要是由于拟杆菌门的黄杆菌属在该养殖区出现,并且相对丰度较高,达到9.7%。黄杆菌属可引起养殖对象虹鳟幼鱼患细菌性疾病,但由于在春秋两季对养殖区施用生石灰进行处理,未有大规模的虹鳟细菌性疾病爆发现象。有研究表明,施用生石灰后水体中的pH等理化指标产生变化,一些致病菌受到抑制,水体中浮游细菌的多样性和丰度提高,群落更加稳定[3]。隶属于蓝细菌门的聚球藻属,是刘家峡水库浮游细菌群落的优势种群,是一种固氮蓝藻[16],但在养殖区A5相对丰度减少。由表2可以看出,氮元素不是影响聚球藻属生长的主要影响因子,导致出现相对丰度减少的原因可能是由于养殖区域藻类生物量高[17],导致水体透明度降低,影响聚球藻属种类的生长。厚壁菌门在养殖区的相对丰度增大的主要原因是与厚壁菌门是一类厌氧菌相关[18],由于养殖区A5采样点网箱框架设置较密,加上养殖密度大,周围水体中的溶氧被大量消耗,给厚壁菌门的种类提供了一种缺氧环境。
变形菌门为刘家峡水库最主要的浮游细菌,主要包括α-变形菌纲、β-变形菌纲和γ-变形菌纲。刘家峡水库以α-变形菌纲中的一些种类为优势菌群,鞘氨醇单胞菌属凭借自身的高代谢能力和多功能的生理特性,可以降解芳香族化合物[19]。在养殖区A5相对丰度增加,这可能由于该区域受到农药等有机物的污染,与放线菌门红球菌属在此区域相对丰度增高的原因相同。从非养殖区到养殖区,α-变形菌纲的Pelagibacteraceae-uncultured和Acetobacteraceae-uncultured两个属、β-变形菌纲的Limnohabitans属以及γ-变形菌纲的Acinetobacter属的相对丰度都降低,这与沈燕等[20]的研究结果水体中α-变性菌的丰度随总磷浓度增加而增加不一致,可能是由于这几种浮游菌类为光能型细菌,养殖区水体透明度降低,不利于生长。Limnohabitans属种类作为主要的淡水浮游细菌,TN对其生长繁殖有重要的作用[21],这与本研究得到的TN含量越高的水域Limnohabitans属相对丰度越高的结果相一致。A5和A6养殖区的浮游细菌群落结构不同的原因可能是由于网箱养殖对象不一致,A5养殖区除养殖虹鳟外,还有鲟鱼和鲤鱼等其他鱼类,已有研究表明不同养殖对象的养殖水体中浮游细菌群落结构不相同[22]。
