α-酮戊二酸对氨氮胁迫下草鱼鳃Na+/K+-ATP酶活性及血液生化指标的影响
2018-09-13赵玉蓉王红权
赵玉蓉 付 莹 王红权,
(1. 湖南农业大学动物科学技术学院, 长沙 410128; 2. 水产高效健康生产湖南省协同创新中心, 常德 415000)
在当前高度集约化养殖模式下, 水体极易出现氨氮过量积累[1]。氨作为一种有毒物质, 在水体中过量积累时影响鱼类的呼吸系统、中枢神经系统和免疫系统等, 从而出现抑制生长、阻碍离子平衡、降低机体免疫功能等多种不良影响[2—4]。α-酮戊二酸(α-ketoglutarate, α-KG)作为三羧酸循环的中间体, 具有调节机体能量代谢、氮代谢、维持肠道健康和提高机体免疫力等多种功能[5—10]。大量研究表明, 饲粮中添加适量的α-KG能够有效缓解动物的热应激、脂多糖应激、氧化应激和草鱼的急性氨氮胁迫[9—14], 但其缓解草鱼氨氮胁迫的机制尚不清晰。本试验以草鱼(Ctenopharyngodon idellus)为对象, 研究α-KG对慢性氨氮胁迫下草鱼鳃Na+/K+-ATP酶活性和血液生化指标的影响, 以期为阐述α-KG缓解草鱼氨氮胁迫机制和α-KG作为鱼类抗氨氮应激剂饲料的开发应用提供参考。
1 材料与方法
1.1 试验动物及分组
试验用草鱼购自湘阴巨丰渔业有限公司, 饲养于容积为250 L的塑料桶。选取体格相近的健康草鱼270尾[初始体重为(24.79±0.11) g], 随机分成3个处理组, 分别为对照组 (Ⅰ) (曝气后的自来水、氨氮浓度为1.51 mg/L, 饲喂基础饲粮)、氨氮组 (Ⅱ)(曝气后的自来水、氨氮浓度为18.37 mg/L, 饲喂基础饲粮)和α-KG组 (Ⅲ) (曝气后的自来水、氨氮浓度为18.37 mg/L, 饲喂α-KG饲粮), 每处理组设3个重复桶, 每个重复桶放养30尾鱼。
1.2 试验饲料
根据草鱼配合饲粮标准(SCT 1024-2002)配制基础饲粮, 配方及营养成分见表1。根据本课题组的前期研究, 草鱼饲粮中α-KG的适宜添加量为7.5 g/kg[15]。因此, 本试验以7.5 g/kg α-KG等量替代基础饲粮中次粉, 配制α-KG饲粮。用逐级稀释混合扩大法将饲料原料混合均匀, 制成直径2 mm的颗粒料, 自然风干后置于–20℃保存备用。α-KG购自湖北远成集团, 纯度99.8%。
1.3 饲养管理
根据参考文献[14, 16, 17], 设计本试验氨氮组和α-KGr组的氨氮胁迫浓度为18.36 mg/L, 采用10 g/L的氯化铵母液调制。养殖试验在湖南农业大学水族基地进行, 所有试验用鱼提前15d饲养于试验桶中, 以适应试验环境。正式试验期间, 每天上午9: 00和下午5: 00投喂相应饲粮, 日投食量为鱼体重的3%左右, 投喂1h后吸出残饵和粪便, 然后换水(约1/3体积), 分别用氯化铵母液、氢氧化钠溶液或盐酸溶液调整养殖水体的氨氮浓度和pH以维持试验所需环境。另外, 每天13:00和22:00监测水体氨氮浓度、温度和pH, 并24h连续充氧。养殖期间各处理组的氨氮含量及其他实测值分别为:对照组、氨氮组和α-KG组的水体氨氮分别为1.51±0.08、18.71±0.62和18.26±0.40, 水温为(27.25±2.51)℃,pH为6.55±0.29, 草鱼成活率100%。
1.4 样品采集及指标测定
采样时间分别为第1、第14、第28和第42天,采样当天早晨禁食。每次采样时, 每桶随机选取4尾鱼, 经MS222麻醉后用2.5 mL无菌注射器尾静脉采血, 用1 g/L的肝素钠溶液抗凝, 3500×g4℃离心10min, 取上层血浆于–40℃保存备用。将草鱼置于冰上, 用镊子取草鱼两侧鳃组织, 用生理盐水冲洗, 滤纸吸干水分, 保存于–40℃备用。采用高效液相色谱-四级杆离子阱串联质谱仪测定血氨含量,深圳迈瑞BS-200全自动生化分析仪分别测定血液中谷丙转氨酶(Alanine aminotransaminase, ALT)、谷草转氨酶(Aspartate transaminase, AST)、碱性磷酸酶(Alkaline phosphatase, ALP)活性及尿素(UREA)、球蛋白(Globulin, GLB)的含量。鳃Na+/K+-ATP酶活性采用南京建成生物工程研究所的超微量Na+/K+-ATPase试剂盒测定, 严格按试剂盒操作说明书进行。
1.5 数据统计
所有数据采用SPSS 21.0软件进行单因素方差分析, 并用Duncan氏法进行多重比较, 试验结果用平均值±标准误表示,P<0.05时为差异显著, 反之为差异不显著。
2 结果
2.1 鳃Na+/K+-ATP酶活性
如图1所示, 氨氮胁迫后第28天, 氨氮组Na+/K+-ATP酶活性显著低于对照组和α-KG组(P<0.05), 但α-KG组的Na+/K+-ATP酶活性与对照组的差异不显著。第1、第14和第42天, 3组间Na+/K+-ATP酶活性均无显著差异。
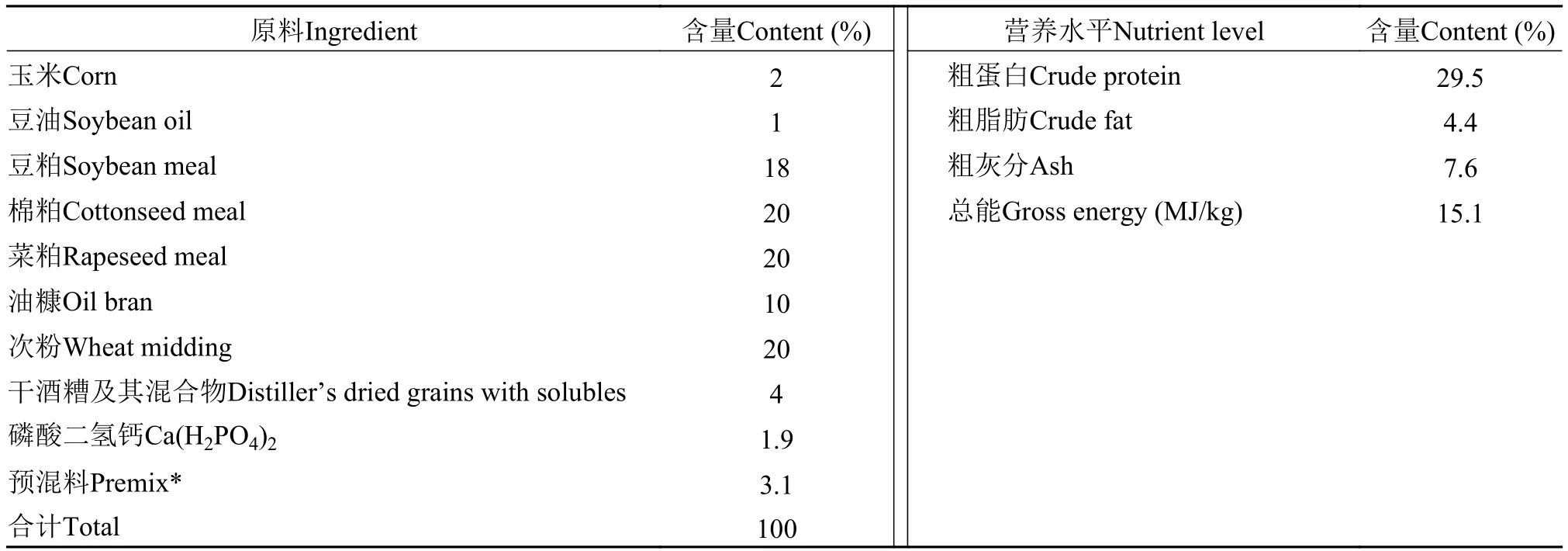
表1 基础饲粮组成及营养水平Tab. 1 Composition and nutrient levels of basal diet
2.2 血液生化指标
统计分析结果表明(图2), 氨氮胁迫后1d, 3个处理组间草鱼血氨含量存在显著差异。氨氮组草鱼血氨含量较对照组显著升高(P<0.05), 而α-KG的添加有效降低了α-KG组草鱼的血氨含量(P<0.05)。而氨氮胁迫后14d、28d和42d, 3个处理组草鱼血氨含量无显著差异(P>0.05)。
氨氮胁迫后第1天, 氨氮组和α-KG组血浆ALT活性均显著低于对照组(P<0.05), 但2组间无显著差异(P>0.05)。第14天, 氨氮组ALT活性低于对照组和α-KG组, 但3组间ALT活性无显著差异(P>0.05)。第28和第42天, 氨氮组ALT活性显著低于对照组(P<0.05)和α-KG组(P<0.05), 但对照组和α-KG组间无显著差异(P>0.05)。血浆AST活性在第1和第28天, 3组间无显著差异。第14天, 氨氮组血浆AST活性较对照组和α-KG组显著升高(P<0.05), 但对照组和α-KG组间无显著差异。第42天, 氨氮组和α-KG组AST活性无显著差异, 但均显著高于对照组(P<0.05)。
氨氮胁迫后第1天, 氨氮组和α-KG组血浆UREA含量无显著差异, 但均较对照组显著降低(P<0.05)。第14和第42天, 3组间血浆UREA含量均无显著差异。但第28天, 氨氮组血浆UREA含量显著低于对照组和α-KG组(P<0.05), 而对照组和α-KG组间血浆UREA含量无显著差异。
在氨氮胁迫后第1和第14天, α-KG组血浆GLB含量高于对照组和氨氮组, 但3组间差异不显著(P>0.05)。第28天, 氨氮组与对照组相比, 血浆GLB含量无显著差异, 但α-KG组血浆GLB含量显著高于对照组和氨氮组(P<0.05)。第42天, 对照、氨氮、α-KG组间血浆GLB含量无显著差异。
在氨氮胁迫后第1和第14天, 3组间血浆ALP活性无显著差异, 但第14天, α-KG有缓解氨氮胁迫导致的血浆ALP酶活升高的趋势。第28天, 氨氮组ALP活性与对照组相比无显著差异, 但显著高于α-KG组(P<0.05)。第42天时, 3组间血浆ALP活性无显著差异, 但α-KG组血浆ALP活性较低。
3 讨论
在本试验中, 氨氮胁迫1d后, 草鱼血氨含量显著升高, 而α-KG的添加能够有效缓解草鱼血氨含量的升高, 这说明α-KG能在一定程度上有效缓解氨氮胁迫。而14d、28d和42d, 3组草鱼间血氨含量差异不显著, 这说明草鱼对一定浓度的环境氨氮胁迫有一定的自我调节适应能力。
鳃不仅是鱼类的呼吸器官, 还参与机体的氨氮排泄、渗透压调节等。鳃上皮的泌氯细胞是鱼类机体离子排出的主要功能细胞, Na+/K+-ATP酶则位于该细胞的表面, 能通过耗能泵出Na+吸收K+以维持体内的渗透压, 而NH4+能够代替K+在Na+/K+-ATP酶上的位点与其结合, 因此Na+/K+-ATP酶与NH4
+的转运密切相关[18,19]。本试验结果表明, 第28天氨氮组鳃Na+/K+-ATP酶活显著低于对照组和α-KG组, 而对照组和α-KG组间差异不显著, 这说明慢性氨氮胁迫导致了草鱼鳃的氨转运受到抑制, 而饲粮α-KG能够有效缓解该现象。这可能是因为α-KG作为三羧酸循环的中间体, 能够提供Na+/K+-ATP酶进行离子转运时所需的能量, 从而有利于Na+/K+-ATP酶活的维持。第42天3组间鳃Na+/K+-ATP酶活差异不显著, 可能是因为草鱼对氨氮的慢性胁迫出现了适应, 这与Wei等[20]在鲫(Carassius auratus)上的研究结果相似。但是, Francois等[21]发现鳕(Gadus morhua)经过长期氨氮胁迫(0—0.17 mg/L)之后, 鳃Na+/K+-ATP酶活性并未受到影响, 而Alam和Frankel[22]发现银鲈(Bidyanus bidyanus)和金鲈(Macquaria ambigua)在氨氮胁迫(0—5 mg/L)下, 鳃Na+/K+-ATP酶活性随着氨氮浓度升高而升高, 这些不同结果的得出可能与试验所用氨氮浓度、试验鱼的种类和生存水环境的盐度(淡水和海水)等不同有关。
肝脏作为重要的代谢器官, 是鱼类解毒的主要场所。ALT和AST主要存在于肝细胞内, 当肝细胞受到损伤时, 会大量从细胞进入血液。因此, 血液中ALT和AST活性是肝脏损伤最敏感的检测指标。此外, 这2种转氨酶在非必需氨基酸的合成和蛋白质的分解代谢中也起着重要的作用。在本试验中, 氨氮胁迫后14d, 氨氮组草鱼血浆AST酶活显著高于对照组和α-KG组, 这说明一定浓度的氨氮胁迫14d后对草鱼肝脏造成了一定的损伤, 而饲粮中添加适量的α-KG能在一定程度上缓解氨氮胁迫对肝脏的损伤。第28天, 氨氮组草鱼血浆AST酶活显著升高现象消失, 3组间无显著差异, 这可能与草鱼对一定浓度的氨氮胁迫有所适应相关, 但还有待进一步证实。然而, 在长达42d的氨氮胁迫后, 氨氮组和α-KG组的AST含量均出现显著升高, 这说明在长期的慢性氨氮胁迫下, 草鱼肝脏受到损伤。此外,在氨氮胁迫后28d和42d, 血浆中ALT含量显著降低,这是否与动物为了适应氨氮胁迫环境, 从而抑制机体蛋白质的分解、减少体内氨氮产生相关, 还有待进一步研究。而α-KG组血浆ALT活性仅在第1天降低, 这说明饲粮中添加适宜的α-KG能减缓慢性氨氮胁迫造成的草鱼机体蛋白质代谢紊乱。
尿素氮是血液中主要的非蛋白质含氮物, 可以反映体内蛋白质分解代谢和肾功能的状况[23]。由于机体中的氨转换为尿素需要消耗大量的能量, 所以在一般情况下, 水生动物氮代谢产物多以氨的形式排泄, 少量以尿素形式排泄。在本试验中, 氨氮胁迫后1d, 氨氮组和α-KG组血液中尿素含量均显著低于对照组, 这可能是由于动物为了弥补氨氮胁迫带来的额外能量需求[24], 从而抵制机体的尿素合成。第28天, 氨氮组血液尿素含量依旧显著低于对照组, 而α-KG组血液尿素含量与对照组无显著差异, 这说明α-KG作为三羧酸循环的中间体, 对机体有补充能量的作用, 从而能一定程度地缓解动物应激时的额外能量消耗, 维持机体的代谢平衡。随着氨氮胁迫时间的进一步延长, 各组间血浆尿素含量差异不显著, 这可能是在长期慢性氨氮胁迫下, 草鱼自身出现适应性调节。
GLB由浆细胞分泌形成, 能够反映机体的抵抗能力[25]。在本试验中, 氨氮胁迫1d和14d后, α-KG组血浆GLB有增加的趋势; 胁迫28d后, 血浆GLB含量得到显著提高, 这表明日粮添加α-KG对草鱼氨氮胁迫下的抵抗力有一定提高。ALP主要参与磷酸基团的转移和代谢过程以及体内的钙、磷代谢[26,27], 对动物体的骨骼矿化、物质跨膜运输、解毒等起重要作用, 当组织或细胞受到损伤或诱导应激时, 溶菌体会释放该酶[28]。在本试验中,氨氮胁迫后28d α-KG组血浆中ALP活性出现显著降低, 说明饲粮适量α-KG的添加有利于氨氮胁迫下草鱼的机体保护。
综上所述, 饲粮α-KG的适量添加能够显著降低草鱼氨氮胁迫所致的血氨含量升高, 维持氨氮胁迫下草鱼机体鳃Na+/K+-ATP酶活、血浆谷丙转氨酶、谷草转按酶、碱性磷酸酶的活性和血浆球蛋白、尿素含量的稳定, 从而有利于草鱼缓解氨氮胁迫。
