红豆杉AFLP分子标记技术体系的建立及应用
2018-09-12史正文
史正文
(山西药科职业学院,山西 太原 030031)
红豆杉(Taxus)又名紫杉,为红豆杉科红豆杉属植物,是多年生小乔木或灌木,在我国云南、江西、福建以及东北等地都有栽培和野生。红豆杉在全世界共有11种,我国拥有其中4种和1个变种,即中国红豆杉(Taxus chinensis)、云南红豆杉(Taxus yunnanensis)、西藏红豆杉(Taxus wallichinana)、东北红豆杉(Taxus cuspidata)、南方红豆杉(Taxus chinensis var.maire)[1],其中,中国红豆杉、南方红豆杉为我国所特有。从红豆杉的树皮、树根及枝叶中提取的紫杉醇具有很强的抗癌能力,是重要的天然抗癌药物,尤其在治疗乳腺癌、肺癌和卵巢癌等方面疗效显著[2]。因此,作为药源植物的红豆杉的种质资源遗传多样性研究和种质资源的鉴定就显得非常重要。
扩增片段长度多态性技术(AFLP)是由VOS等[3]发展起来的一种高效分子标记技术,具有技术稳定、分辨率高、重复性强、可靠性好等特点[4-6]。AFLP被广泛应用于蔬菜[7-9]、林木[10-11]、果树[12]、粮食作物[13]、牧草[14]等农作物的遗传多样性分析。
红豆杉属植物次生代谢产物较多,总基因组DNA提取较难[15]。AFLP分析对供试DNA的要求较高[16],所以,提取高分子量、高纯度的DNA是AFLP分析成功的关键之一。
本研究以来自不同种源的红豆杉为材料,通过优化AFLP反应体系各关键影响因素,建立适合红豆杉的AFLP分子标记体系,为红豆杉的种质资源遗传多样性研究和种质资源的鉴定奠定基础。
1 材料和方法
1.1 材料
1.1.1 植物材料 植物样品为硅胶干燥后的红豆杉叶片,来自红豆杉属的4个种源和1个变种,样品保存于山西药科职业学院药用植物实验室。每个种源5个单株的等量叶片混合,用于提取基因组DNA。
1.1.2 主要试剂 RNA酶,Taq DNA聚合酶,限制性内切酶 EcoRI与 MseI,T4DNA 连接酶,dNTP,DL2000 bp DNA Marker等购自上海生工生物技术公司。
1.2 DNA的提取
本研究采用改良后的CTAB法提取红豆杉基因组DNA,紫外分光光度法、琼脂糖凝胶电泳法检测其纯度和浓度。具体步骤为:(1)选取超低温保存的红豆杉叶片放于研钵中,加液氮用力研磨使之呈粉末状,迅速称取0.2 g材料,置于1.5 mL离心管中,并将离心管置于冰中。(2)在1.5 mL的离心管中加入1 000 μL预热的CTAB提取液(含有PVP(聚乙烯吡咯烷酮)和β-巯基乙醇),使材料完全分散;置于65℃水浴锅中温浴30 min,每10 min摇匀一次。(3)将温浴的材料取出,待冷却至室温后加500 μL苯酚-氯仿-异戊醇,摇匀10 min,离心10min(13000r/min),将上清液转移至一新的1.5 mL离心管中。(4)重复步骤(3)一次。(5)将上清液转移到一新的1.5mL离心管中,加入0.5倍体积的NaCl和3倍体积的无水乙醇,沉降DNA,轻轻颠倒2~3次,于-20℃冰箱中静置30 min,离心10 min(13 000 r/min),弃上清液。(6)用 200 μL的 70%的乙醇和无水乙醇各洗2次,加入0.1倍体积的NaAc和2倍体积的无水乙醇,-20℃放置30 min,离心10 min(13 000 r/min),收集得到 DNA 沉淀。(7)待DNA干燥后,加100 μLTE溶液溶解,测定其浓度,而后保存于-20℃冰箱备用。
1.3 AFLP分析
1.3.1 酶切反应 采用MseΙ和EcoRΙ对红豆杉基因组DNA进行双酶切,37℃酶切6 h,70℃加热15 min终止酶切反应,将反应管置于冰上,电泳检测酶切完全后可进入连接反应。
1.3.2 连接反应 将连接体系与酶切体系混合(共40 μL),20℃连接过夜,得到的连接产物稀释5倍后作为下一步预扩增的模板。
1.3.3 预扩增 用具有一个选择性碱基的引物对连接产物进行预扩增。预扩增程序:94℃变性30 s,56℃退火1 min,72℃延伸1 min,20个循环。预扩增产物稀释50倍后用于选择性AFLP扩增反应。
1.3.4 选择性扩增 确定多态性较好的6对引物进行 PCR:94 ℃ 30 s,65 ℃ 30 s,72 ℃ 60 s一次循环,然后每循环一次,其退火温度降低1℃,执行11个循环。在第一阶段11个循环以后,94℃30 s,56℃30 s,72℃60 s下执行23个循环后终止反应,得到的选择性扩增产物进行电泳检测,确认有条带出现后,进入聚丙烯酰胺凝胶电泳。
2 结果与分析
2.1 红豆杉DNA的提取
本研究采用改良的CTAB法提取红豆杉基因组DNA,提取方法主要进行了以下改进:(1)在CTAB中加人PVP(聚乙烯吡咯烷酮)和β-巯基乙醇联合除酚。(2)采用高盐沉淀法代替了异丙醇沉淀法,高盐沉淀法更适合红豆杉基因组DNA的提取。(3)采用多次洗涤和高盐沉淀法相结合的方法,以达到除去多糖的目的。用乙醇沉淀DNA之前,加入0.5倍体积的5 mol/LNaCl;再次溶解洗涤后,用0.1倍体积的3 mol/L NaAc和2倍体积的无水乙醇沉淀DNA。紫外分光光度法检测所提取基因组DNA的纯度,OD值在1.637~1.857。经1.5%的琼脂糖凝胶电泳检测(图1),用改良后的CTAB法提取的红豆杉DNA完整,无降解,能满足AFLP分子标记分析的需要。
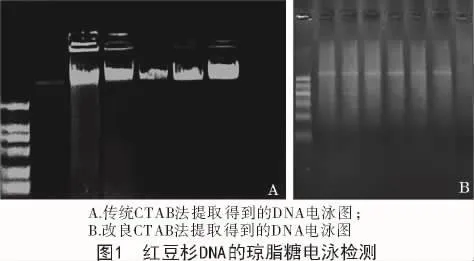
2.2 AFLP程序的优化
在高质量DNA的基础上,优化了AFLP反应体系。其中,酶切反应体系、PCR扩增反应体系列于表 1,2。
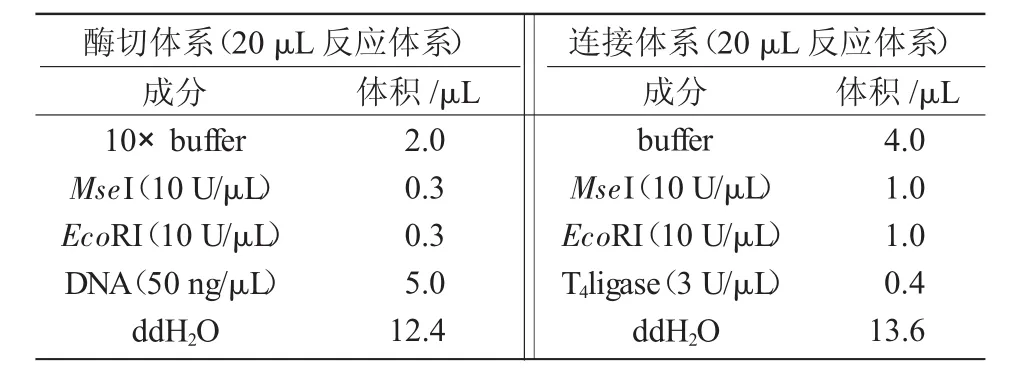
表1 酶切连接反应体系
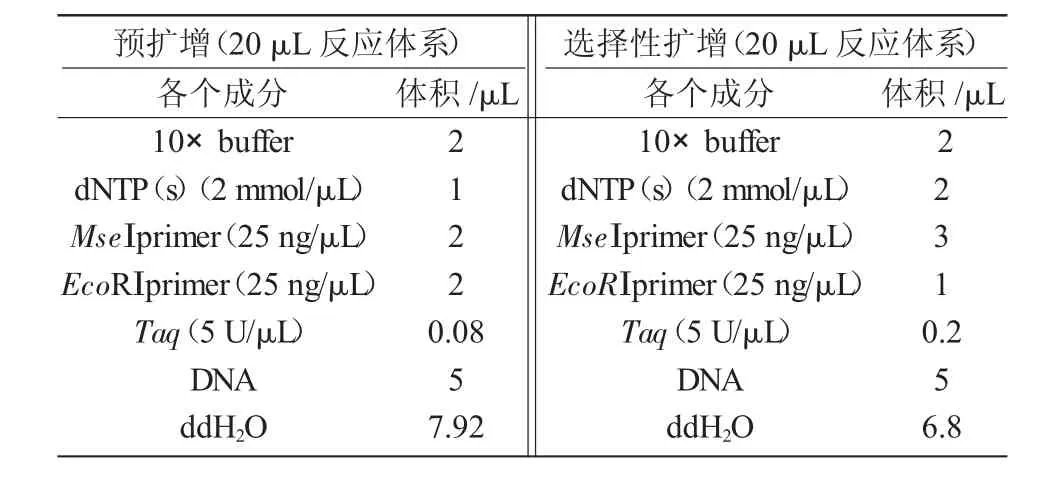
表2 预扩增和选择性扩增反应体系
同时,改进了聚丙烯酰胺凝胶电泳检测的方法。具体改进的步骤为:(1)用6%的凝胶进行电泳检测。(2)在银染的过程中,使用超纯水可获得较好的效果;同时要用高纯度的氢氧化钠洗涤,但时间不宜过长,洗涤时间太长,银颗粒会脱离DNA;染色及显影溶液临用前加入甲醛,不能提前加入。
2.3 利用AFLP分子标记对红豆杉进行鉴定
用8个EcoRΙ引物和8个MseΙ引物组成的64对引物组合对红豆杉的供试样品进行扩增,筛选出多态性较好的6对引物对红豆杉的供试样品进行AFLP分析(表3),6%聚丙烯酰胺凝胶电泳检测结果。结果表明,所采用的6对引物组合中,每对引物组合扩增结果在不同的红豆杉的供试样品中表现出丰富的多态性(表4)。从表4可以看出,第1号引物组合E-ACC/M-CTC产生的条带最多,其中,62.5%的条带为多态性条带;第6号引物组合E-AGG/M-CAA产生的条带最少,多态性检出率最低,为47.6%。所选6对引物共获得总条带数323条,平均每对引物产生约54条AFLP带,176条均为多态性条带,多态性检出率为54.5%。
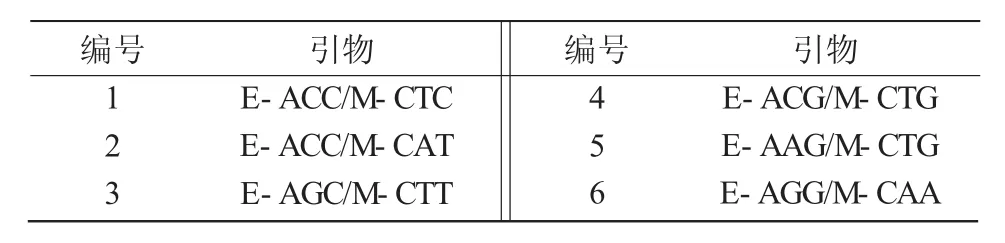
表3 选择性扩增的引物序列
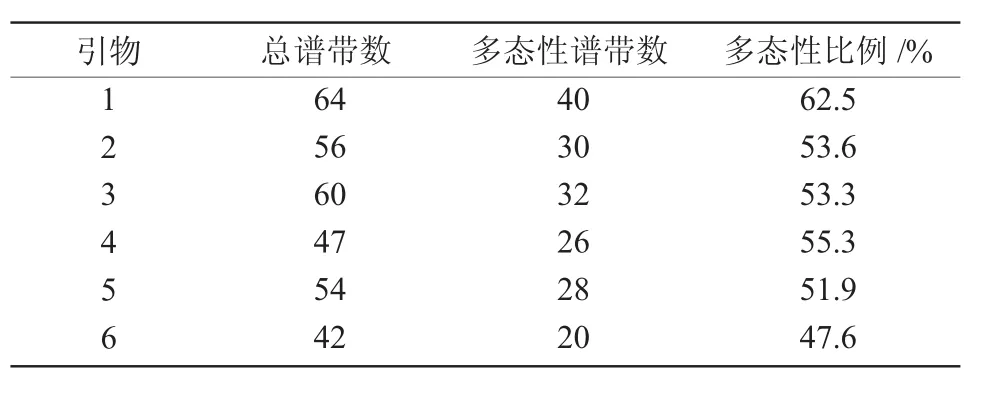
表4 红豆杉AFLP分析多态性情况
3 结论与讨论
AFLP技术多态性丰富、灵敏度高、DNA用量少,但对DNA的纯度要求较高。红豆杉的叶片组织含有大量的多糖、多酚及其他次生代谢产物,用CTAB常规方法获得的DNA纯度不高,影响了DNA的酶切和PCR效果。本研究采用改良后的CTAB法,采用PVP(聚乙烯吡咯烷酮)和β-巯基乙醇联合除酚、高盐沉淀提取红豆杉基因组DNA,结果表明,利用该方法得到的基因组DNA,其质量能够满足AFLP的要求。
在AFLP分子标记分析过程中,PCR反应体系中各个成分的浓度要根据不同物种进行调整。本研究在对不同浓度成分组合进行试验后,得到了一个适合红豆杉的稳定反应体系。聚丙烯酰胺凝胶电泳分析表明,预扩增用1个选择性碱基,选择性扩增用3个选择性碱基,得到的条带数目适中,适合红豆杉AFLP分析。在聚丙烯酰胺凝胶电泳体系中,凝胶的银染很重要,银染步骤不适合,得到的条带不清晰,通过反复实践,建立了一个优良的银染体系。
同时,应用建立的AFLP体系,筛选出6对引物组合,在5个红豆杉种源中共扩增出323条条带,检测到176个多态性位点。这些多态性分子标记为进一步研究红豆杉不同种源间的遗传差异,保护及开发、利用红豆杉资源奠定了基础。
