铜金属配合物和质子酸在可见光下催化喹啉与异喹啉的偶联反应
2018-09-11张金相武可书
张金相 ,王 琳 ,武可书 ,刘 鲲 ,王 斌
(1.天津师范大学化学学院,天津300387;2.天津师范大学无机-有机杂化功能材料化学教育部重点实验室,天津300387;3.天津师范大学天津市功能分子结构与性能重点实验室,天津300387)
喹啉和异喹啉类化合物是很多有生物活性的天然产物和药物的基本骨架,广泛应用于治疗疟疾、抗癌药物等的生产[1-3].因此,合成含有各种取代基的喹啉和异喹啉类化合物对于新药研发有重大意义[4-7],也逐渐成为有机化学研究的前沿领域之一[8-10].近年来,可见光诱导下的金属催化有机反应备受关注,相对于传统的有机催化化学反应(如加热方法),可见光诱导的反应能量来源清洁廉价,装置简便,反应条件温和可控,能够满足化学未来发展趋势中对于环境友好型和可持续利用的要求[11-14].如Condie等[1]报道了一种氧化偶联方法,通过可见光作用实现了芳基叔胺和硝基烷烃的反应.在催化剂使用方面,相对于传统贵金属(如:铑,钌,钯,铱等)化合物催化剂,金属铜配合物具有价格低廉、毒性低、来源丰富等优点[15-17],近年来被广泛应用于有机合成领域.
为了探究可见光诱导下的金属铜配合物催化有机反应方法在喹啉和异喹啉类化合物合成上的应用,本研究使用 2,9-二甲基-4,7-二苯基-1,10-邻菲啰啉碳硼烷双二苯基膦一价铜配合物(Cu1)和质子酸作为双催化剂,在可见光诱导下,成功催化了2-甲基喹啉类化合物和N-苯基四氢异喹啉类化合物的交叉脱氢偶联反应.为了得到较高收率,本研究对Cu1的用量、酸的种类及用量、溶剂的种类及用量、反应时间等条件进行了筛选,为喹啉和异喹啉类的偶联反应合成新型化合物提供了实验依据.
1 实验
1.1 仪器与试剂
仪器:Mercury400MHz型核磁共振仪,美国Varian公司;Yanaco-241型显微熔点测定仪,北京世纪科信仪器公司.
试剂:1,2-二碳十硼烷,梯希爱(上海)化成工业发展有限公司;二苯基氯化膦,天津希恩思生化科技有限公司;2-甲基喹啉类化合物,萨恩化学技术(上海)有限公司.所有试剂均为分析纯.
光催化剂 2,9-二甲基-4,7-二苯基-1,10-邻菲啰啉碳硼烷双二苯基膦一价铜配合物(Cu1)按照文献[18]的方法合成,四氢异喹啉类原料按照文献[19]的方法制备.
1.2 实验步骤
1.2.1 2-甲基喹啉和四氢异喹啉合成反应条件的筛选
2-甲基喹啉和四氢异喹啉偶联反应的实验步骤:在50 mL的Schlenk瓶中加入一定量的光催化剂Cu1、间甲基苯甲酸(或其他酸类)、2-甲基喹啉或其衍生物、N-苯基四氢异喹啉或其衍生物、溶剂(甲醇与乙腈或二氯甲烷混合物).反应体系充满氧气,距离反应瓶2 cm处放置3.5 W的LED白光灯带.反应完成后将溶剂去除,通过硅胶柱层析色谱方法进行分离,获得相应的脱氢偶联产物.2-甲基喹啉和N-苯基四氢异喹啉脱氢偶联反应方程式如图1所示.反应体系中,2-甲基喹啉的物质的量为0.4 mmol,N-苯基四氢异喹啉为0.2 mmol,对Cu1的用量、溶剂的种类及用量、酸的种类及用量以及反应时间进行筛选,最终得出最佳反应条件.
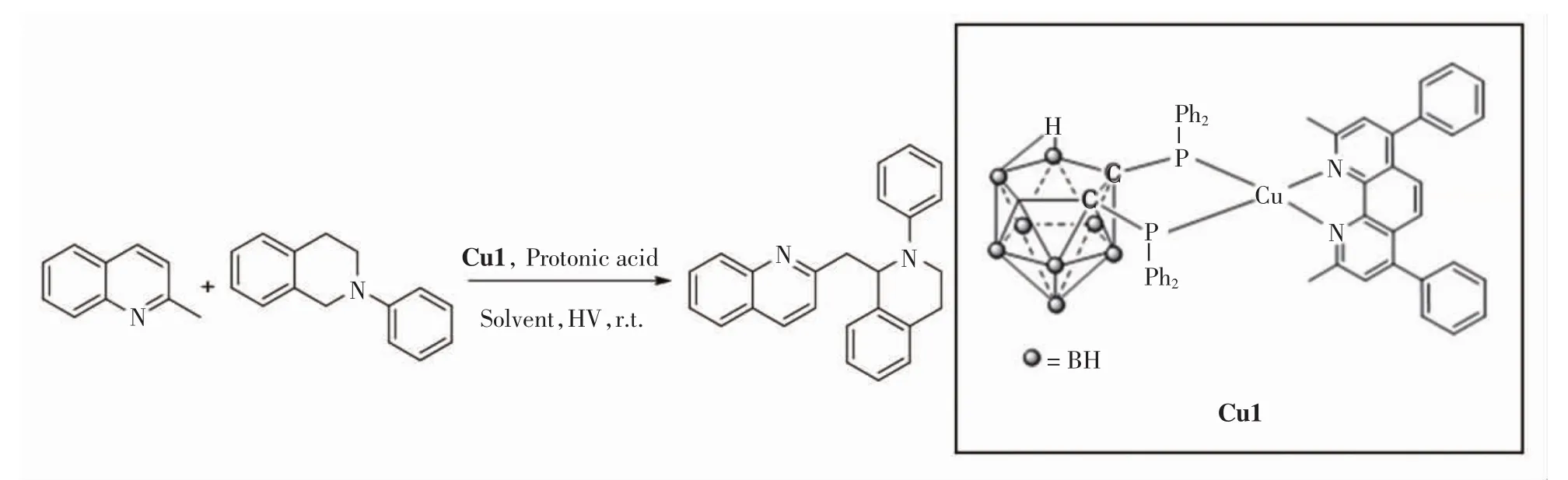
图1 2-甲基喹啉与对N-苯基四氢异喹啉的化学反应方程式Fig.1 Chemical reaction formula of 2-methylquinoline with N-phenyl-tetrahydroisoquinoline
另外,在其他条件不变的情况下,一方面以空气为反应气体环境,考察气体环境对该反应的影响;另一方面,在避光环境下进行反应,考察光照对该反应的影响.
1.2.2 实验底物的扩展
选用2-甲基喹啉及衍生物和N-苯基四氢异喹啉及衍生物为底物,使用Cu1和质子酸作为双催化剂,在1.2.1中得到的最佳条件下催化脱氢偶联反应,得到不同种类的脱氢偶联产物.化学反应通式如图2所示.
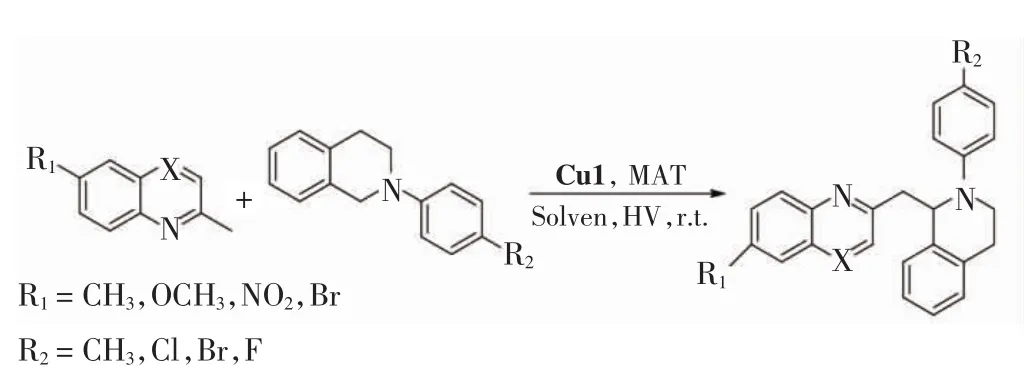
图2 2-甲基喹啉和N-苯基四氢异喹啉脱氢偶联反应通式Fig.2 General dehydrogenation coupling reaction formula of 2-methylquinoline with N-phenyl-tetrahydroisoquinoline
1.2.3 对产物的表征
使用显微熔点测定仪与核磁共振仪分别对15种反应产物的熔点和1H NMR进行测定,通过对表征数据的分析确定产物结构.
2 结果与分析
2.1 Cu1光催化2-甲基喹啉与N-苯基四氢异喹啉偶联反应条件的筛选
反应体系中,2-甲基喹啉固定为0.4 mmol,N-苯基四氢异喹啉为0.2 mmol,用氧气作为气体氛围,对Cu1的用量、酸的种类及用量、溶剂的种类及用量以及反应时间进行筛选,不同条件下产物的产率如表1所示.
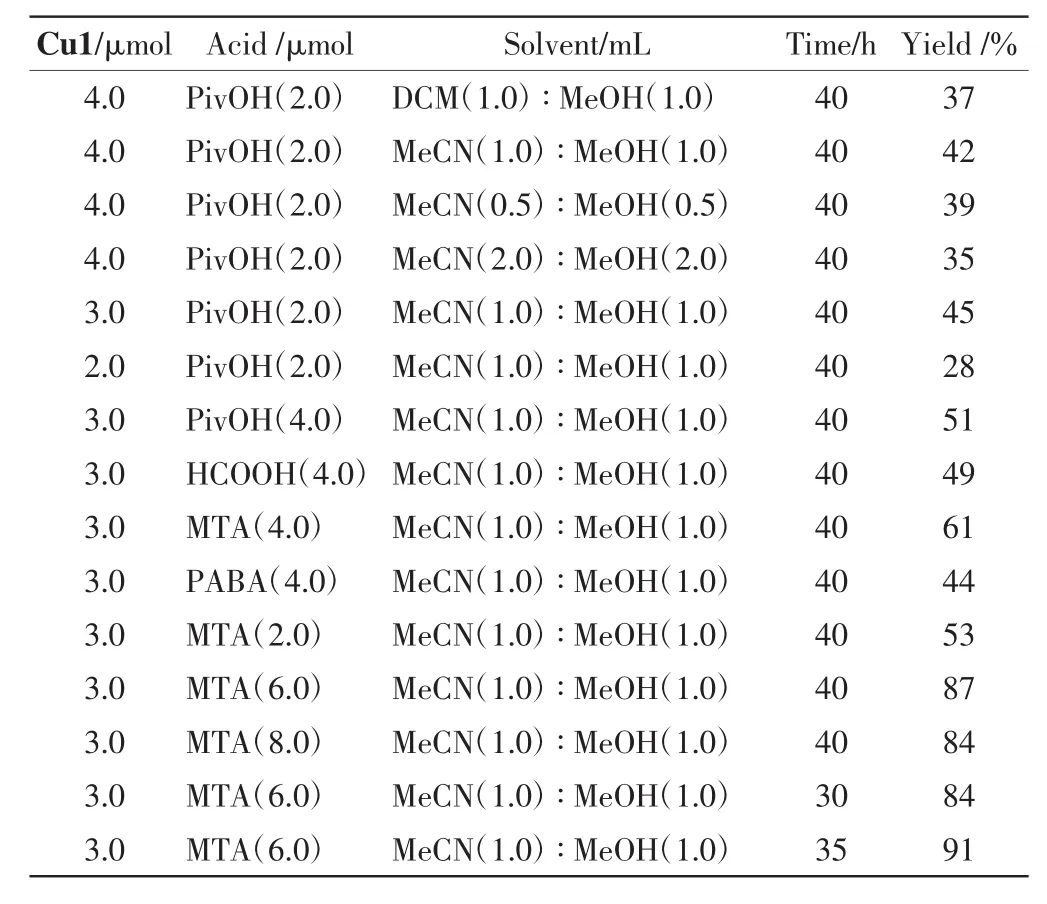
表1 不同条件下2-甲基喹啉与N-苯基四氢异喹啉反应的产率Tab.1 Yield of 2-methylquinolinereacted with N-phenyltetrahydroisoquinoline under different conditions
由表1可以看出,最佳条件:Cu1的物质的量为3.0 μmol,酸的种类为间甲基苯甲酸(MTA),其用量为6.0 μmol,溶剂为甲醇(MeOH)与乙腈(MeCN)的等体积混合物(各1.0mL),在氧气氛围下,3.5W的LED白光灯光照35 h,产物的产率最大,为91%.
在反应气体环境的对照实验中,当其他反应条件相同、气体环境为氧气时,反应产率为60.9%,而气体环境为空气时,反应产率仅为5.1%,因此氧气环境有利于反应进行.反应在避光环境中进行时,产率仅为20%,因此认为,该反应中可见光源是必不可少的.
2.2 Cu1光催化不同取代基的2-甲基喹啉与N-苯基四氢异喹啉反应
在最优条件下,以不同取代基的2-甲基喹啉和N-苯基四氢异喹啉作为反应底物,最终合成了15种化合物,产率如表2所示.

表2 带有不同取代基的2-甲基喹啉与N-苯基四氢异喹啉反应及产率Tab.2 Products and yield of reactions of 2-methylquinoline with N-phenyl-tetrahydroisoquinoline having different substituents
在连有不同取代基的2-甲基喹啉与N-苯基四氢异喹啉反应结果中,当R1为供电子基团时(甲基和甲氧基)产率分别为71%与64%(分别对应产物b和e),当R1为受电子基团时(硝基和溴)产率均为57%(分别对应产物c和d),因此当R1为供电子基团时有利于反应进行.当R2分别为甲基、氟、氯、溴时,相应的产率分别为77%、58%、77%和66%(对应产物分别为g、o、k和j),即R2为甲基和氯时反应产率较高.
化合物a:白色固体.m.p.119~121℃.1H NMR(400 MHz,CDCl3,TMS)δ8.14 (d,J=8.3 Hz,1H),7.95(d,J=8.3 Hz,1H),7.78(m,2H),7.51(t,J=7.6 Hz,1H),7.16(m,4H),7.08(d,J=8.0 Hz,1H),7.01(m,1H),6.95(d,J=8.0 Hz,2H),6.88(d,J=7.5 Hz,1H),6.67(t,J=7.2 Hz,1H),5.47(t,J=6.9 Hz,1H),3.82(m,1H),3.72(m,1H),3.36(m,1H),3.15(m,1H),2.95(m,1H).表征结果与文献[9]中一致.
化合物b:白色固体.m.p.123~125℃.1H NMR(400 MHz,CDCl3,TMS)δ8.06(d,J=8.5 Hz,1H),7.88(d,J=8.3 Hz,1H),7.58(m,2H),7.20(m,4H),7.05(m,2H),6.96(d,J=8.3 Hz,2H),6.88(d,J=7.5 Hz,1H),6.68(t,J=7.1 Hz,1H),5.47(t,J=6.9 Hz,1H),3.84(m,1H),3.72(m,2H),3.36(m,1H),3.18(m,1H),2.96(m,1H).表征结果与文献[9]中一致.
化合物c:白色固体.m.p.131~133℃.1H NMR(400 MHz,CDCl3,TMS)δ8.02 (d,J=8.9 Hz,1H),7.91 (d,J=2.1 Hz,1H),7.85 (d,J=8.4 Hz,1H),7.78(d,J=8.9 Hz,1H),7.18(m,4H),7.08(d,J=8.4 Hz,1H),7.01(m,1H),6.91(d,J=8.1 Hz,2H),6.84(d,J=7.6 Hz,1H),6.69(t,J=7.2 Hz,1H),5.43(t,J=7.0 Hz,1H),3.81(m,1H),3.71(m,2H),3.38(m,1H),3.16(m,1H),2.95(m,1H).表征结果与文献[9]中一致.
化合物d:黄色固体.m.p.156~158℃.1H NMR(400 MHz,CDCl3,TMS)δ8.72(s,1H),8.49(d,J=9.2 Hz,1H),8.25(d,J=9.2 Hz,1H),8.11(d,J=8.4 Hz,1H),7.21 (m,5H),7.05 (m,1H),6.92(m,3H),6.70(t,J=7.2 Hz,1H),5.50(t,J=7.0 Hz,1H),3.82(m,1H),3.73(m,2H),3.41(m,1H),3.17(m,1H),2.97(m,1H).表征结果与文献[9]中一致.
化合物 e:白色固体.m.p.52~54℃.1H NMR(400 MHz,CDCl3,TMS)δ8.44(s,1H),8.14(d,J=8.3 Hz,1H),8.06(d,J=8.0 Hz,1H),7.78(m,2H),7.18(m,4H),7.07(m,1H),6.92(m,3H),6.70(t,J=7.2 Hz,1H),5.43(t,J=7.0 Hz,1H),3.83(m,1H),3.71(m,2H),3.41(m,1H),3.15(m,1H),2.94(m,1H).表征结果与文献[9]中一致.
化合物f:白色固体.m.p.121~123℃.1H NMR(400 MHz,CDCl3,TMS)δ8.05(d,J=9.2 Hz,1H),7.86(d,J=8.4 Hz,1H),7.38(m,1H),7.16(m,4H),7.04(m,3H),6.93(d,J=8.3 Hz,2H),6.87(d,J=7.6 Hz,1H),6.68(t,J=7.2 Hz,1H),5.42(t,J=7.0 Hz,1H),3.92(m,3H),3.82(m,1H),3.72(m,2H),3.33(m,1H),3.16(m,1H),2.95(m,1H).表征结果与文献[9]中一致.
化合物g:白色固体.m.p.105~106℃.1H NMR(400 MHz,CDCl3,TMS)δ8.14(d,J=8.4 Hz,1H),7.97(d,J=8.3 Hz,1H),7.77(m,2H),7.52(t,J=7.3 Hz,1H),7.14(m,3H),7.03(m,1H),6.97(d,J=8.4 Hz,2H),6.91(d,J=7.6 Hz,1H),6.84(d,J=8.4 Hz,2H),5.41(t,J=7.0 Hz,1H),3.79(m,1H),3.71(m,2H),3.37(m,1H),3.15(m,1H),2.89(m,1H),2.19(s,3H).表征结果与文献[9]中一致.
化合物h:白色固体.m.p.105~107℃.1H NMR(400 MHz,CDCl3,TMS)δ8.03(d,J=8.5 Hz,1H),7.88(d,J=8.4 Hz,1H),7.56(m,2H),7.14(m,2H),7.07(d,J=8.4 Hz,1H),7.03(m,3H),6.89(d,J=7.6 Hz,1H),6.83(d,J=8.6 Hz,2H),5.38(t,J=7.1 Hz,1H),3.80(m,1H),3.70(m,2H),3.35(m,1H),3.15(m,1H),2.89(m,1H),2.53(s,3H),2.19(s,3H).表征结果与文献[10]中一致.
化合物 i:白色固体.m.p.106~109℃.1H NMR(400 MHz,CDCl3,TMS)δ8.06(d,J=9.0 Hz,1H),7.97(m,1H),7.91(s,1H),7.87(d,J=8.4 Hz,1H),7.79 (d,J=8.9 Hz,1H),7.14 (d,J=3.5 Hz,2H),7.04(m,1H),6.94(t,J=8.0 Hz,3H),6.79(d,J=8.6 Hz,2H),5.38(t,J=7.0 Hz,1H),3.79(m,1H),3.70(m,2H),3.39(m,1H),3.14(m,1H),2.87(m,1H),2.18(s,3H).表征结果与文献[10]中一致.
化合物 j:白色固体.m.p.155~157℃.1H NMR(400 MHz,CDCl3,TMS)δ8.16(d,J=8.4 Hz,1H),7.96(d,J=8.3 Hz,1H),7.77(m,2H),7.53(t,J=7.8 Hz,1H),7.20(m,4H),7.04(d,J=8.3 Hz,2H),6.90 (d,J=7.5 Hz,1H),6.81 (d,J=8.9 Hz,2H),5.44(t,J=7.0 Hz,1H),3.78(m,1H),3.65(m,1H),3.36(m,1H),3.13(m,1H),2.96(m,1H).表征结果与文献[9]中一致.
化合物k:白色固体.m.p.158~160℃.1H NMR(400 MHz,CDCl3,TMS)δ8.19(d,J=8.3 Hz,1H),7.99(d,J=8.3 Hz,1H),7.80(m,2H),7.55(t,J=7.2 Hz,1H),7.19(d,J=2.8 Hz,2H),7.10(m,4H),6.93(m,3H),5.46(t,J=6.8 Hz,1H),3.81(m,1H),3.66(m,2H),3.39(m,1H),3.17(m,1H),2.97(m,1H).表征结果与文献[9]中一致.
化合物 l:白色固体.m.p.174~175℃.1H NMR(400 MHz,CDCl3,TMS)δ8.03 (d,J=8.5 Hz,1H),7.87(d,J=8.3 Hz,1H),7.57(m,2H),7.16(m,2H),7.07(m,4H),6.88(d,J=7.6 Hz,1H),6.84(d,J=9.0 Hz,2H),5.40(t,J=7.0 Hz,1H),3.78(m,1H),3.65(m,2H),3.34(m,1H),3.16(m,1H),2.95(m,1H).表征结果与文献[10]中一致.
化合物m:白色固体.m.p.146~147℃.1H NMR(400 MHz,CDCl3,TMS)δ8.01 (d,J=8.9 Hz,1H),7.91(d,J=2.1 Hz,1H),7.86(d,J=8.4 Hz,1H),7.80(m,1H),7.17(m,2H),7.08(m,4H),6.86(d,J=7.6 Hz,1H),6.82(d,J=9.0 Hz,2H),5.39(t,J=7.0 Hz,1H),3.77(m,1H),3.64(m,2H),3.33(m,1H),3.12(m,1H),2.95(m,1H).表征结果与文献[10]中一致.
化合物n:黄色固体.m.p.173~174℃.1H NMR(400 MHz,CDCl3,TMS)δ8.72(s,1H),8.49(d,J=9.2 Hz,1H),8.23 (d,J=9.2 Hz,1H),8.11 (d,J=8.4 Hz,1H),7.18(m,3H),7.07(m,3H),6.86(m,3H),5.44(t,J=7.0 Hz,1H),3.77(m,1H),3.68(m,2H),3.38(m,1H),3.16(m,1H),2.97(m,1H).表征结果与文献[10]中一致.
化合物o:白色固体.m.p.154~156℃.1H NMR(400 MHz,CDCl3,TMS)δ8.14(d,J=8.4 Hz,1H),7.98(d,J=8.3 Hz,1H),7.79(m,2H),7.54(t,J=7.6 Hz,1H),7.17(d,J=4.0 Hz,2H),7.09(m,2H),6.92(d,J=7.6 Hz,1H),6.86(m,4H),5.40(t,J=6.9 Hz,1H),3.81(m,1H),3.65(m,2H),3.37(m,1H),3.14(m,1H),2.93(m,1H).表征结果与文献[9]中一致.
3 讨论与结论
本研究以可见光为能量来源,以廉价易得且对环境友好的金属铜配合物(2,9-二甲基-4,7-二苯基-1,10-邻菲啰啉碳硼烷双二苯基膦一价铜配合物,Cu1)和间甲基苯甲酸为双催化剂,催化喹啉类和异喹啉类的C—H交叉脱氢偶联反应.根据文献[9-10,20]的报道,推断本研究的反应机理为:在可见光条件下,Cu1与间甲基苯甲酸组成的双催化剂促使异喹啉类物质与喹啉类物质形成C(sp3)—C(sp3)键,其中,间甲基苯甲酸将喹啉类物质转变为更加亲核的烯胺,Cu1在氧气存在下使异喹啉类物质变为亲电子的亚胺离子,二者发生偶联反应,生成新的化合物.本研究首先以一种喹啉类(2-甲基喹啉)和一种异喹啉类(N-苯基四氢异喹啉)为底物,筛选出最优反应条件.在此条件下,选用带有不同取代基的2-甲基喹啉和N-苯基四氢异喹啉作为反应底物,成功合成了15种化合物.与文献[9-10]相比,本研究以可见光代替传统的加热方法,以Cu1和间甲基苯甲酸取代氧代哌啶铵盐为催化剂,反应条件温和可控,能源和催化剂成本低廉,同样获得了较高的收率.
