2013—2017年我国北方马铃薯产区疮痂病病原菌组成分析
2018-09-11杨德洁关欢欢于秀梅李寿如赵伟全刘大群
杨德洁,关欢欢,于秀梅,李寿如,赵伟全*,刘大群,3*
(1.河北农业大学 植物保护学院/河北省农作物病虫害生物防治工程技术研究中心,河北 保定 071001; 2.本溪市马铃薯研究所,辽宁 本溪 117000; 3.中国农业科学院 研究生院,北京 100081)
马铃薯是我国第四大主粮作物,在国家粮食安全战略部署和农业发展方式转变中具有重要作用[1]。我国是马铃薯生产和消费第一大国,常年种植面积在566.67万hm2以上,总产量保持在9 000多万t[2]。随着近年来我国马铃薯种植规模的增长,病害对生产的影响日益突出。马铃薯疮痂病是马铃薯生产中重要的土传和种传病害,感染该病的薯块表面会形成疮痂症状,降低其品质和商业价值,造成重大的经济损失。此外,发病薯块不耐贮藏并且易被其他的病原菌侵染危害。在脱毒微型薯生产中发生疮痂病会将病原菌带入种薯基地,造成种薯带菌,并随着种薯调运远距离传播病害。马铃薯疮痂病可由多种植物病原链霉菌(Plant pathogenicStreptomyces)引起,病原菌在不同地域的分布较广,组成也比较复杂[3-4]。鉴于该病已在我国北方马铃薯种植区普遍发生且逐年加重[5],而该区域亦是我国马铃薯种薯的主要生产基地,很有必要对其疮痂病病原菌进行跟踪检测。因此,本研究在2013—2017年对北方马铃薯产区的疮痂病薯进行了持续取样,并对病原菌进行了分离、纯化与鉴定,旨在明确我国北方马铃薯产区疮痂病病原菌的组成和变化情况,为该病害的预测预报和防治研究提供依据。
1 材料和方法
1.1 供试材料
采集的样本为2013—2017年我国黑龙江、辽宁、内蒙古、山西、陕西、山东、河北等地马铃薯产区带有典型疮痂病斑的病薯。
1.2 菌株的分离纯化
菌株的分离与纯化参照Liu等[6]的方法。使用蒸馏水清洗薯块后,用75%乙醇擦拭薯块表面,在独立病斑的病健交界处切取约5 mm3的薯块,于1% NaClO溶液中浸泡约30 s后取出,无菌水冲洗后用灭菌滤纸擦干表面水分,将其切成0.5~1 mm的薄片,置于1.5%的琼脂培养基上,在恒温培养箱中28 ℃条件下培养4 d,挑取目标单菌落在OMA培养基上连续纯化3次,得到链霉菌的纯化菌株。
1.3 菌株致病性检测
参照Faucher等[7]的方法进行。选取株高约10 cm、长势一致的马铃薯幼苗进行接种。采用灌根法接种,将待测菌株孢子悬浮液浓度调整为106cfu/mL,每盆接种200 mL,并设置清水对照,每个菌株处理设5次重复。正常管理,于第11周收获并检测新生薯块的发病情况,以确定菌株的致病性。
1.4 菌株16S rDNA序列扩增
按照链霉菌分子操作方法[8]进行致病菌株基因组DNA提取。采用链霉菌16S rDNA序列通用引物Pu(5′-CATTCACGGAGAGTTTGATCC-3′)和Pd(5′-AGAAAGGAGGTGATCCAGCC-3′)对菌株基因组DNA进行扩增。扩增的反应体系为50 μL,其中2×GC bufferⅡ(大连TaKaRa公司)25 μL、dNTP(10 mmol/L)1 μL、模板1 μL、引物各1 μL、Taq酶0.8 μL,ddH2O补至50 μL。PCR扩增条件:94 ℃预变性5 min;94 ℃变性30 s,62 ℃退火50 s,72 ℃延伸1 min,30个循环;72 ℃终延伸5 min;10 ℃保存。扩增产物用1%的琼脂糖凝胶电泳检测后,回收目的片段,送交上海生工生物工程技术服务有限公司测序。
1.5 菌株16S rDNA序列聚类分析
将所得测试菌株的16S rDNA序列校对后,在NCBI数据库中进行BLAST比对分析,选取同源性较高的序列,利用MEGA 6.0软件的邻接法(Neighbor-Joining)进行聚类分析。选取的参比菌株包括前期获得的我国不同典型疮痂病菌株CPS-1、CPS-2、CPS-3及NCBI数据库中的S.acidiscabies(AY621376)、S.europaeiscabiei(NR_042790)、S.galilaeus(AB184378)、S.griseus(AB184347)、S.scabieiATCC49173(D63862)、S.turgidiscabies(NR_040828)、S.diastatochromogenes(NR_025867)、S.enissocaesilis(KF454847)、S.albulus(AB024440.1)、S.chartreusis(NR_041216.1)、S.galbus(NR_026178.1)、S.lividans(NZ_CP009124.1)、S.lydicus(FJ799181.1)、S.resistomycificus(EU054370.1)、S.virginiae(JN201950.1)等不同链霉菌模式菌株,通过构建系统发育树进行聚类、鉴定。
1.6 菌株生物学特性测定
参照Lambert等[9-10]、Miyajima等[11]的方法对菌株单一碳氮源的利用情况、药物敏感性和黑色素产生情况等生物学指标进行测定。
2 结果与分析
2.1 菌株分离与致病性检测结果
将采集的疮痂病薯样品按照每个病薯选取1个病斑进行链霉菌菌株分离,在每个病斑获得的全部菌株中选取保留1个典型菌株,共分离纯化出423个链霉菌菌株。通过温室盆栽接种进行柯赫氏法则验证,将能使新生薯块产生典型疮痂病症状的菌株确定为致病菌株(图1),共筛选到141个致病性较强的菌株。

A:菌株Ss-1;B:菌株Sg-16;C:菌株Sd-2;D:菌株Sen-1;
2.2 菌株16S rDNA序列聚类分析结果
在致病菌株中选取42个具有不同培养特征的典型菌株用于16S rDNA序列分析。对提取的各菌株基因组DNA检测结果表明,OD260/280值均在1.8~2.0,纯度较好。PCR扩增产物在约1.5 kb处有明显的目的条带(图2)。回收测序后,将所得序列在NCBI数据库中进行BLAST比对,选取最高相似度种属的典型菌株作为系统发育树构建的参比菌株,同时将不同类别的菌株进行编号。聚类分析结果表明(图3),在42个测试菌株中,有17株与S.galilaeus聚为一类,8株与S.scabies或S.europaeiscabiei聚为一类,9株与S.diastatochromogenes聚为一类,3株与S.enissocaesilis聚为一类,2株与S.turgidiscabies聚为一类,1株与S.griseus聚为一类,另有2个菌株SC-8、SC-16未能有效聚类。其中S.scabies、S.europaeiscabie和S.diastatochromogene在聚类时位于同一分支,说明其亲缘关系较近,尤其是S.scabies与S.europaeiscabie在亲缘关系上最为接近。而S.galilaeus、S.griseus和S.enissocaesilis均为单独分支,与以上各种亲缘关系较远。在对菌株的不同采集地区进行分析后发现,河北的菌株有S.scabies、S.europaeiscabie、S.diastatochromogenes、S.galilaeus、S.enissocaesilis等种,山东有S.scabies和S.turgidiscabies,内蒙古和山西有S.scabies和S.galilaeus,陕西有S.diastatochromogenes、S.turgidiscabies、S.griseus,黑龙江有S.scabies和S.galilaeus,辽宁有S.scabies和S.griseus。说明我国北方马铃薯产区的疮痂病菌种类多样、组成复杂。
M:Marker DL2000; 1: Sg-1;
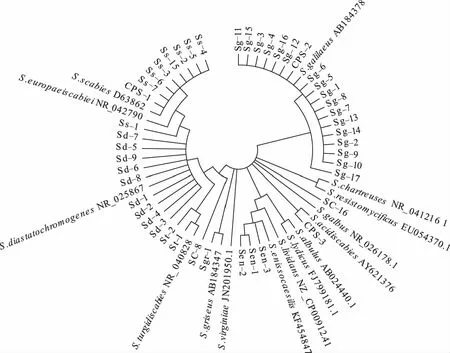
图3 根据16S rDNA序列构建的致病菌株系统发育树
2.3 菌株生物学特性测定结果
对典型菌株的形态特征、培养特征及生理生化特性分别进行了测定,结果见表1。
在所有鉴定的菌株里,除了S.enissocaesilis组和S.griseus组的菌株及SC-8、SC-16外,大部分菌株不能以木糖、果糖和阿拉伯糖为单一碳源。除了S.enissocaesilis组的菌株外,大部分菌株对链霉素(20 μg/mL)、苯酚(0.1%)及结晶紫(0.5 μg/mL)敏感。其中菌株Sd-1、Sen-1、Sen-2、Sen-3、Sgr-1、SC-8能以所有9种碳源和3种氮源为单一碳、氮源。测试菌株中,S.scabies组与S.diastatochromogenes组的菌株生物学特性十分相近。其中S.scabies组的菌株与典型菌株S.scabiesATCC49173的差异表现为不能以果糖、阿拉伯糖和木糖为单一碳源,对青霉素(10 IU/mL)不敏感。与典型菌株[12]相比,S.diastatochromogenes组的菌株不能以ISP(InternationalStreptomycesProject medium)中的果糖为单一碳源;S.enissocaesilis组的菌株能以木糖、阿拉伯糖、果糖为单一碳源;S.turgidiscabies组的菌株不能以ISP中的果糖、阿拉伯糖、木糖和鼠李糖为单一碳源,能以组氨酸为单一氮源;S.griseus组的菌株能产生黑色素,能以ISP中的阿拉伯糖、鼠李糖、棉子糖、蔗糖和肌醇为单一碳源。S.galilaeus组的菌株与其他组菌株的差异性表现为不能以甘露醇为单一碳源,并且不能以甲硫氨酸为单一氮源。
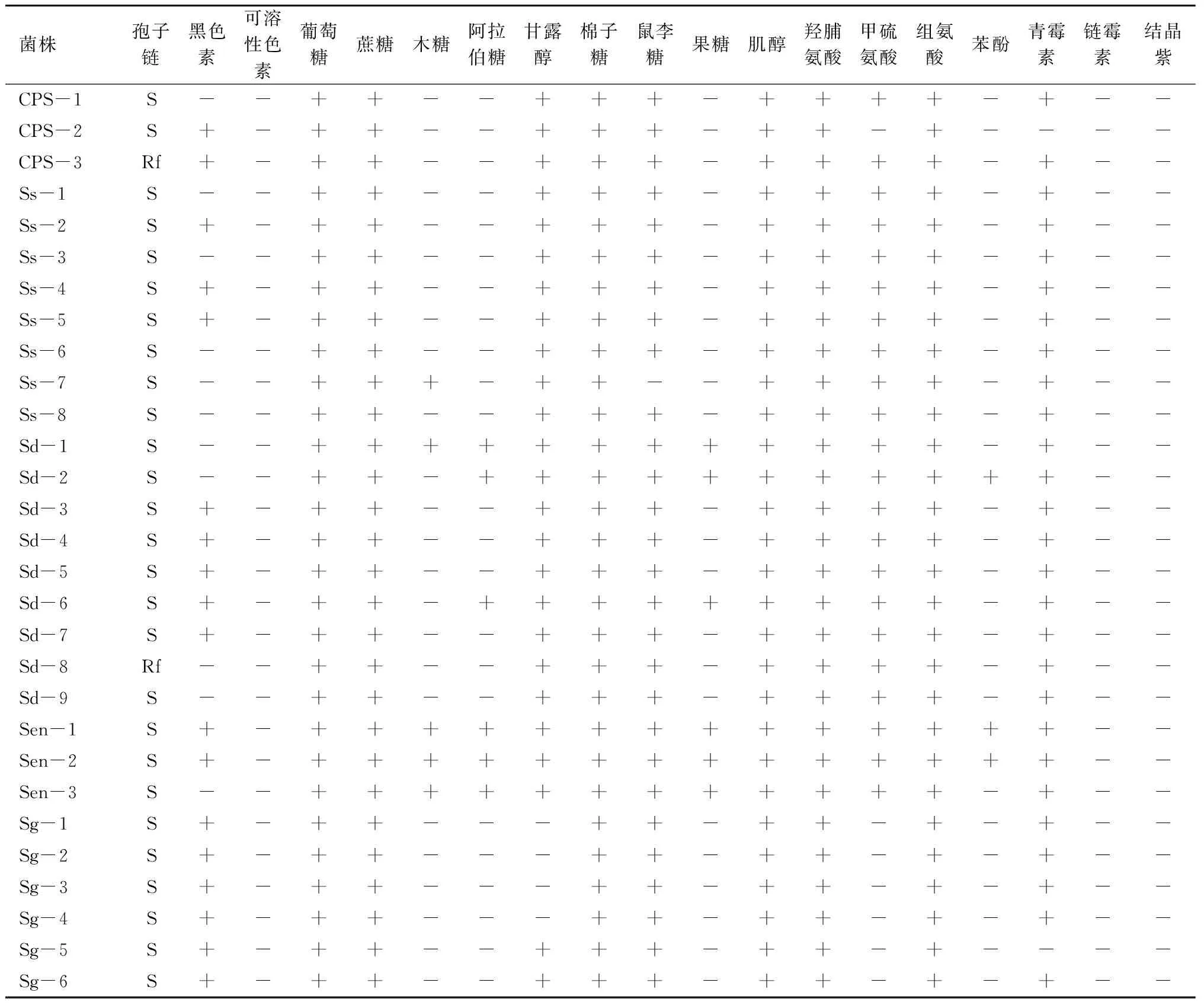
表1 测试菌株的培养特征及生理生化特性
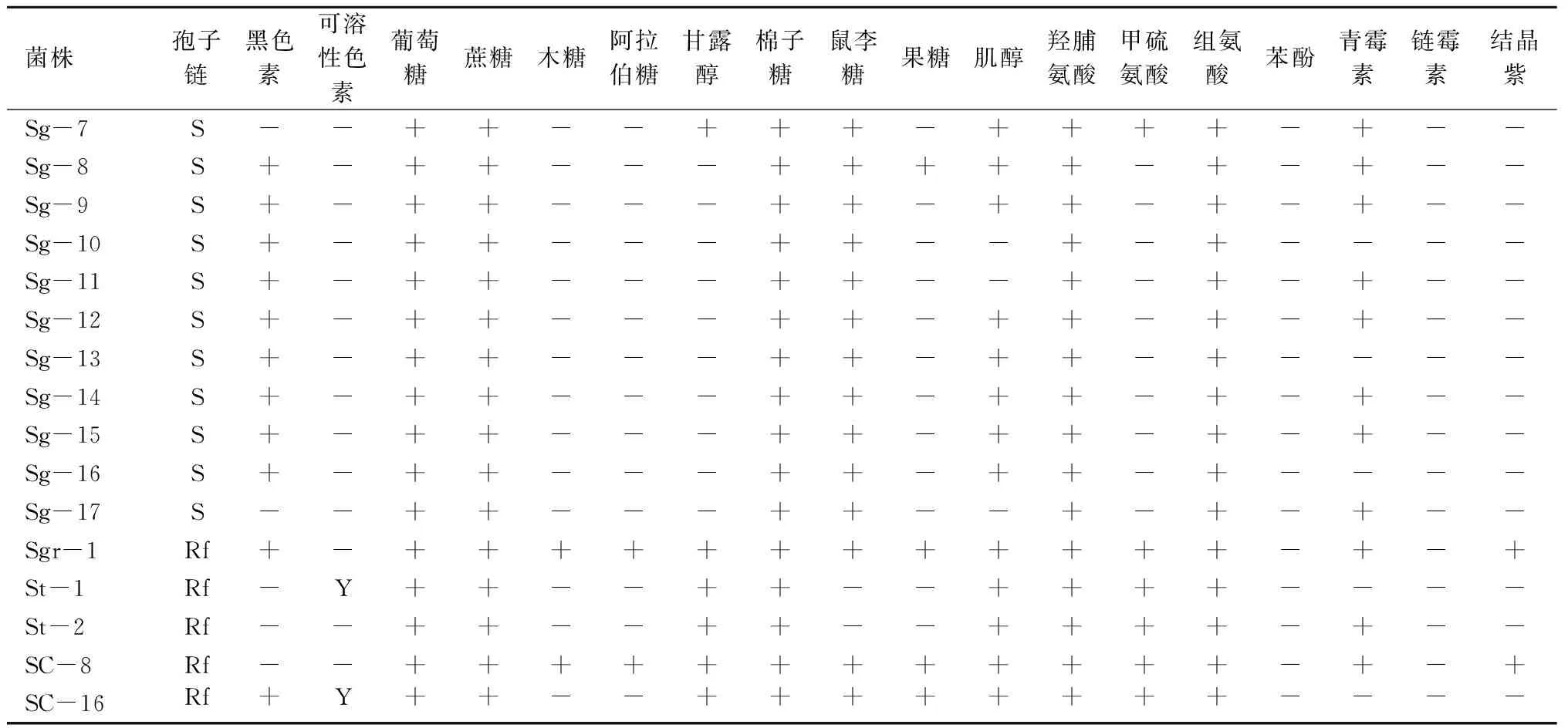
续表1 测试菌株的培养特征及生理生化特性
注: +.产生或生长;-.不产生或不能生长;Y.黄色;S.螺旋状;Rf.直-柔曲状;链霉素为20 μg/mL; 苯酚为0.1%;结晶紫为0.5 μg/mL;青霉素为10 IU/mL。
3 结论与讨论
马铃薯疮痂病是典型的土传和种传病害,在世界各马铃薯种植区普遍发生,受到各国研究人员的高度重视。马铃薯疮痂病可由十几种植物病原链霉菌引起,不同地域的疮痂病病原菌组成存在较大差别。美国的马铃薯疮痂病菌在西部地区的优势种为S.europaeiscabiei,而东部地区S.scabies占优势[13];韩国报道的病原除S.scabies外,还有S.puniciscabiei、S.acidiscabies、S.luridiscabiei、S.turgidiscabies和S.niveiscabiei等种[14];法国也曾报道有S.scabies、S.stelliscabiei、S.europaeiscabiei、S.reticuliscabiei等疮痂病菌[15];其他如南非[16]、巴基斯坦[17]等国也有研究者在近期报道存在马铃薯疮痂病菌。
随着近年来我国马铃薯种植规模不断扩大,土传病害对马铃薯生产的影响日益突出。马铃薯疮痂病已在我国各马铃薯产区普遍发生,明确各地的疮痂病原是当务之急。目前已发现黑龙江省的致病种有S.scabies、S.europaeiscabiei、S.turgidiscabies和S.acidiscabies[18],甘肃省有S.scabies和S.griseus[19],新疆有S.scabies和S.acidiscabies[20]。说明我国不同地区疮痂病原的组成差异较大。为全面了解我国北方疮痂病病原菌的组成分布情况,本研究对2013—2017年北方马铃薯产区的疮痂病菌进行了系统鉴定分析,发现存在S.scabies或S.europaeiscabiei、S.galilaeus、S.diastatochromogenes、S.turgidiscabies、S.griseus、S.enissocaesilis等种。与之前的调查结果[21]相比,本次未分离到S.bobili、S.acidiscabies和S.setonii等种,新发现有S.griseus存在,而S.scabies、S.galilaeus、S.enissocaesilis、S.diastatochromogenes和S.turgidiscabies等种仍稳定存在。说明我国北方马铃薯产区的疮痂病病原菌组成表现为稳中有变,但整体分布依旧比较复杂,仍需对其进行持续跟踪监测。
从现有的报道来看,在已知的疮痂病菌中以S.scabies的分布最为广泛,其他致病种一般为局部或多地发生。但由于马铃薯生产中调种频繁,对疮痂病菌的传播影响较大,因此在进行马铃薯生产,尤其是种薯繁育和调运时,应加大对疮痂病的检测力度,尽量减缓病原菌的传播,并定期对不同区域的疮痂病病原菌进行监测。同时积极寻求有效的病害防控途径,以助力马铃薯产业的安全持续发展。
