布氏锥虫来源内切-β-N-乙酰氨基葡糖苷酶的异源表达和活性鉴定
2018-09-06崔娟喜多岛敏彦王宁中西秀树高晓冬
崔娟,喜多岛敏彦,王宁,中西秀树,高晓冬
(江南大学 生物工程学院,江苏 无锡,214122)
糖基化是真核生物蛋白质翻译后修饰的重要环节,糖链对于蛋白质的结构和功能具有重要的影响[1]。目前在医药用的蛋白中,70%以上都是糖蛋白。药用糖蛋白表面的糖链具有改善药物在体内的稳定性,增强药物的靶向性等功能[2]。然而,目前生产出来的重组药用糖蛋白糖链结构的非均一性造成了药效下降及批次间不一致,甚至产生免疫副反应,这些都严重影响了药用糖蛋白的临床应用[3]。因此,如何生产糖链结构均一的糖蛋白十分重要[4]。
目前糖苷内切酶催化的转糖基作用对于生产均一糖链的糖蛋白是一种重要的手段。ENGase(EC 3.2.1.96)是一种糖苷内切酶,可以水解N糖链上2个N-乙酰葡糖胺之间的β-1,4糖苷键,分为糖苷水解酶18家族(glycoside hydrolase families 18, GH18)和GH85。属于GH18的ENGase具有糖苷水解活性,例如来源于褶皱链霉菌(Streptomycesplicatus)的Endo-H[5]和来源于酿脓链球菌(Streptococcuspyogenes)的Endo-S[6]等。属于GH85的ENGase除了水解活性之外同时还具有转糖基活性,可以将均一化的糖链转移到糖蛋白上的β-N-乙酰氨基葡萄糖上,在2个GlcNAc之间形成新的均一化糖链从而应用到生产均一糖链的糖蛋白上,例如来源于原生节杆菌(Arthrobacterprotophormiae)的Endo-A[7]和来源于冻土毛霉(Mucorhiemalis)的Endo-M[8]等。
目前Endo-A和Endo-M已经被广泛应用于均一化糖链糖蛋白的合成,但Endo-A只能利用高甘露糖型糖链作为糖基供体,Endo-M虽然可以利用高甘露糖型、复合型以及杂合型N-糖链,已经被商业化利用,但是由于其难以从大肠杆菌中大量纯化,导致价格昂贵[9]。通常ENGase的水解活性要比转糖基活性高,合成产物容易被自身再次水解,导致产率降低。而且不同的ENGase由于其底物特异性不同,使用范围受到限制。为了克服这些问题,该研究寻找到一种新的来源于布氏锥虫(Trypanosomabrucei)的ENGase,可以在大肠杆菌中大量表达和纯化,通过检测水解活性以及底物特异性,融合蛋白Nus-Endo Tb能够作用于高甘露糖型和复合型糖链。并且用唾液酸糖肽作为糖基供体,检测到 Nus-Endo Tb具有转糖基活性。由于Nus-Endo Tb可以在大肠杆菌中大量表达和简单的纯化,并且酶的性质稳定利于储存,在对于N糖蛋白修饰的研究中有一定的实用价值。
1 材料与方法
1.1 质粒和菌株
大肠杆菌DH5α由本实验室保存;大肠杆菌BL21(DE3)pLysS购于博迈德公司;质粒pET43a-10His-Nus由实验室前期构建;用于扩增基因的引物在华大基因合成。
1.2 表达载体pET43a-10His-Nus-Endo Tb的构建
以布氏锥虫基因组作为模板,使用正向引物ETb-Fw0和反向引物ETb-Rv0对其进行PCR扩增,获得Endo-Tb的基因片段。用XhoI和EcoRI限制性内切酶(TaKaRa)分别对基因片段和质粒pBluescript II SK(+)进行双酶切,经Ligation-Mix连接酶(TaKaRa)连接后转化大肠杆菌DH5α,涂布于LB卡那抗性平板。挑选单菌落进行菌落PCR和限制性酶切的初步鉴定,将获得的阳性克隆送至上海六合华大基因测序,从而得到正确编码的载体pBS-EndoTb。然后以pBS-EndoTb为模板,分别使用FL-43、D1-43、D2-43为正向引物,Rv-43为反向引物,扩增3个不同长度的基因片段,用EcoRI和XhoI分别对基因片段和质粒pET43a-10His-Nus进行双酶切。连接转化后涂布于LB氨苄抗性平板。鉴定后得到正确编码的载体pET43a-10His-Nus-Endo Tb(FL)、pET43a-10His-Nus-Endo Tb(D1)和pET43a-10His-Nus-Endo Tb(D2)。构建质粒所用的引物在表1中列出。

表1 引物序列Table 1 Primer sequences
1.3 Nus-Endo Tb在大肠杆菌BL21(DE3)pLysS中的表达和纯化
将重组表达载体pET43a-10His-Nus-Endo Tb(FL/D1/D2)分别转化到BL21(DE3)pLysS,挑取单菌落接种至5 mL LB氨苄液体培养基中,37 ℃培养过夜。次日,将菌液转接至新的LB培养基,37 ℃继续培养至OD600约0.8,加入终浓度为0.1 mmol/L的IPTG,16 ℃培养过夜。收集100 mL菌液,重悬于20 mL平衡缓冲液A(18 mmol/L NaH2PO4,2 mmol/L Na2HPO4,0.5 mol/L NaCl,pH 7.4),置于冰上超声破碎后14 000 r/min离心30 min收集上清。使用蛋白纯化系统AVANT(AKTA)纯化上清中蛋白。首先,用平衡缓冲液A平衡亲和层析柱HisTrpTMHP,上样之后分别用含有12%、20%、40%、100%的洗脱缓冲液B(18 mmol/L NaH2PO4,2 mmol/L Na2HPO4,0.5 mol/L NaCl,500 mmol/L咪唑,pH 7.4)进行梯度洗脱,收集样品进行SDS-PAGE检测。将目的蛋白透析除去高浓度咪唑后,用BCA试剂盒检测蛋白浓度。
1.4 Nus-Endo Tb的水解活性检测
初步反应以0.1 pmol的NGA2-Asn-Fmoc作为底物,加入150 ng蛋白酶液,100 mmol/L的醋酸缓冲液(pH 5.5),37 ℃反应1 h。进行反应温度优化时,反应温度分别为25~50 ℃,其他条件相同。进行pH优化时,所用缓冲液为100 mmol/L pH值为3.0~8.0的磷酸氢二钠-柠檬酸缓冲液,其他条件相同。在95 ℃加热5 min终止反应,然后在10 μL的反应体系中加入40 μL去离子水,高效液相色谱分析底物的转化率。检测条件:Shodex Asahipak NH2P-50 4E色谱柱,流动相为0.3%的醋酸铵溶于57%的乙腈,流速1 mL/min,洗脱25 min,激发波长265 nm,发射波长315 nm,柱温40 ℃,荧光检测器检测[10]。
1.5 Nus-Endo Tb底物特异性分析
以10 pmol不同的PA-糖链为底物,加入100~1 000 ng不等的蛋白酶液(调整使得每种底物转化率在20%左右),在100 mmol/L的磷酸缓冲液(pH 6.5)中30 ℃反应1 h,95 ℃加热5 min终止反应。在10 μL的反应体系中加入40 μL去离子水,高效液相色谱法分析其底物的转化率。所用色谱柱为Supelcosil LC18柱(2.1 mm×150 mm),流动相A为100 mmol/L醋酸-醋酸铵溶液,pH 4.0。流动相B为100 mmol/L醋酸-醋酸铵溶液,0.5%正丁醇,pH 4.0。5%~50%的流动相B线性洗脱25 min,流速为0.5 mL/min,在激发波长为320 nm、发射波长为400 nm的荧光条件下检测,柱温40 ℃[10]。
1.6 Nus-Endo Tb对糖蛋白的水解活性
分别以10 μg核糖核酸酶B和4 μg人类转铁蛋白作为糖蛋白底物,在20 μL反应体系中加入10 μg蛋白酶液,在100 mmol/L的磷酸缓冲液(pH 6.5)中30 ℃反应过夜。反应样品进行SDS-PAGE,经考马斯亮蓝染色后,脱色观察酶切效率。
1.7 Nus-Endo Tb的转糖基活性
在10 μL反应体系中,以100 μg唾液酸糖肽作为糖基供体,1.25 mmol/L MU-GlcNAc作为糖基受体,在100 mmol/L的磷酸缓冲液(pH 6.5)中,加入10 μg Nus-Endo Tb酶液和5 mU来源于灰色链霉菌(Streptomycesgriseus)的壳聚糖酶,在30 ℃分别反应15,30,45 min。各取5 μL反应液加入到96孔板中的250 μL甘氨酸缓冲液(150 mmol/L,pH 10.5)中混匀,在激发波长为355 nm,发射波长为460 nm的条件下读取荧光值。将10 μg Nus-Endo Tb酶液在95 ℃加热5 min使其灭活,同等条件下进行反应,作为阴性对照。
2 结果与分析
2.1 Endo Tb的基因克隆及表达纯化
通过数据库检索从布氏锥虫(Trypanosomabrucei)的基因组中找到了ENGase的同源序列,通过用Clustal Omegae软件进行序列比对,发现来源于布氏锥虫的氨基酸序列和GH85家族的ENGase高度保守,如图1-A(Endo-Tb的序列Tbr用黑色箭头标出)。在图1(左)中,高保守氨基酸用白色字体黑色方框表示,相似氨基酸用白色字体灰色方框表示。保守氨基酸E538和N536在Endo-M及其他ENGase中被证实分别是活性催化位点必需氨基酸和噁唑啉中间体形成的必需氨基酸[11-13](黑色星号标出)。在真核生物ENGases中高度保守的芳香族氨基酸已被报道是识别复合型糖链的必需氨基酸[14-15],如图1(右),在Endo-Tb中相应位点的苯丙氨酸也是芳香族氨基酸(黑色圆点标出),推测Endo-Tb有可能识别复合型糖链。
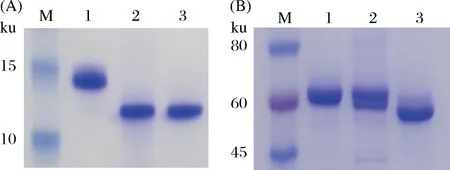
通过序列比对,确定Endo-Tb基因包含3个区域,分别为蛋白酶C97(6~146)区域[16],PUB(230~300)区域[17]和GH85 (453~699)区域。GH85区域是ENGase酶的功能区域,为了探究前两个区域的协助作用,本研究进行了截短型突变,其中FL为全长,D1截除了蛋白酶C97区域,D2截除了蛋白酶C97区域和PUB区域,如图1-B所示。将3个长度不同的基因连接到带有Nus融合蛋白的原核表达载体pET43a-10His-Nus上。将pET43a-10His-Nus-Endo-Tb (FL/D1/D2)分别在大肠杆菌BL21(DE3)pLysS中诱导表达,然后通过HisTrpTMHP亲和层析柱(GE)进行纯化,产量约为5 mg/L。Nus是一个61 kDa的蛋白标签,有助于增强融合蛋白的可溶性。Nus-Endo Tb (FL)融合蛋白大小为175 kDa,Nus-Endo Tb (D1)融合蛋白大小为159 kDa,Nus-Endo Tb (D2)融合蛋白大小为141 kDa。纯化结果如图1-C。可看出Nus-Endo Tb (D1)的纯度更高,无杂带,但Nus-Endo Tb (FL)和Nus-Endo Tb (D2)蛋白有略微降解。

A-ENGases GH85家族氨基酸序列比对。Spn-肺炎链球菌(Streptococcus pneumoniae);Apr-原玻璃蝇节杆菌(Arthrobacter protophormiae);Bha-耐盐芽孢杆菌(Bacillus halodurans);Cci-灰盖鬼伞(Coprinopsis cinereal);Omi-Ogataeaminuta;Mhi-冻土毛霉(Mucorhiemalis);Tbr-布氏锥虫(Trypanosoma brucei);Ath-拟南芥(Arabidopsis thaliana);Cel-秀丽隐杆线虫(Caenorhabditise legans);Hsa-现代人类(Homo sapiens)。B-Nus-Endo Tb (FL/D1/D2)蛋白的区域分布。Nus-pET43a表达载体上的融合蛋白标签;Peptidase C97,蛋白酶C97区域;PUB-PUB区域;GH85-糖苷水解酶85家族区域。C-SDS-PAGE分析纯化的融合蛋白Nus-Endo Tb(FL/D1/D2)。M-Marker;1,Nus-Endo Tb(FL);2-Nus-Endo Tb(D1);3-Nus-Endo Tb(D2)图1 Endo-Tb的基因构造和蛋白纯化Fig.1 Construction and purification of Endo-Tb
2.2 Nus-Endo Tb的水解活性检测
2.2.1 对NGA2-Asn-Fmoc的水解活性
以NGA2-Asn-Fmoc为底物,分别添加150 ng纯化酶液Nus-Endo Tb (FL/D1/D2),反应后通过高效液相色谱法检测到荧光产物GlcNAc-Asn-Fmoc(图2),说明3种蛋白酶液都可以水解NGA2-Asn-Fmoc中2个N-乙酰葡糖胺之间的β1-4糖苷键,验证了在Endo Tb基因的3个区域中GH85区域是酶的功能区域。由于在蛋白纯化之后获得D1的纯度明显高于FL和D2,而且在纯化之后对酶液存储的过程中,D1的酶液相对于FL和D2更稳定,不易出现降解和蛋白质沉淀,说明PUB区域对于维持酶的稳定性是有一定帮助的,所以本文最终选择只用含有PUB区域和GH85区域的D1进行后续的研究。
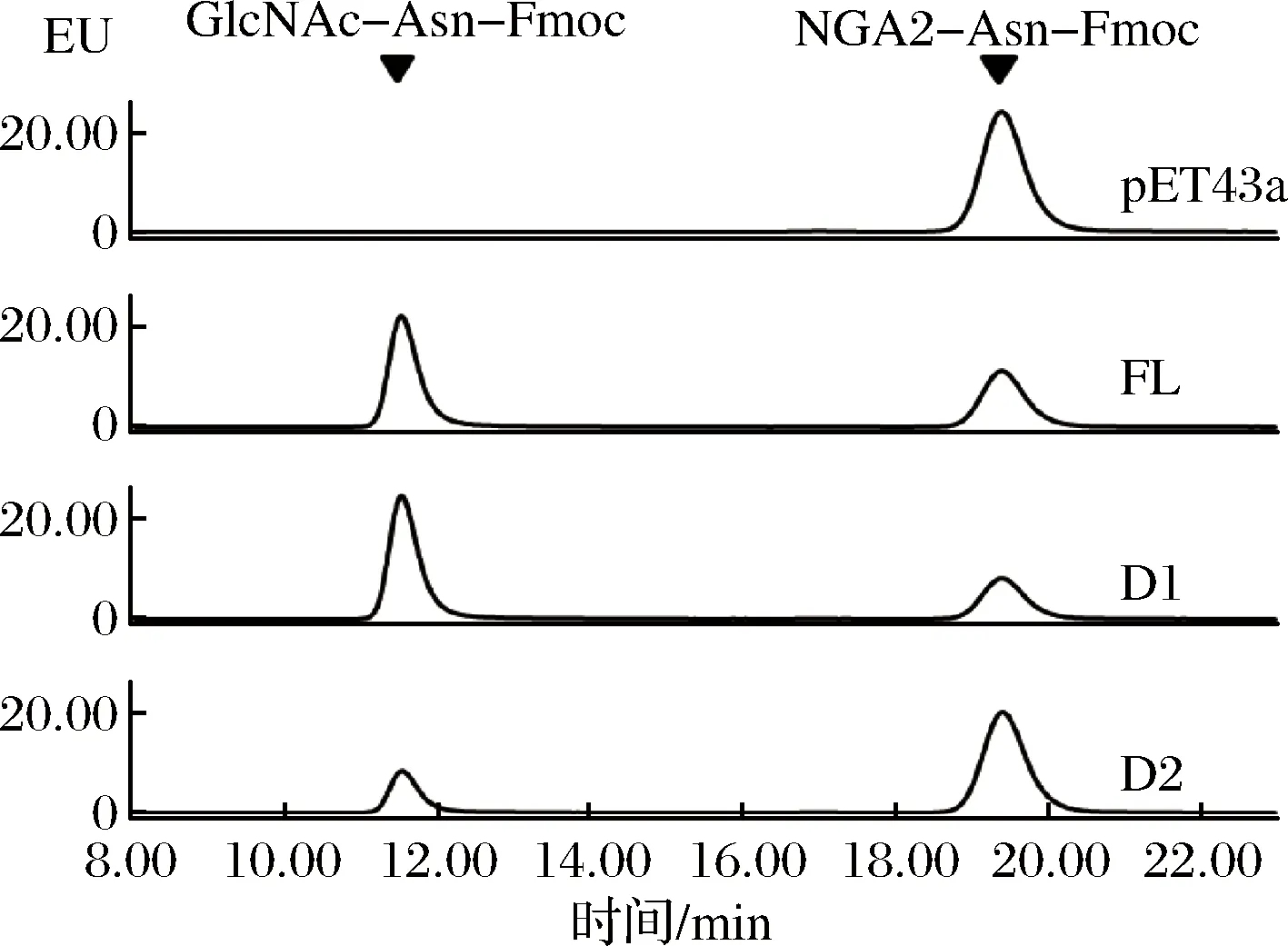
图2 HPLC检测 Nus-Endo Tb的水解活性Fig.2 HPLC analysis of hydrolysis activity of Nus-Endo Tb
2.2.2 温度和pH的优化
为了确定酶的最适反应温度,在温度25~50 ℃范围内,测定D1对NGA2-Asn-Fmoc的水解活性,以最大酶活力为100%,计算相对酶活力,结果如图3-A。当温度在25~35 ℃时酶活较稳定,温度大于35 ℃时酶的活性迅速下降,最适温度为30 ℃。然后在不同pH值的磷酸氢二钠-柠檬酸缓冲液中,测定pH值对酶活性的影响,以最大酶活力为100%,计算相对酶活力,结果如图3-B。当pH低于4.0时酶失活,pH在6.0~7.0之间酶活较稳定,当pH大于7.0酶活迅速下降,最适反应pH为6.5。
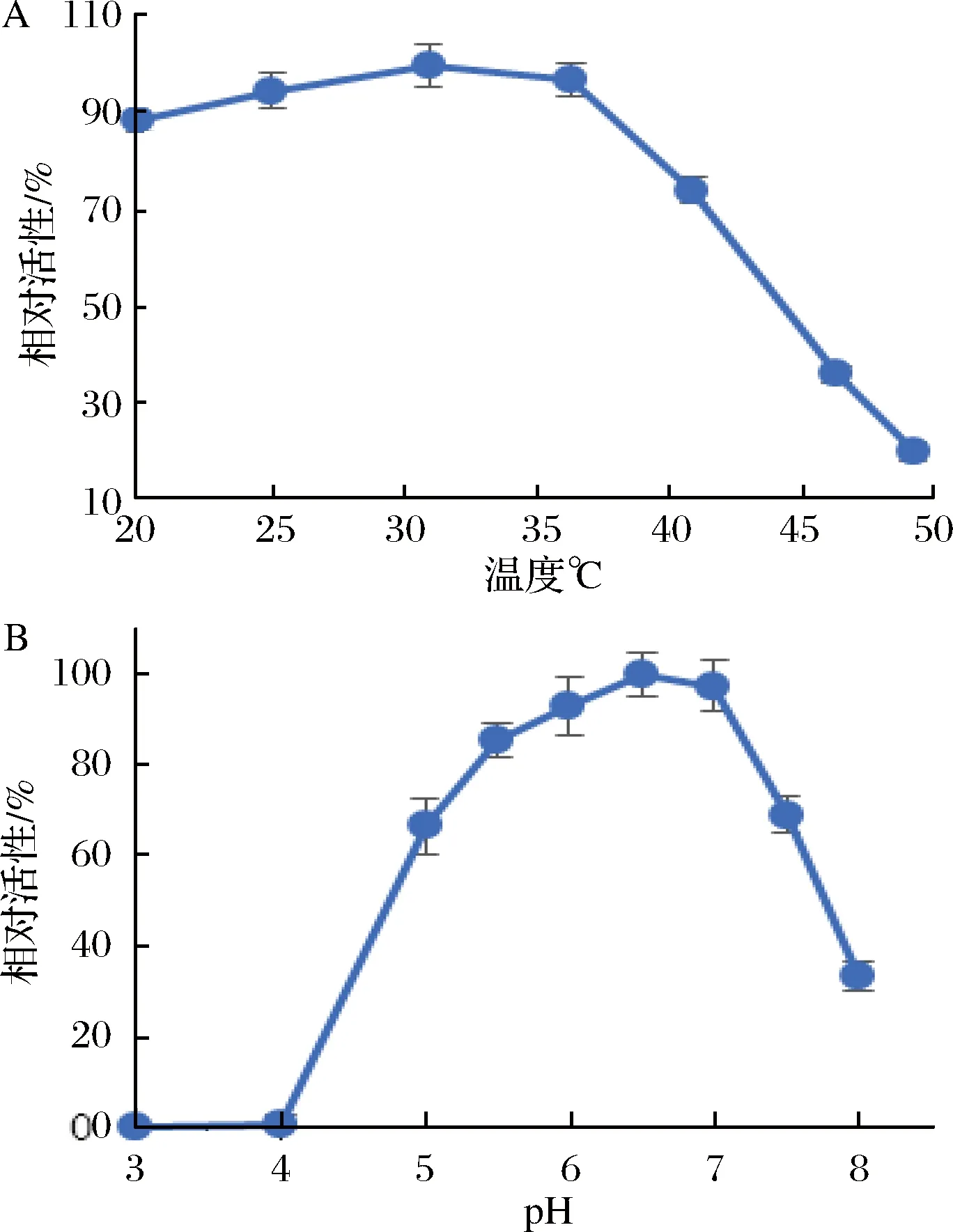
图3 温度和pH对酶活力的影响Fig.3 Optimization of temperature and pH
2.2.3 Nus-Endo Tb底物特异性分析
以各种结构的PA-糖链作为底物,添加不同浓度的Nus-Endo Tb (D1)酶液,使得底物转化率在20%左右,计算每种底物的比活力,然后以酶对三甘露糖核心结构的活力为100%,比较不同糖型相对于三甘露糖核心的相对活性。结果如表2中所示,Nus-Endo Tb (D1)对高甘露糖型的特异性更高,其中对7个甘露糖的糖链的活性最高,是三甘露糖核心的6倍以上,对6个甘露糖的糖链的活性是三甘露糖核心的4倍以上。但Nus-Endo Tb (D1)对短链的高甘露糖活性较低,对双天线复合型糖链的活性约为三甘露糖核心的一半,而且不能作用于三天线复合型糖链。

表2 不同PA-糖链的相对酶活Table 2 Relative activities toward various PA-sugar
注:ND,无活性;●,甘露糖;■,N-乙酰氨基葡萄糖。
2.3 Nus-Endo Tb对糖蛋白的水解活性
天然牛胰核糖核酸酶B的N-糖链类型是高甘露糖型,糖链从5个甘露糖到9个甘露糖不等。人类转铁蛋白的糖链是唾液酸化的双天线型和三天线型的寡糖。以天然牛胰核糖核酸酶B和人类转铁蛋白为底物,检测Nus-Endo Tb对糖蛋白的水解活性。以Endo-H和PNGase F作为对照,其中Endo-H可以切除高甘露糖中2个GlcNAc之间的连键,PNGase F可以水解N-糖蛋白中GlcNAc和天冬酰氨之间的连键,将糖蛋白上的糖链切除[18]。图4结果显示,Nus-Endo Tb可以完全切除核糖核酸酶B的高甘露型糖链,由于人类转铁蛋白含有三天线型寡糖,糖链不能被Nus-Endo Tb完全切除。
2.4 Nus-Endo Tb的转糖基活性
A-M-Marker;1-未处理RNase B;2-Nus-Endo Tb酶切RNase B;3-Endo-H酶切RNase B B-M-Marker;1-未处理transferrin;2-Nus-Endo Tb酶切transferrin;3-PNGase F酶切transferrin图4 核糖核酸酶B和人类转铁蛋白的水解Fig.4 Digestion of the N-glycan from RNase B and transferrin
来源于灰色链霉菌(Streptomycesgriseus)的壳聚糖酶,作为一种糖苷内切酶,可以水解GlcNAc2-MU中的荧光基质底物四甲基伞形酮[19],但是不能水解N-糖链中的核心壳二糖,也不能水解MU-GlcNAc中的四甲基伞形酮[20]。以SGP作为糖基供体,MU-GlcNAc作为糖基受体,首先SGP在Nus-Endo Tb的作用下发生水解,接着Nus-Endo Tb(D1)将水解后的糖链转移到MU-GlcNAc受体上,壳聚糖酶可以水解掉GlcNAc2-MU中的荧光基质底物MU,MU在碱性条件下变构,在365 nm激发光照射下,发出460 nm发射光,根据荧光值的强度,可以检测到Nus-Endo Tb转糖基活性的大小。将这个Nus-Endo Tb(D1)和壳聚糖酶同时作用的复合酶反应体系,在30 ℃分别反应15,30,45 min,用pH 10.5甘氨酸缓冲液终止反应。通过MU的荧光值检测到在反应的初始阶段反应速度较快,30 min之后趋于平衡。以高温灭活的Nus-Endo Tb作为阴性对照,相同条件下可以检测到轻微荧光值,说明壳聚糖酶对荧光底物MU-GlcNAc具有轻微的水解作用,当Nus-Endo Tb存在时显著增长的荧光值验证了Nus-Endo Tb的转糖基活性。
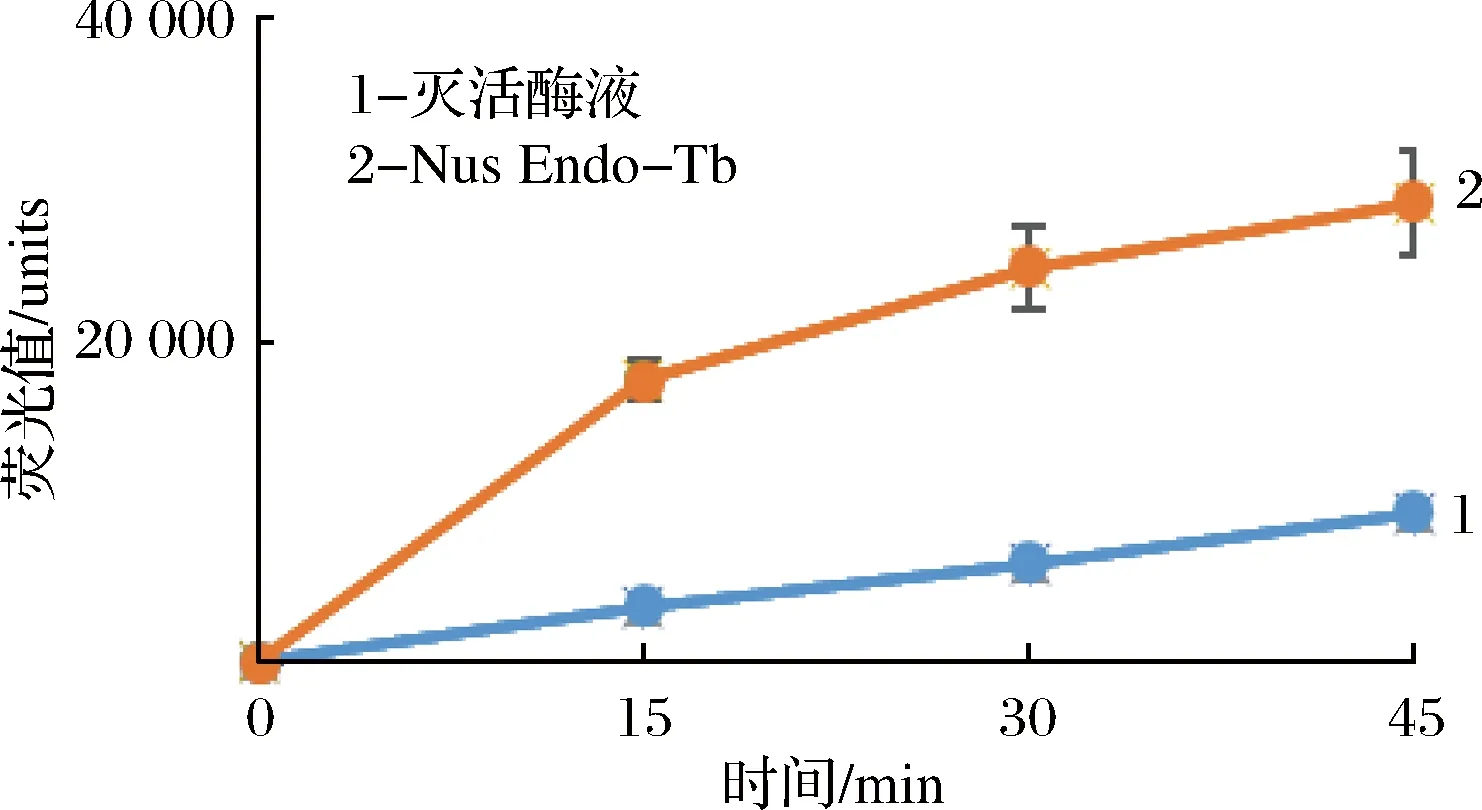
图5 Nus-Endo Tb的转糖基活性Fig.5 transglycosylation activity of Nus-Endo Tb
3 讨论
在本研究中,发现了一种新的来源于布氏锥虫(Trypanosomabrucei)的ENGase,实现了在大肠杆菌中的大量表达。在前期的工作中,曾尝试通过His标签纯化Endo-Tb蛋白,但由于蛋白表达量很低,而且容易降解,难以纯化。后来尝试pET系统的不同载体及标签,最后在pET43a载体上通过与N端的Nus标签融合表达,大大提升了蛋白的表达量和稳定性,成功纯化出Nus-Endo Tb融合蛋白。后来尝试切除Nus标签,但切除后发现蛋白的稳定性降低,所以选择使用融合蛋白进行后续的实验。
在Endo-Tb基因的全长序列中包含3个区域,即GH85区域之前还含有蛋白酶C97和PUB两个区域。后来通过比较,发现PUB区域有利于维持蛋白的稳定性,减少蛋白质的降解。通过检测水解活性以及底物特异性,Nus-Endo Tb能够作用于高甘露糖型和复合型糖链,对含有7个甘露糖的糖链活性较高,其次是含有6个甘露糖的糖链,但是对三天线的杂合型糖链无活性。然后以天然牛胰核糖核酸酶B和人类转铁蛋白作为底物,检测Nus-Endo Tb对糖蛋白的水解活性,Nus-Endo Tb对含有高甘露糖链的核糖核酸酶B的活性相对较高。当用唾液酸糖肽作为糖基供体,GlcNAc-MU作为糖基受体,通过来源于灰色链霉菌(Streptomycesgriseus)的壳聚糖酶的作用,在这个复合酶体系中,检测到Nus-Endo Tb的转糖基活性。
由于Nus-Endo Tb水解活性很高,转糖基产物很快就被自身再次水解,所以通过其他方法难以检测到转糖基产物。在后续的研究中,还需要寻找一些能够提高Nus-Endo Tb转糖基活性的突变体,同时通过化学法合成合适的糖基噁唑啉作为糖基供体[21],实现化学酶法合成新的糖肽和糖蛋白。
