不同水解度猪骨蛋白水解物对水包油型乳状液乳化特性的影响
2018-08-31刘昊天李媛媛汪海棠孔保华
刘昊天,李媛媛,汪海棠,孔保华*
乳状液是由一种液体以液滴的方式分散在另一种与其不相溶的液体中所组成的非均相体系[1]。乳状液一般分为水包油(O/W)与油包水(W/O)两种类型,这两种类型的乳状液被广泛的应用于化妆品、护肤品,以及制药业,但前者在食品领域中应用的更为广泛[2]。乳状液一经形成,随后在预期的货架期内使其保持稳定是至关重要的。乳状液的分层,絮凝和聚集等机制都会对乳化体系的稳定性造成破坏[3]。而许多蛋白质是表面活性物质,可以作为乳化剂应用于乳状液的制备中,因为在其多肽链上含有许多具有亲水性和疏水性的氨基酸,它们可以吸附到油水界面上并包裹由均质化所形成的油滴[4]。同时因为它们含有带负电(—COO-)以及带正电荷(—NH3+)的氨基酸,因此可以产生静电斥力,起到稳定液滴、防止聚集的作用[5]。
动物鲜骨是畜禽屠宰加工中主要的副产品,约占胴体的10%~15%[6]。鲜骨中含有许多营养物质,如矿物质、蛋白质、脂肪、磷蛋白和磷脂质等,蛋白质约占总体营养成分的11%~15%,其中90%为骨胶原及软骨素。我国是畜肉生产大国,以往的加工过程中主要对象是肉类,而其副产物往往被忽视,大量的畜禽骨骼得不到利用或者加工产品价值低,从而使得资源浪费并造成了一定的环境压力。国内外针对畜禽骨骼的加工主要是将其制成骨粉用作动物饲料,以及提取营养元素应用于保健食品中,此外,近年来有利用骨蛋白酶解产物制备功能性多肽的研究。酶法水解条件温和,通过酶水解可以提高蛋白质的溶解度并使其位于内部的功能性基团更好地暴露出来。刁静静等[7]研究表明通过酶解处理可将短时间加热处理或一般加工温度难以利用的骨胶原蛋白水解成多肽及L-氨基酸以此来提高其营养价值。刘骞等[8]对不同水解度的猪血浆蛋白的抗氧化能力进行了研究,结果表明猪血浆蛋白水解物的抗氧化能力随着水解度的提高而显著增强,Xu Xingfeng等[9]的研究发现水解天然谷蛋白会改善其乳化活性(emulsion activity index,EAI)和乳化稳定性(emulsion stability index,ESI),并且适度水解的谷蛋白水解物具有最高的物理稳定性。李媛媛等[10]利用碱性蛋白酶对玉米蛋白进行水解,探讨了水解后玉米蛋白乳化能力及抗氧化能力提高的机制,为制备乳化能力高且具有一定抗氧化能力的玉米蛋白水解物提供一定的理论参考依据。
目前,现有关于酶水解的研究主要集中在单相(溶液)体系中,缺乏在多相体系中的深入探讨,因此本实验以不同水解时间为出发点,对不同水解度的猪骨蛋白水解物(porcine bone protein hydrolysates,PBPH)在乳化体系中的作用机理进行探讨,优化出可以应用于乳状液体系中的PBPH乳化性的平衡点,探讨不同水解度的PBPH增强乳化性的作用机制,以此提高猪骨蛋白利用价值并为后续其在乳化体系中的应用提供数据基础。
1 材料与方法
1.1 材料与试剂
猪腿骨 北大荒肉业有限公司;碱性蛋白酶Alcalase 丹麦Novo公司;邻苯二酚紫、菲啰嗪、Ans-荧光探针 美国Sigma公司;九三一级大豆色拉油九三粮油工业集团有限公司;磷酸氢二钠、磷酸二氢钠、硫酸铜、氢氧化钠、十二烷基硫酸钠(sodium dodecyl sulfate,SDS);过硫酸钾、盐酸、亚硫酸钠、氯化亚铁、三氯乙酸、硫代巴比妥酸、3%过氧化氢等均为国产分析纯。
1.2 仪器与设备
FE20K型pH计、AL-104型精密电子天平 上海梅特勒-托利多仪器设备有限公司;DK-8B电热恒温水浴锅上海精宏实验设备有限公司;JB-2恒温磁力搅拌器上海雷磁新径仪器有限公司;722可见光分光光度计上海第三分析仪器厂;XW-80A涡旋混合器 上海精科实业有限公司;FD-2A冷冻干燥机 北京博医康试验仪器有限公司。
1.3 方法
1.3.1 猪骨蛋白的制备
剔除猪腿骨上的非骨物质(肉、皮、骨膜等),将骨骼粉碎至1~2 cm3,在室温下将骨碎片以10%的比例置于0.6 mol/L盐酸溶液中浸泡24 h以除去钙、磷等有机成分,浸泡结束后用自来水冲洗骨碎片,再将骨碎片移至0.1%的氢氧化钙中浸泡至骨碎片呈现洁白色时,用稀盐酸将骨碎片pH值调节至7,再用清水清洗除去杂质,将处理过的骨碎片在90 ℃煮制5~6 h,过筛后再除去油脂得到骨胶溶液,再将骨胶溶液进行冷冻干燥,所得骨蛋白粉利用双缩脲法测量蛋白含量。
1.3.2 不同水解度PBPH的制备
参照刁静静等[7]的方法并稍作修改。将制备好的猪骨蛋白粉配制成底物质量分数为7%的蛋白溶液,置于初始温度为25 ℃的水浴中进行加热并将溶液的pH值调节至9.0,当温度达到50 ℃时,加入碱性蛋白酶,使酶与底物质量比为1∶100,再进行振荡水解,水解时间分别为0、1、2、3、4 h和5 h,反应过程中不断加入1 mol/L的NaOH溶液使pH值保持恒定,记录耗碱量,用于水解度的计算。水解结束后将溶液pH值调至7.0,之后将温度升高至95 ℃,保持10 min使酶灭活。所得溶液在4 ℃ 、5 000×g离心15 min,经双缩脲法测定蛋白含量后,取上清液进行真空冷冻干燥得到冻干粉,用于各项指标的测定。
1.3.3 水解度的测定
水解度的测定采用pH-stat法[11],水解度的计算公式如下:

式中:DH为水解度/%;h为单位质量蛋白质中被水解的肽键的量/(mmol/L);htot为单位质量蛋白质中肽键的总量/(mmol/L),骨蛋白htot为11.1 mmol/L;B为水解过程中的耗碱量/mL;Nb为碱液浓度/(mol/L);MP为水解液中蛋白质质量/g;1/α为校正系数(碱性蛋白酶为1.01)。
猪骨蛋白经过0、1、2、3、4、5 h的水解所得到的水解度经过计算分别为0%、5.6%、7.8%、11.1%、14.3%、17.2%。
1.3.4 不同水解度PBPH乳化性质的测定
1.3.4.1 EAI及ESI的测定
参照Pearce等[11]的方法并稍做修改,取8 mL 1 mg/mL PBPH溶液加入2 mL一级大豆色拉油于直径2.5 cm的离心管中,内切式匀浆机17 500 r/min匀浆2 min,匀浆后立即从离心管底部0.5 cm处取样0.5 μL,用0.1% SDS溶液稀释100 倍,振荡混匀后以SDS溶液作为空白,读取样品在500 nm波长处的吸光度记作A0,样品放置10 min后再次在相同位置取匀浆液50 μL,重复上述步骤记录A10。样品的EAI和ESI分别通过下列公式进行计算:
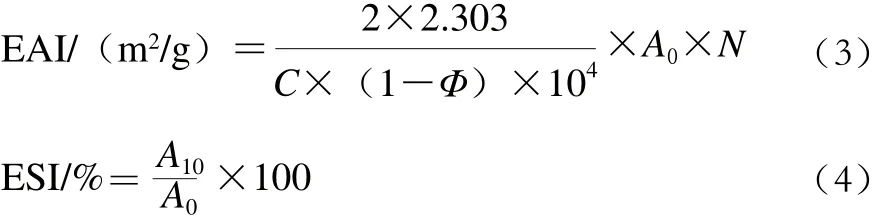
式中:C为样品质量浓度/(g/L);Φ为油相比例;A0为样品初始吸光度;N为稀释倍数;A10为样品放置10 min后的吸光度。
1.3.4.2 表面疏水性的测定
参照Xu Xingfeng等[9]的方法,使用1-苯胺基-8-萘磺酸盐(1-anilino-8-naphthalenesulfonate,ANS)作为疏水荧光探针。样品溶液用10 mmol/L磷酸盐缓冲液(pH 7.0)稀释至质量浓度范围为0.01~0.1 mg/mL。将20 μL 8 mmol/L的ANS溶液加入到2 mL的样品溶液中,并在室温及避光条件下反应20 min。利用荧光光谱仪测量不同浓度样品的荧光强度,激发波长与发射波长分别为390 nm与470 nm。在通过线性回归分析计算不同浓度对应不同荧光强度的初始斜率。
1.3.4.3 Zeta电位和粒径的测量
参照Yin Baoru等[12]的方法并稍作修改,取均质后的乳状液50 μL,利用0.1 mol/L、pH 6.5的磷酸盐缓冲溶液将其混匀稀释100 倍,在注入到弯曲毛细管中,在常温下使用Malvern激光粒度仪测定出含有不同水解度PBPH乳状液的Zeta电位与粒径。
1.3.4.4 光学显微镜观察
使用光学显微镜对不同水解度的PBPH制备的乳状液进行微观结构观察,取1.3.4.1节中均质后的乳状液7 μL于载玻片上,然后盖上盖玻片后,在XPS-8C型光学显微镜下,在SP 40/100的物镜下,观察样品,进行显微照片的拍摄。
1.3.5 蛋白质相对分子质量分布的测定
采用Sionkowska等[13]的方法并作适当修改,将冻干所得的不同水解度的样品分散于含0.3 mol/L NaCl的50 mmol/L磷酸钠缓冲液(pH 7.0)中,配制成最终质量浓度为1 mg/mL的蛋白溶液。10 000×g离心10 min,取上清液过滤膜,孔径为0.45 μm,利用Water 2690型液相色谱系统进行相对分子质量分布的测定,流动相为磷酸钠缓冲液。色谱柱为Shodex protein KW-804型(300 mm×8 mm,7 μm),检测器为Waters 996光电二极管阵列检测器,紫外检测波长280 nm,流速1 mL/min,柱温25 ℃。标准蛋白用Marker(分子质量为6.5~200 kDa)进行校正,并绘制标准曲线。
1.4 统计分析
每个实验重复3 次,结果表示为 ±s。数据统计分析采用Statistix 8.1(分析软件,St Paul,MN)软件包中Linear Models程序进行,差异显著性(P<0.05)或差异极显著性(P<0.01)分析使用Tukey HSD程序,采用Sigmaplot 12.5软件作图。
2 结果与分析
2.1 不同水解度PBPH的乳化性质
2.1.1 EAI及ESI
从表1可知,猪骨蛋白经过水解处理后EAI与ESI显著提高,并且随着水解度的增高呈现先升高后降低的趋势(P<0.05),在水解度为11.1%时表现出较好的EAI和最高的ESI。乳状液体系是一种多相体系,并且液滴有自发结合以降低体系总界面自由能的倾向,Hou Zhanqun等[14]研究表明界面张力越低,乳状液越稳定。因此,为了减少这种不稳定程度,就需要降低油水界面的张力,使乳化剂快速吸附到油水界面上,增加乳状液的稳定性。由于经过水解后多肽链数量增加,PBPH分子柔性增加并且构象迅速发生变化,使得亲水基延伸至水相,疏水基延伸至油相从而快速的吸附到油-水界面上以此来降低界面张力,因此经过水解处理会提高PBPH的EAI和ESI[15]。但是水解度7.8%的样品EAI高于11.1%的样品,其ESI却低于11.1%的样品,可能是由于11.1%的PBPH的表面疏水性较大,所以在乳状液均质过程中的高速旋转可能会导致由疏水相互作用所引起的部分蛋白质絮凝,使得粒径稍大于7.8%的样品,从而影响到EAI的测定结果,但经过放置后,11.1%的样品较之其他水解度的样品是趋于稳定的,而水解度为7.8%的样品会由于静电排斥力(表面电荷),空间位阻效应(界面膜厚度、表面疏水性、吸附能力)等机制的影响而发生部分液滴的聚集,使得ESI低于水解度为11.1%的PBPH。而对于水解度为14.3%和17.2%样品而言,随着水解时间延长,水解度增大,维持蛋白质的内部结构力(氢键、范德华力、离子键等)遭到破坏,使得液滴表面的界面膜变薄,增大了其界面张力,进而导致PBPH的EAI与ESI的降低[16]。Xu Xingfeng等[9]的研究表明,水解时间较短的蛋白质水解物在均质期间可以快速吸附到油滴表面上并能有效防止液滴间的聚集,表现出很高的乳化能力,这与本实验水解时间3 h,相应水解度为11.1%的PBPH样品的ESI最好的研究结果一致。Cheng Yu等[17]对马铃薯蛋白水解物的乳化性进行研究,结果表明,过度水解所得到的小肽或者肽段可能不是两性分子,不能很好地吸附于油水界面,因此乳化性较差,这进一步证明了水解度为17.4%的样品乳化性降低的原因。
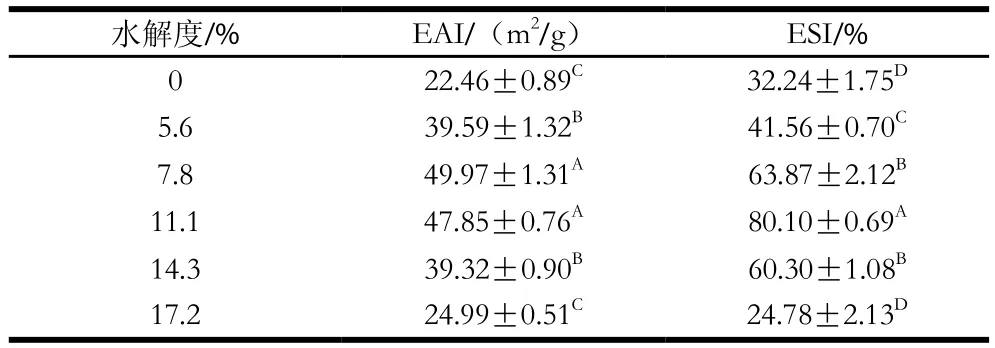
表1 水解度对PBPH的EAI和ESI的影响Table 1 Effects of different degrees of hydrolysis on EAI and ESI of porcine bone protein hydrolysates
2.1.2 表面疏水性分析
蛋白质的表面疏水性对蛋白质的构象及其功能性质有着非常重要的作用,对于高分子化合物为乳化剂的乳状液体系来说通过空间稳定作用液滴表面的高分子吸附层可以阻止液滴间的相互碰撞和聚合,增加乳状液的稳定性[18]。在乳化体系中,空间稳定作用的强度通常随着界面层的厚度以及疏水性的增加而增加[5],这也就意味着表面疏水性越高,其空间稳定作用力越强。因此为观察不同水解度的PBPH在油滴上的吸附效果,本实验测定表面疏水性的变化趋势,结果见图1。
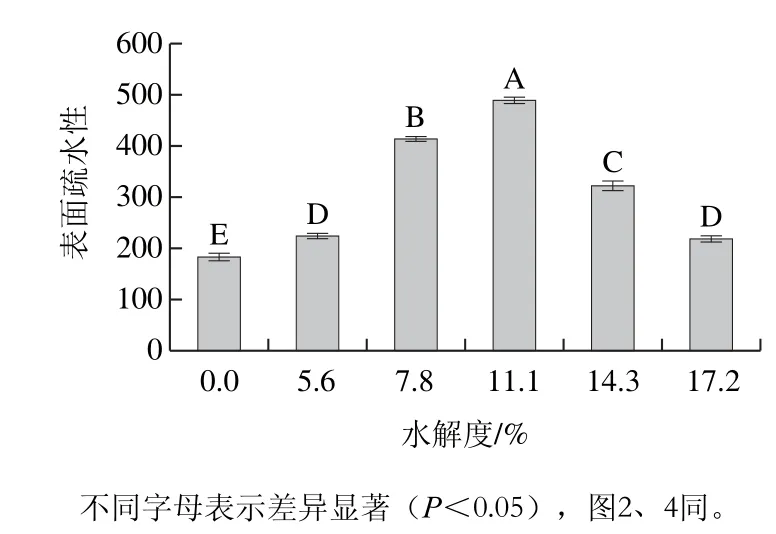
图1 不同水解度对PBPH表面疏水性的影响Fig. 1 Effects of different degrees of hydrolysis on surface hydrophobicity of porcine bone protein hydrolysates
由图1可以观察到,不同水解度的PBPH的表面疏水性随着水解度的增加呈现先增加后降低的变化趋势(P<0.05),未经水解的猪骨蛋白的表面疏水性仅为182.25,而经过水解后,水解度为5.6%、7.8%、11.1%、14.3%、17.2%的PBPH的表面疏水性分别增加至223.18、413.39、488.15、321.49、218.28。其中水解度为11.1%的样品显示出最高的表面疏水性,与未经水解的猪骨蛋白相比其表面疏水性增长到近3 倍。在适度水解条件下,PBPH的表面疏水性与未水解的样品相比显著增加,这可能是由于适度水解后,蛋白质内部结构发生分解,β-折叠结构展开,使包埋在蛋白质内部的疏水性位点暴露出来,因此增加了蛋白水解物的表面疏水性[19]。但当水解达到一定程度时表面疏水性会降低,导致这一现象的原因可能有两点:一是由于水解时间过长,蛋白质的疏水区域被破坏导致表面疏水性的降低;二是由于水解度的增加提高了PBPH的表面疏水性,表面疏水性的增加会使PBPH间的疏水相互作用增强,当疏水相互作用达到一定程度时,蛋白质之间会发生聚集形成蛋白质-蛋白质复合物,复合物的形成会掩盖之前暴露出来的疏水性位点,从而降低了PBPH的表面疏水性[19]。可以发现不同水解度的表面疏水性的变化趋势与ESI的测定结果基本一致,因此可以认为PBPH的表面疏水性的大小与ESI之间存在正相关的关系,这是由于蛋白质表面疏水性的增加,增大了其在油滴上的吸附能力,使疏水基团快速延伸至油相,蛋白质更加快速、致密地吸附到油滴上从而形成带电界面层,提高了界面处的蛋白质浓度,从而达到了降低表面张力、稳定乳状液的目的[1]。但由于11.1%的PBPH具有相对较高的表面疏水性,因此在乳状液均质期间可能会发生由疏水相互作用所导致的部分蛋白质的聚集,进而造成EAI的降低。
2.1.3 Zeta电位分析
在乳状液体系中,相对于空间稳定作用,静电相互作用也同样是一种维持乳状液稳定的一种重要的作用力[20],静电相互作用的存在可以有效防止由范德华力及疏水相互作用所导致的液滴间的聚集,以此来稳定乳状液。Zeta电位绝对值的大小是衡量静电相互作用程度的重要指标,因此Zeta电位与乳状液的物理稳定性具有正相关性,可以作为评定乳状液物理稳定性的一个重要指标。Zeta电位的测定结果如图2所示,无论是未水解的猪骨蛋白还是经过水解的猪骨蛋白,所制备的乳状液都显示为高度负电,这是由于此时pH值处于中性,H+浓度较高,羧基(—COOH)和氨基(—NH3+)没有发生质子化,导致负电荷的产生[21]。随着水解时间的延长,水解度增大,Zeta电位的绝对值呈现先增高后降低的趋势(P<0.05),水解度为11.1%的样品组显示带有最高的净负电荷。这就进一步解释了在此水解度条件下具有较高ESI的原因。水解后的PBPH样品显示出相对较高的静电荷是由于猪骨蛋白经过水解后,蛋白结构发生改变,使得更多的极性基团暴露出来,增加了其表面电位[22]。随着水解度的增加,Zeta电位的降低可能与表面疏水性过高所引起的蛋白质间的聚集有关,随着水解的进行,PBPH相互聚集形成复合物,复合物吸附在界面处,包埋了界面蛋白所暴露出的极性基团从而导致表面电位的降低。
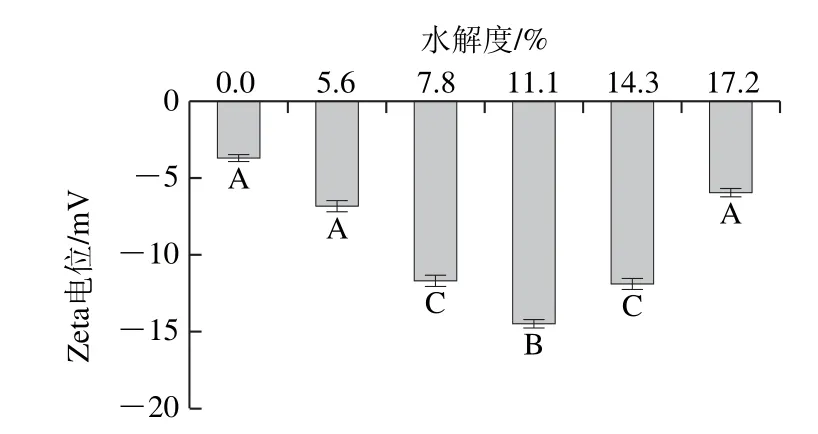
图2 不同水解度对PBPH乳状液Zeta电位的影响Fig. 2 Effects of different degrees of hydrolysis on zeta potential of porcine bone protein hydrolysates in emulsion
2.1.4 粒径与乳状液光学显微镜结果
为进一步分析不同水解度PBPH的乳化能力,测定不同水解度PBPH制备的乳状液的光学显微结果见图3,比表面积平均粒径见图4。随着水解度的增加,粒径的变化呈现先降低后增加的趋势(P<0.05),水解度为11.1%的PBPH显示出最小的平均粒径,这表明在适度水解条件下PBPH能够在乳化过程中更快速地吸附到液滴表面形成带电界面层,降低界面张力从而有效防止液滴的聚集,所形成的乳状液稳定性较好。Li Yuanyuan等[23]对利用玉米蛋白水解物所制备的乳状液进行了激光共聚焦的观察,发现蛋白质可以吸附到油水界面上并在油滴周围形成一层带电蛋白质薄膜,从而增加界面膜的厚度。此外,Wooster等[24]研究表明在乳清蛋白质作为乳化剂的水包油乳状液中,蛋白质形成较厚的界面膜的同时可以和碳水化合物通过空间位阻效应有效降低乳状液的絮凝和聚集。多肽所形成的界面膜是不需要通过非共价相互作用的聚集体[25]。He Dong等[26]研究表明静电相互作用是这一过程中的重要作用力,强烈的静电相互作用力与疏水键以及氢键一起作用会促使多肽链聚集在乳状液液滴表面最终形成界面膜,而本实验结果表明未经过水解的猪骨蛋白的表面疏水性和表面电位较低,所以其吸附到液滴表面的能力较差,所形成的乳化液滴界面膜薄而不均,EAI与ESI较差。而经过适当水解的猪骨蛋白吸附性较好,形成的界面膜致密而均匀,可以很好地防止液滴间的聚集及降低界面张力,所制备的乳状液的平均粒径较小,因此EAI与ESI较高[1]。这也进一步说明了表面电位、表面疏水性与平均粒径之间的相互关系。而随着水解度的提高,平均粒径变大原因同样与蛋白质-蛋白质复合物的形成及油滴间的聚集有关,这与之前表面疏水性的研究结果形成了对应。
为更直观地观察用不同水解度的PBPH所制备乳状液的乳化效果,采用光学显微镜对放置10 min后的不同水解度PBPH所制备的乳状液进行液滴大小及分布情况的微观观察(图3)。未经过水解的猪骨蛋白所制备的乳状液的液滴粒径较大,且分散不均匀,部分还具有聚集的趋势,而由于水解后提高了猪骨蛋白的乳化能力,因此所形成的乳状液的液滴粒径明显变小,具体的液滴大小及分散情况与水解度有关,总体趋势与粒径的测定结果相符。利用PBPH制备的乳状液其液滴大小随着水解度增加呈现先减小后增大的趋势(P<0.05),在适度水解条件(11.1%)下液滴粒径相对较小且分散均匀,而水解度过高时(14.3%和17.2%)液滴分散不均匀,粒径变大并有聚集的趋势,此时乳液的稳定性较差。这与之前平均粒径以及ESI的测量结果相吻合。

图3 不同水解度PBPH制备的乳状液的光学显微照片Fig. 3 Optical photomicrographs of emulsions prepared with porcine bone protein hydrolysates with different DHs
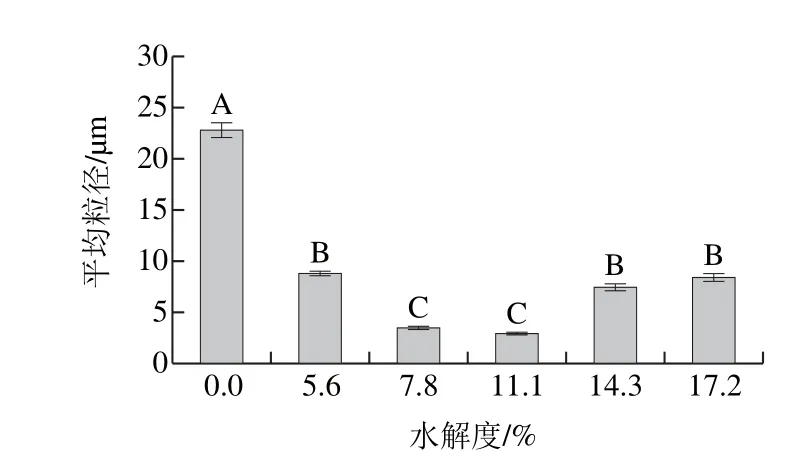
图4 不同水解度PBPH制备的乳状液比表面积平均粒径Fig. 4 Specific surface area average particle size of emulsions prepared with porcine bone protein hydrolysates with different DHs
2.2 PBPH的相对分子质量分布
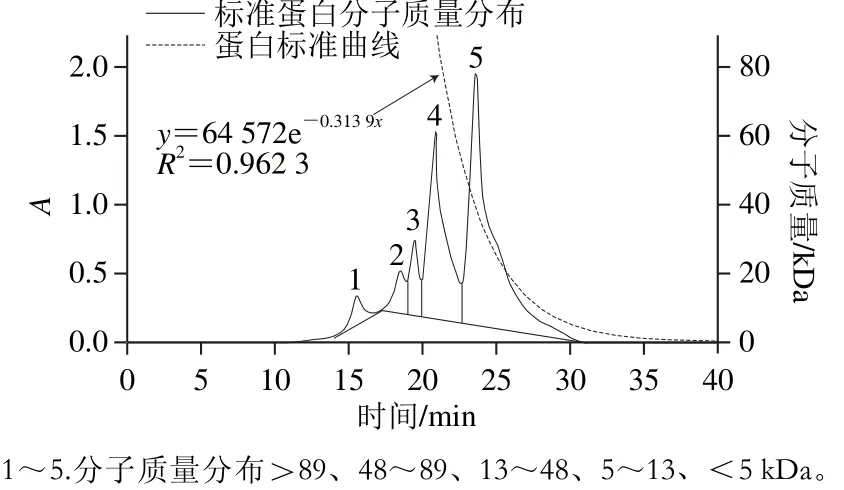
图5 蛋白标准曲线与标准蛋白分子质量分布图Fig. 5 Standard curve of molecular mass and molecular mass distribution of protein marker
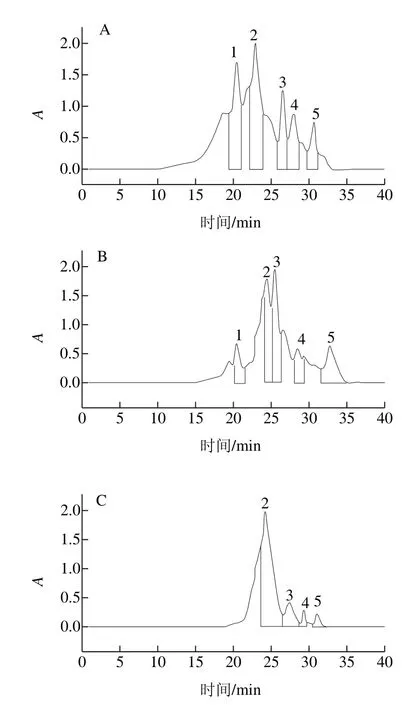
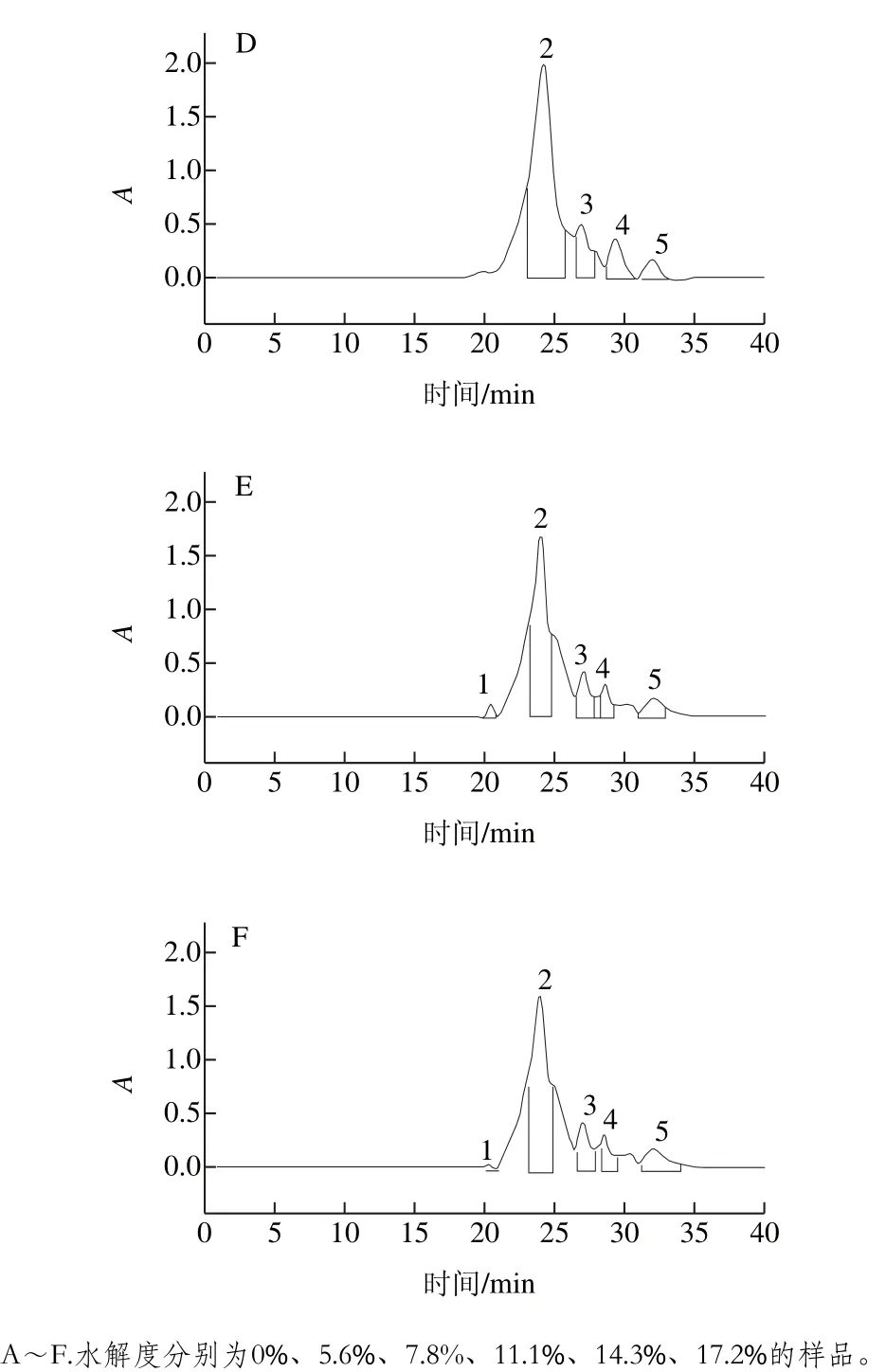
图6 不同水解度对PBPH分子质量分布的影响Fig. 6 Effect of different degrees of hydrolysis on molecular mass distribution of porcine bone protein hydrolysates
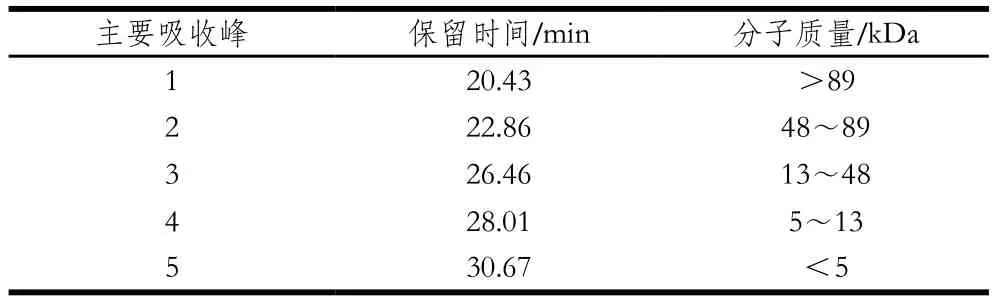
表2 不同吸收峰的保留时间与分子质量分布Table 2 Retention times and molecular mass distribution of different absorption peaks
为观察不同水解度的PBPH分子质量分布情况的变化,采用分子排阻色谱对其分子质量分布进行测定。蛋白标准曲线与标准蛋白分子质量分布图见图5,不同水解度的PBPH的凝胶色谱图见图6。未经水解的猪骨蛋白的分子排布图显示出了5 个主要吸收峰,具体见表2。通过图6可以观察到,与未水解的猪骨蛋白图谱相比,随着水解度的增加,峰1逐渐减少直至消失,而在保留时间23~27 min之间相继出现较强的谱峰吸收并不断积累,说明大分子肽在反应过程中易于解聚,并且分离的单体被碱性蛋白酶专一切割成较为集中的片段组成(23~27 min),并不断有小分子肽段(>31 min)生成[27]。
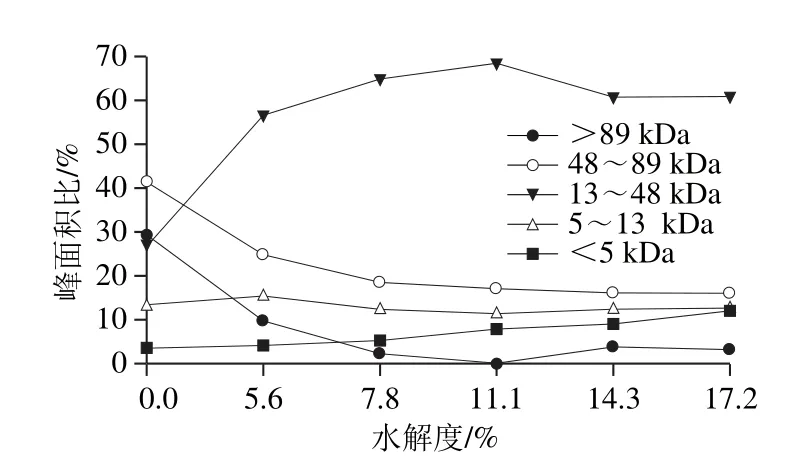
图7 不同水解度对水解猪骨蛋白分子质量分布的影响Fig. 7 Percentage peak areas obtained with high-performance size exclusion chromatograph for porcine bone protein hydrolysates with different DHs
由图7可见,从反应进程看,随着水解度的增加,大分子肽(>89、48~89 kDa)的所占比例迅速减少,小分子比例不断增加,当水解度达到11.1%时,分子质量高于89 kDa的肽段消失,而水解度进一步增加时又有小部分大分子肽生成,说明此时发生了蛋白质的聚集。而13~48 kDa的肽段起初随着水解度的增加而增加,当达到一定程度时会降低,说明水解过程中既有多肽链的断裂,同时也伴有蛋白质的聚集,二者是交互进行的[28]。结合前面的实验结果,即水解度为7.8%与11.1%时的乳化性较好,此时13~48 kDa肽段所占比例较高,水解度为11.1%时乳化性达到了最大(68.47%),说明此范围的肽段对乳化性的提高有着重要的作用[29]。分子质量在5~13 kDa范围的肽段总体呈现上下浮动的变化且涨落较小,也就是说其降解速率接近生成速率,说明这段范围内的分子间存在高度偶联且相互制约的关系[30]。分子质量低于5 kDa的小肽含量随着水解度的增大而显著增加,这是由于猪骨蛋白的空间结构较为松散,易于降解以及碱性蛋白酶的高度专一性的切割特点所致。
3 结 论
本实验以不用水解时间为出发点,对不同水解度PBPH在乳化体系中的作用机制进行探讨,结果表明PBPH的乳化特性受水解度的影响,对比未经水解的猪骨蛋白,PBPH的EAI、ESI、表面疏水性、Zeta电位,均得到显著提高,并随着水解时间和水解度的增大,呈先增加后降低的趋势,水解度为11.1%的PBPH表现出最好的乳化能力,并具有最小粒径及最均匀的液滴分布。总之,水解处理可以显著提高猪骨蛋白在乳化体系中的乳化能力,并且水解时间为3 h,水解度11.1%的PBPH作为天然乳化剂可以有效提高食品乳状液体系的物理稳定性。
