原发性肝细胞肝癌YAP、FOXP1 mRNA的表达及对患者预后的影响
2018-08-30尹必辉李怀亮侯卫晓周益龙邵冰峰张素青徐爱兵张一心
陈 橼,周 元,尹必辉,李怀亮,侯卫晓,周益龙,邵冰峰,张素青,徐爱兵,张一心*
1.南通大学附属肿瘤医院外科,南通 226300 2.南通大学医学院研究生院临床医学系,南通 226019
肝癌在我国发病率居恶性肿瘤的第4位,死亡率居第3位[1],其中原发性肝细胞肝癌(HCC)占85%~90%以上。南通地区位于江海平原,是乙型肝炎高发地区,大多数患者就诊时病变已属中晚期,如何早期监测肝癌的发生成为关键。目前认为,致癌基因的激活与肿瘤发生发展密切相关,抑制癌基因的高表达可以防止正常细胞向恶性转化,甚至可使恶性肿瘤细胞向正常方向逆转,从而达到治疗肿瘤的目的[2]。Yes-associated protein(YAP)和Forkhead-box P1(FOXP1)是HCC的致癌基因,在HCC组织中二者是否相互作用,值得进一步研究。因此,本研究观察HCC肝癌组织中YAP、FOXP1 mRNA的表达情况,初步探讨二者对患者预后的影响。
1 资料与方法
1.1 一般资料 收集2004年1月至2007年12月本院收治并经病理组织学确诊的HCC患者的石蜡肿瘤标本共114例,其中男性91例,女性23例,中位年龄49.28岁(年龄范围21~75岁)。肿瘤TNM分期按WHO诊断标准,收集患者临床信息,包括年龄、性别、病理类型、临床分期等。所有患者术前未经任何放化疗和免疫治疗,患者详细资料见表1。本研究经医院伦理委员会审核批准,所有患者均知情同意。
1.2 主要试剂及仪器 Real-time RT-PCR试剂盒:High Pure RNA Tissue Kit、Transcriptor First Strand cDNA Synthesis Kit、LightCycler480 SYBR Green Ⅰ Master均购自Roche公司。YAP、FOXP1、GAPDH引物由上海生工生物工程技术有限公司合成,具体序列如下,YAP引物序列:5′-CTA TTG GTC GTC ATT GTT CTC-3′(正向),5′-AGT TAG CCC TGC GTA GCC-3′(反向),FOXP1引物序列:5′-CGG TAC TCA GAC AAA TAC AA-3′(正向),5′-GTC GGA AGT AAG CAA ACA-3′(反向),GAPDH引物序列:5′-AGA AGG CTG GGG CTC ATT TG-3′(正向),5′-AGG GGC CAT CCA CAG TCT TC-3′(反向)。
1.3 Real time RT-PCR测定基因表达 HCC及癌旁石蜡组织(paraffin-embedded tissues)中RNA的提取:将蜡块组织切成6~8 μm切片,至1.5 mL离心管中,加入1 mL二甲苯,混匀,离心2 min。取上清液,加入1 mL无水乙醇,混匀,离心2 min,取上清液。加入150 μL Buffer PKD,重悬沉淀。加入10 μL蛋白酶K,混匀。56℃孵育15 min,20 000×g离心15 min。取上清液,至1.5 mL离心管中。提取方法参照文献[3-4]。Real time RT-PCR检测方法参照Roche说明书,构建20 μL反转录反应体系,混匀后37℃温浴5 min。42℃温浴60 min,70℃温浴10 min,终止反应。构建20 μL聚合酶链式反应PCR反应体系,扩增条件:94℃ 10 min;94℃ 20 s,55℃ 20 s,72℃ 20 s,共40个循环。
实时荧光定量PCR仪分析结果,根据阴性对照调整阈值和基线以确定各个标本的Ct值,并根据熔解曲线确定该Ct值是否有效。2-ΔΔCt值计算方法参照文献[3],进行相对表达量定量分析。参照文献[5],以癌旁组织作为对照组进行定性分析:若癌组织中表达量大于癌旁组织则为阳性,癌中表达量等于或小于癌旁组织则为阴性。
1.4 统计学处理 采用SPSS 19.0进行数据分析,采用χ2检验分析YAP、FOXP1 mRNA表达水平与肝癌患者临床特征的相关性,比较癌及癌旁组织中YAP、FOXP1的表达差异。采用T检验(Wilcoxon non-parametric signed-rank test)对组织中YAP、FOXP1 mRNA表达情况进行组内和组间差异分析,采用Pearson分析YAP、FOXP1 mRNA表达间的相关性。随访患者5年的无病生存期(disease-free survival, DFS),单变量Cox比例风险回归用于分析患者在各种不同影响因素下的生存差异,单变量回归分析中的显著因素进一步纳入多因素回归分析。检验水准(α)为0.05。
2 结 果
2.1 癌及癌旁组织YAP和FOXP1 mRNA的表达差异 Real time RT-PCR结果(图1A)表明:HCC组织FOXP1 mRNA表达水平高于癌旁正常组织,差异有统计学意义(0.62±0.24vs0.28±0.17,P<0.000 1),HCC组织YAP mRNA表达水平高于癌旁组织,差异有统计学意义(0.61±0.29vs0.20±0.12,P<0.000 1)。进一步相关性分析结果(图1B)表明:HCC组织YAP、FOXP1 mRNA表达水平正相关(r=0.76,P<0.000 1)。
2.2 癌组织YAP、FOXP1 mRNA表达与患者临床特征的相关性 结果(表1)表明:HCC组织YAP、FOXP1 mRNA阳性表达与患者肿瘤直径、TNM分期、AFP相关(P<0.05)。

图1 癌及癌旁组织YAP、FOXP1 mRNA的表达
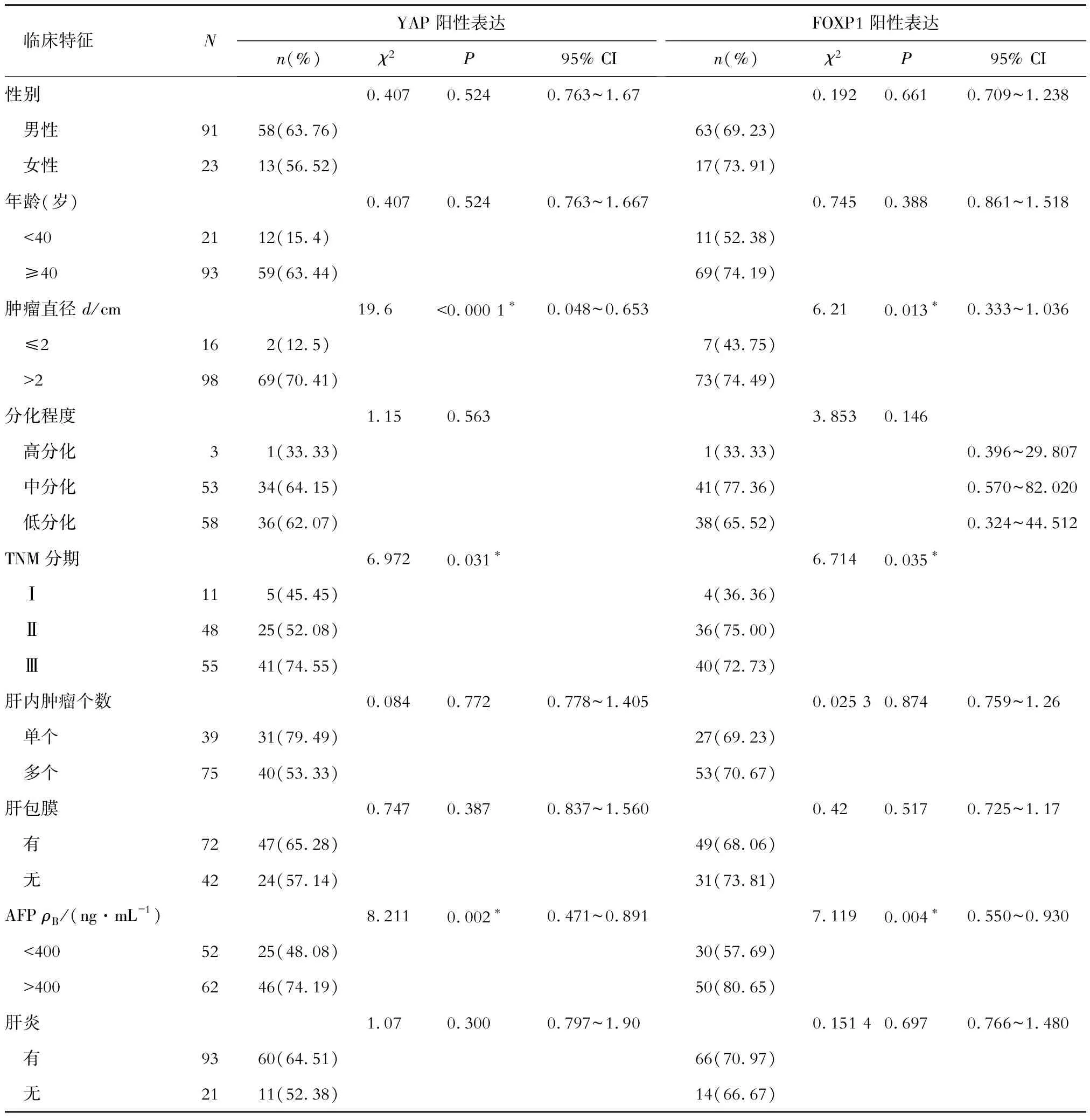
表1 HCC组织YAP、FOXP1 mRNA表达与肝癌患者临床特征的相关性
*P<0.05
2.3 HCC患者DFS影响因素分析 结果(表2)表明:随访5年,单因素回归分析发现DFS生存时间受患者肿瘤分化程度、TNM分期、肝内肿瘤个数、AFP、HBV感染、YAP和FOXP1表达的影响(P<0.05)。

表2 患者随访5年DFS的单因素回归分析
*P<0.05
2.4 Kaplan-Meier生存分析 结果(图2)表明:YAP阳性HCC患者DFS生存时间短于YAP阴性患者(17个月vs26个月,P=0.020 7);FOXP1阳性患者DFS生存时间短于FOXP1阴性患者(18个月vs27个月,P=0.004 2);YAP、FOXP1共表达阳性患者DFS生存时间短于YAP、FOXP1共表达阴性患者(18个月vs24个月,P=0.003 7),差异有统计学意义。结果提示:YAP、FOXP1阳性表达影响患者的治疗效果,缩短了患者的DFS时间。

图2 Kaplan-Meier生存分析HCC患者DFS
A:YAP表达阴性vsYAP表达阳性;B:FOXP1表达阴性vsFOXP1表达阳性;C:YAP、FOXP1共表达阴性vsYAP、FOXP1共表达阳性
3 讨 论
HCC是目前我国较为常见的恶性肿瘤,且病死率居前3位。HCC治疗方式首选手术治疗,但术后5年肿瘤复发转移率高达40%~70%,这与术前可能已存在微小播散灶或多中心发生有关,且合并有HBV感染及病毒复制活跃的HCC患者预后较无罹患肝炎的患者差[1]。南开大学的学者提出HBV相关蛋白X蛋白通过激活YAP/FOXA1信号通路影响HBV病毒复制,从而导致肝癌的发生[2]。其他研究人员研究了罹患HBV的HCC样本后认为FOXP1可能参与HBV相关肝硬化的癌变过程[6]。而FOXP1是FOX家族转录因子成员之一,参与细胞增殖、分化和代谢过程。本课题组前期研究发现在HCC中FOXP1高表达影响HCC患者预后[5],对HCC细胞增殖和迁移能力有影响[7]。利用转染技术在细胞内抑制FOXP1表达,可抑制HCC细胞增殖,导致G1/S期受阻,有丝分裂时间延长,激活型Rb和磷酸化Rb的表达及E2F1表达在24 h时明显降低[8]。
Hippo-YAP通路是控制肿瘤发生发展的一个重要的信号转导通路。去磷酸化的YAP能结合转录因子,抑制凋亡和促进细胞增殖。Mizuno等[9]发现下调Hippo-YAP、FOXM1 mRNA的表达,可抑制恶性间皮瘤肿瘤细胞的生长和促进凋亡。YAP通过转录相关因子TEAD(transcription enhancer and activator domain)直接影响FOXM1的表达。Weiler等[10]对人肝癌细胞系、转基因小鼠和肝癌组织进行分析,发现YAP与FOXM 1协同作用导致染色体不稳定。除肝癌外,Rizvi等[11]发现在胆管癌细胞中FOXM1的表达依赖于YAP,将沉默YAP基因导致FOXM1蛋白表达水平下降,能诱导胆管癌细胞的死亡。此外,还有研究发现FOXM1和YAP在卵巢癌中的表达也有相关性[12]。YAP不仅与FOXM1有关,还与FOX家族的其他成员有关。有研究[13]表明在肝癌细胞中RANT相关转录因子2与YAP之间密切相关,其相互作用是通过依赖FOXA1调控的抑制肿瘤抑制因子lncRNA,从而达到致癌作用。Hippo通路通过抑制YAP-FOXO1的功能而对心肌细胞的存活产生抑制作用[14]。同样,YAP不仅在HCC中高表达,也在胆管癌中高表达,敲除SGC-7901和MGC-803胃癌细胞中FOXA1发现YAP的表达量下降,抑制肿瘤细胞增殖和诱导细胞凋亡[15]。
不仅在肿瘤中YAP与FOX家族基因关系密切,在体细胞中二者间也有相关性。Yuan等[16]体外研究胰岛素β细胞发现YAP的过度表达能显著诱导人胰岛β细胞增殖,且能诱导胰岛素分泌β细胞中的抗凋亡作用所需要的Trx 1/2生成,具有较强的促增殖和抗凋亡功能,且发现FOXM 1在YAP过表达时被上调,是YAP依赖的β细胞增殖所必需的。YAP过表达可保护β细胞免受多种导致糖尿病条件所诱导的凋亡,可用于恢复糖尿病患者的外分泌功能。在心肌细胞中下调miR-206的表达水平抑制诱导心肌肥大和存活的YAP的表达水平,同时FOXP1过表达又影响miR-206的表达[17]。由此可见,在心肌细胞中FOXP1和YAP间通过miR-206相互作用。Hippo-YAP-FOXA2信号通路在肺外周成熟和表面活性物质稳态中也起着重要作用[18]。
RT-PCR技术已经被广泛应用于临床检测多种恶性肿瘤石蜡样本中相关基因的表达水平,包括肺癌[19]、浸润性膀胱癌[20]、胃癌[21]、肝癌[22]等恶性肿瘤。国外研究[3-4]表明从石蜡组织中提取mRNA与冰冻组织中提取mRNA几乎一致,且与免疫组化(IHC)测定结果约90%的一致性。本课题组前期研究了FOX家族的FOXP1[6]在肝癌组织中表达情况,采用RT-PCR和免疫组化技术证实了FOXP1在癌组织中的高表达,且癌组织高于癌旁组织,其高表达影响HCC预后,在此基础上,进一步分析FOXP1与Hippo-YAP信号通路之间的关系。本研究在之前研究的基础上,回顾性分析FOXP1与YAP表达水平相关性,发现癌组织YAP和FOXP1 mRNA表达均大于癌旁组织,YAP与FOXP1的mRNA与肿瘤直径、TNM分期、AFP水平有关,且二者表达正相关。单因素分析结果发现患者的DFS与患者肿瘤的分化程度、TNM分期、肝内肿瘤个数、AFP水平、HBV感染、YAP、FOXP1高表达有关;进一步多因素分析发现患者肝癌术后复发与患者HBV感染和YAP、FOXP1高表达有关,YAP、FOXP1共同影响HCC患者术后复发。
随着我国经济及医学的发展,多种抗癌靶向药物不再是遥不可及,给术后复发患者的治疗带来了多种选择的机会,有望延长肝癌患者总生存率(overall survival, OS)。越来越多的癌基因及抑癌基因的发现表明癌症相关基因不再是孤立的影响因素,而是在相互作用下共同发挥作用,给临床研究带来了新的挑战。
