盐胁迫下不同耐盐性花生品种形态及生理差异研究
2018-08-29梁晓艳顾寅钰宋延静张海洋王向誉郭洪恩
梁晓艳,顾寅钰,李 萌,宋延静,张海洋,付 娆,王向誉,郭洪恩
(山东省蚕业研究所,山东 烟台 264002)
土地盐渍化是影响生态环境和农业生产的全球性问题。据统计,全球盐渍化土地面积大约有9.55×108hm2,其中我国约有3.6×107hm2,占全国可利用土地面积的4.88%,且随着人类耕作活动的增加,盐渍化土壤面积呈逐年不可逆的形式增加[1]。预计到2050年,可用耕地的50%将面临盐渍化[2]。提高作物的耐盐性,扩大作物的盐碱地种植面积是解决我国土地资源短缺的重要途径。
花生是我国重要的油料作物和经济作物,花生种植面积和产量均居世界前列,但由于巨大的人口压力及不断增长的植物油消费量,我国食用植物油供给率严重不足,在避免油料作物与粮争地的前提下,大力拓展花生在盐碱地的种植面积,增加花生总产量是保证我国食用油供给安全的重要途径之一。花生属于中等耐盐作物,花生对盐胁迫的适应性与花生品种和生育期有关,研究表明不同花生品种耐盐胁迫的能力不同,随着盐浓度的增加,其植株生长速率、植株含水量、叶片水势、光合色素、总碳水化合物等性状均明显下降[3];另外,花生不同生育时期的耐盐能力不同,其中芽期和幼苗期对盐害最敏感[4]。前人通过对花生出苗速度、植株形态和生物量等指标对不同基因型花生品种的萌发至幼苗期的耐盐性进了鉴定,并采用聚类分析将其分为高度耐盐型、耐盐型、盐敏感型和高度盐敏感型4种类型[5-6]。
目前关于花生耐盐性的研究已有不少报道,但多集中于种质资源的耐盐筛选以及盐胁迫下花生的基本生理响应等方面[6-8],而关于不同耐盐水平花生的耐盐适应机制仍缺乏系统深入的研究,本研究拟从植株形态发育、光合特性、叶片及根系活性氧代谢及渗透调节物质等多方面研究不同耐盐性花生品种之间的耐盐适应性差异,探明不同耐盐性花生品种的耐盐适应机制,以期为花生耐盐品种的选育及花生耐盐性的提高提供理论依据。
1 材料与方法
1.1 试验材料
供试花生品种为花育25(HY25)、花育22(HY22)和花育33(HY33),其中HY25为高度耐盐品种,HY22为耐盐品种,HY33为盐敏感品种[5-6,9],3个品种均购自山东省花生研究所。
1.2 试验设计
NaCl胁迫试验采用室内水培法。首先,分别选取3个品种均匀、饱满、大小一致的花生种子在1% 次氯酸钠中浸泡15 min,进行消毒,用无菌水反复冲洗3 次后,放在恒温培养箱中进行浸种催芽,出芽后分别播于装有蛭石的营养钵中,用1/2 Hoagland 营养液进行浇灌,生长2 d 后挑选生长一致的植株洗净根部蛭石,保留子叶定植于装有8L Hoagland 营养液的水培槽中,每个水培槽内定植12株花生,调节pH值6.3,全天进行充气泵充气,每2 d更换1次营养液,培养室内釆用高压钠灯补光,光照时间为14/10 h(昼/夜),温度设为 25℃/20℃,光强为 100μmol/(m2·s),水培槽内营养液培养5 d 后分别进行不同浓度的NaCl处理,试验共设4个NaCl浓度处理,分别为50、100、150、200 mmol·L-1NaCl,以不加NaCl的Hoagland 营养液作为对照,其他各处理分别在Hoagland营养液中加入不同量的NaCl以达到设定浓度,每处理设3次重复。各处理在设定NaCl浓度的营养液中统一培养15d后进行取样,测定相关生长发育及生理生化指标,培养期间每2 d更换一次营养液。
1.3 测定项目和方法
根系及地上部生物量的测定,每处理取3株代表性植株用自来水冲洗后吸干水分,将根、茎、叶分开,放入烘箱内105℃杀青30 min,之后70℃烘干至恒重,称取干重。取主茎上第二个展开叶及根系的毛细根进行相关生理生化指标的测定。叶片光合色素含量的测定经95%乙醇浸提采用紫外分光光度法[10];超氧化物歧化酶(SOD)活性采用氮蓝四唑(NBT)还原法[11];过氧化物酶(POD)活性采用愈创木酚法测定[10];过氧化氢酶(CAT) 活性采用紫外分光光度法[12];丙二醛(MDA)含量测定采用硫代巴比妥酸法[12];可溶性蛋白含量的测定采用考马斯亮蓝法G-250染色法[10];游离脯氨酸含量的测定采用茚三酮比色法[10]。
1.4 试验数据处理
运用Excel 2003、SPSS 10.0 软件进行数据的整理和作图,采用LSD法进行差异显著性检验(α= 0.05)。
2 结果与分析
2.1 不同耐盐性花生品种植株生物量及根冠比的差异
由表1可知,不同花生品种地上部生物量随着NaCl浓度的增加,均呈逐渐降低的趋势,在不同浓度盐胁迫处理下,HY25和HY22的地上部生物量均显著高于HY33;根系生物量和总生物量在50 mmol/L NaCl浓度下最大,之后逐渐降低,在100~200 mmol/L NaCl浓度下,HY25和HY22的根系生物量和总生物量均显著高于HY33。无NaCl胁迫下,三个花生品种的根冠比无显著性差异,随着NaCl浓度的增加根冠比呈先升高后降低的趋势,在150 mmol/L NaCl浓度下达到最大值,不同NaCl浓度下根冠比均高于对照,由此可见,不同浓度NaCl胁迫对花生地上部的抑制作用大于对根系的抑制;在100、150、200 mmol/L NaCl浓度下,HY25的地上部生物量与对照相比下降幅度分别为27.6%、37.9%和43.1%,HY22的下降幅度为25.9%、44.8%和46.6%,HY33的下降幅度分别为35.2%、53.7%和59.3%。由此可见,NaCl胁迫对盐敏感品种地上部的抑制作用大于高度耐盐及耐盐品种。
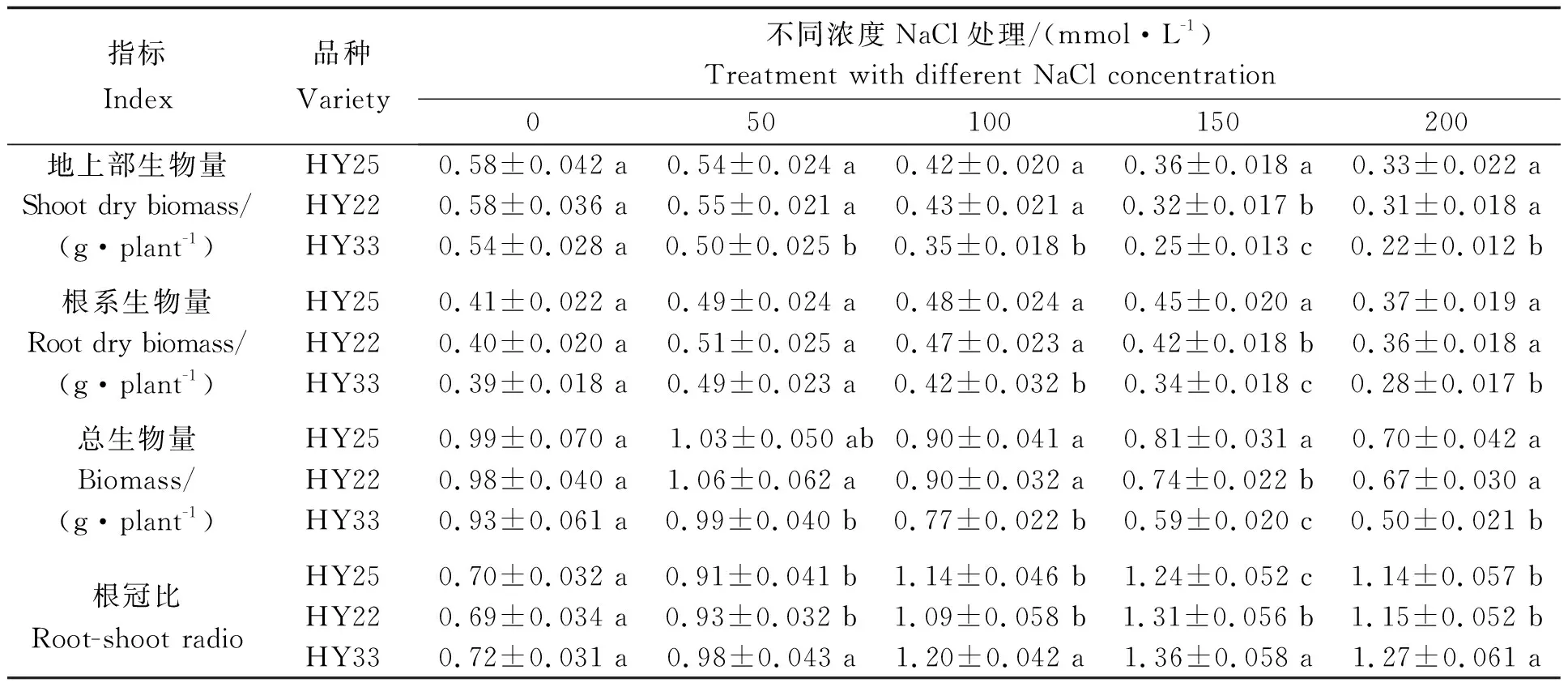
表1 不同耐盐性花生品种生物量及根冠比的差异
注:同列内同一指标中不同小写字母表示不同品种间差异显著 (p<0.05)。下同。
Note: Different small letters in the same column and index indicates significant difference between different varieties (p<0.05) . The same below.
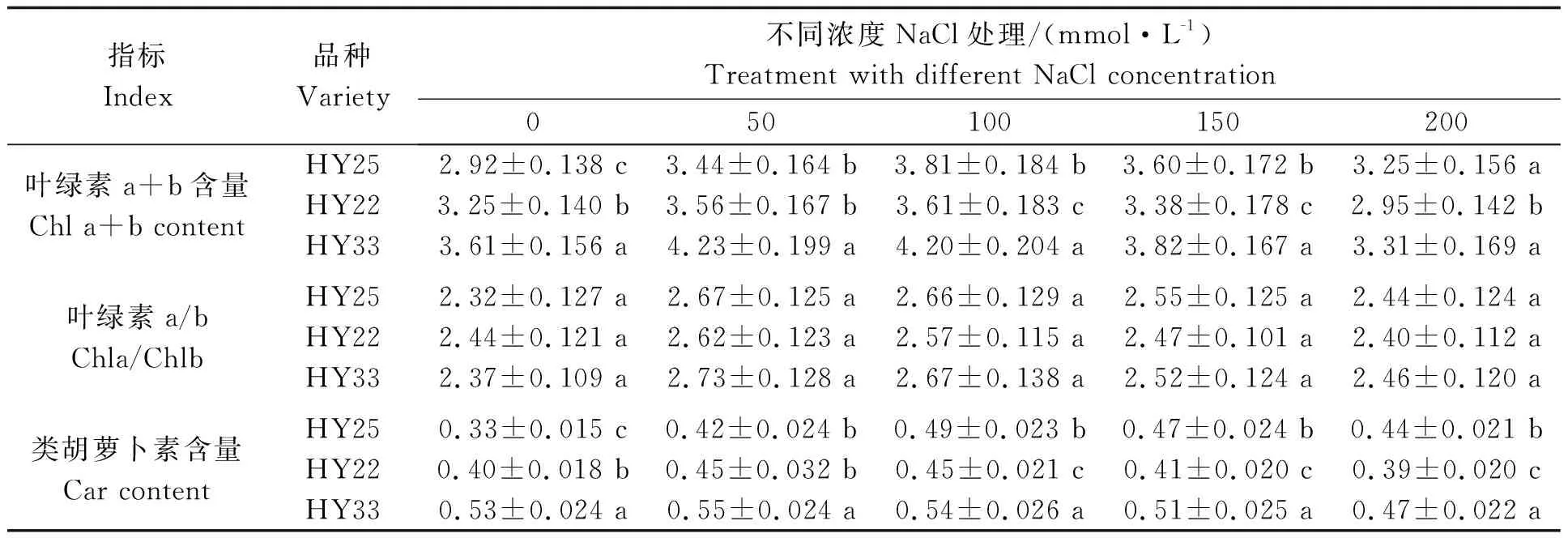
表2 不同耐盐性花生品种叶片光合色素含量的差异 单位:mg/g
2.2 不同耐盐性花生品种叶片光合色素含量的差异
表2可知,不同浓度NaCl胁迫处理对不同花生品种叶片的叶绿素含量、叶绿素a/b及类胡萝卜素含量均有重要影响,不同品种之间叶绿素及类胡萝卜素含量存在显著差异,叶绿素a/b差异不显著。无NaCl胁迫下,不同花生品种的叶片叶绿素a+b含量和类胡萝卜素含量均表现为HY33>HY22>HY25,盐敏感品种HY33显著高于HY22和HY25,随着NaCl浓度的增加,各品种均呈先升高后降低的趋势,HY25和HY22均在100 mmol/L NaCl浓度下达到最大值,二者均显著低于HY33,HY33在50 mmol/L NaCl浓度下达到峰值,之后随着NaCl浓度增加均呈下降趋势,高浓度条件下,下降幅度较大,但HY33的叶绿素a+b含量和类胡萝卜素含量仍高于HY22和HY25,且与HY22差异显著,这说明HY33在对照与不同浓度NaCl处理下均具有较高的叶绿素及类胡萝卜素含量,但随着NaCl浓度的增加,HY33的叶绿素及类胡萝卜素含量下降迅速,尤其是在高浓度NaCl胁迫下,降低幅度较大,这说明盐敏感品种的叶片光合色素对NaCl胁迫反应较为敏感,对NaCl胁迫的适应能力低,而高度耐盐及耐盐品种在高浓度NaCl胁迫下光合色素含量下降较为缓慢。
2.3 不同耐盐性花生品种叶片及根系SOD活性的差异
SOD是生物防御活性氧毒害的关键酶之一,主要功能是清除超氧阴离子自由基(O2-·),减轻其对植物细胞的伤害。由图1可看出,不同品种花生叶片中SOD活性均随着NaCl浓度的增加呈逐渐升高的趋势,在无NaCl胁迫条件下,HY33的叶片SOD活性显著高于HY25和HY22,随着NaCl浓度增加,SOD活性不断升高,HY25和HY22的上升幅度明显高于HY33,而且,HY33在200 mmol/L NaCl浓度下活性开始下降,说明NaCl胁迫条件下,花生高度耐盐及耐盐品种叶片的SOD活性比盐敏感品种反应更迅速,且对NaCl胁迫的承受能力更高。从根系的SOD变化值可以看出,不同NaCl浓度下耐盐品种HY25的SOD活性显著高于其他两个品种,其差异大于叶片间的差异,这说明高度耐盐品种HY25的根系SOD活性与其他品种相比具有明显的优势,而HY33的根系SOD活性在高NaCl胁迫下显著下降,说明盐敏感品种根系SOD对NaCl胁迫的调节能力较差。
2.4 不同耐盐性花生品种叶片及根系POD活性的差异
POD 作为自由基清除剂,能催化过氧化氢及某些酚类的分解,消除活性氧和超氧阴离子自由基对细胞的伤害,从而保护细胞,增强植物对NaCl胁迫的抵御能力。从图2可看出,花生叶片的POD活性均随着NaCl浓度的增加呈上升的趋势,其中叶片的上升幅度较大,不同耐盐性品种之间POD活性表现出显著的差异,高度耐盐品种HY25和耐盐品种HY22之间差异不显著,二者均显著高于盐敏感品种HY33,在高盐浓度下差异尤为显著。根系中POD活性变化幅度相对较小,HY25和HY22呈逐渐增加的趋势,而HY33呈先升后降的趋势,在50 mmol/L NaCl浓度下开始下降,且活性显著低于高度耐盐及耐盐品种。
2.5 不同耐盐性花生品种叶片及根系CAT活性的差异
CAT是植物组织中能有效清除植物组织中的过氧化氢对细胞的氧化作用的酶,保护细胞膜免受自由基伤害。从图3可看出,不同NaCl浓度条件下不同耐盐花生品种之间叶片CAT差异表现不同,无NaCl条件下,HY33的叶片CAT活性显著高于HY25和HY22,50 mmol/L NaCl浓度下,HY25和HY22的CAT活性迅速增加,而HY33活性略有下降,随着NaCl浓度增加,各品种CAT活性均呈上升趋势,大于100 mmol/L NaCl胁迫条件下,HY33的CAT活性均高于HY25和HY22。根系中CAT活性随NaCl浓度的变化趋势与叶片不同,呈先升高后降低再升高的波浪形变化趋势,不同NaCl浓度处理下,各品种的根系CAT活性均表现为:HY25>HY22>HY33,说明耐盐品种与盐敏感品种相比,其CAT活性的优势主要表现在根系,叶片中CAT并没有对耐盐性的提高起主导作用。

图1 不同耐盐性花生品种叶片及根系SOD活性的差异Fig.1 Differences of SOD activity in leaves and roots of peanut varieties with different salt tolerance
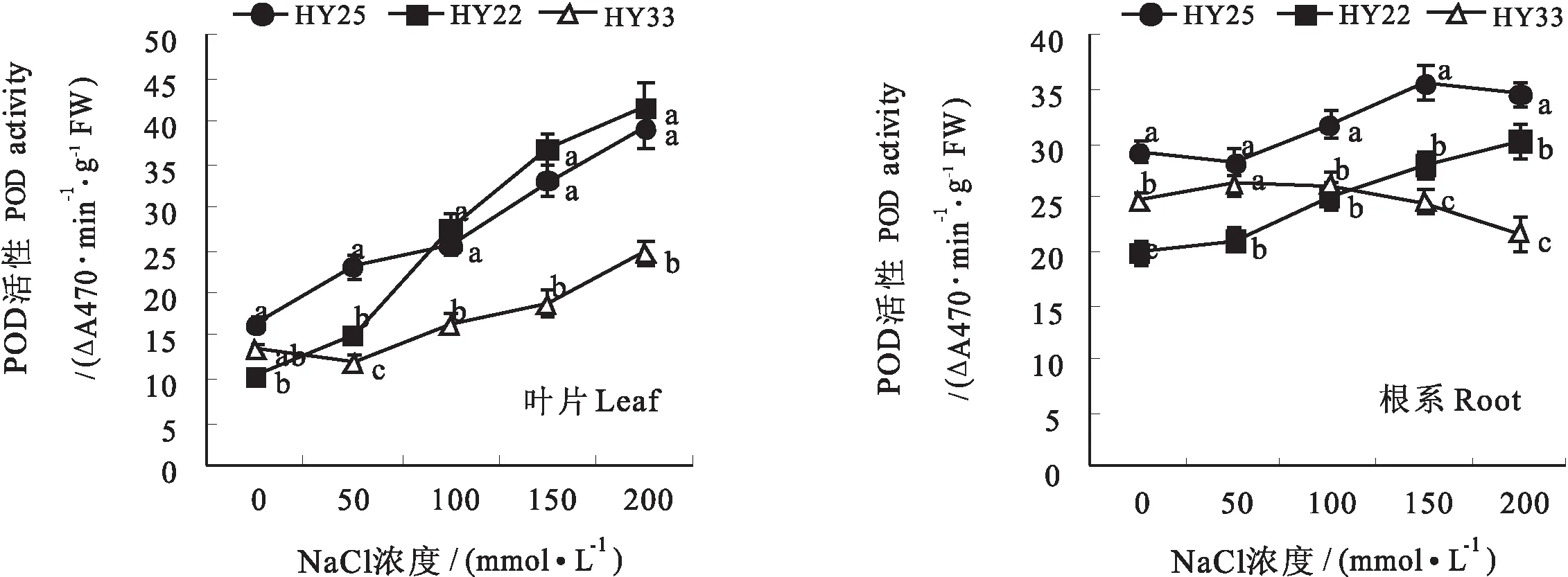
图2 不同耐盐性花生品种叶片及根系POD活性的差异Fig.2 Differences of POD activity in leaves and roots of peanut varieties with different salt tolerance
2.6 不同耐盐性花生品种叶片及根系MDA含量差异
MDA 是植物膜脂过氧化作用的最终产物,其含量高低可反映植株抗氧化能力和生理代谢的强弱。图4可看出,花生叶片和根系中MDA含量均随着NaCl浓度的增加呈逐渐上升的趋势,其中,叶片中MDA含量的上升幅度大于根系。在低NaCl浓度下(50 mmol/L NaCl)MDA含量变化幅度较小,随着NaCl浓度的增加,MDA含量不断积累,膜脂过氧化程度逐渐增加,其中,HY33的叶片和根系中MDA含量均显著高于HY25和HY22,这说明盐敏感品种的花生叶片和根系的膜脂过氧化程度显著高于高度耐盐品种和耐盐品种,这可能与盐敏感品种较低的抗氧化酶活性有关。
2.7 不同耐盐性花生品种叶片及根系可溶性蛋白含量的差异
植株中可溶性蛋白含量在一定程度上反映了植物对逆境的抵抗和耐受能力。图5可以看出,不同耐盐性花生品种叶片和根系中可溶性蛋白含量随NaCl浓度的变化趋势存在差异,高度耐盐品种HY25和耐盐品种HY22的可溶性蛋白含量随着NaCl浓度的增加呈逐渐升高的趋势,而盐敏感品种HY33表现为先升高后降低的趋势,在0~100 mmol/L NaCl条件下HY33的叶片可溶性蛋白含量均显著高于HY25和HY22,之后含量迅速下降,均低于其他两个品种。根系中可溶性蛋白含量与叶片中变化趋势相似,不同的是HY25在不同NaCl浓度下可溶性蛋白含量均高于其他两个品种,而HY22在低NaCl浓度下含量较低,但随着NaCl浓度的增加可溶性蛋白含量迅速增加,由此可见,在较高NaCl浓度下,高度耐盐品种和耐盐品种的可溶性蛋白含量的渗透调节能力要高于盐敏感品种。
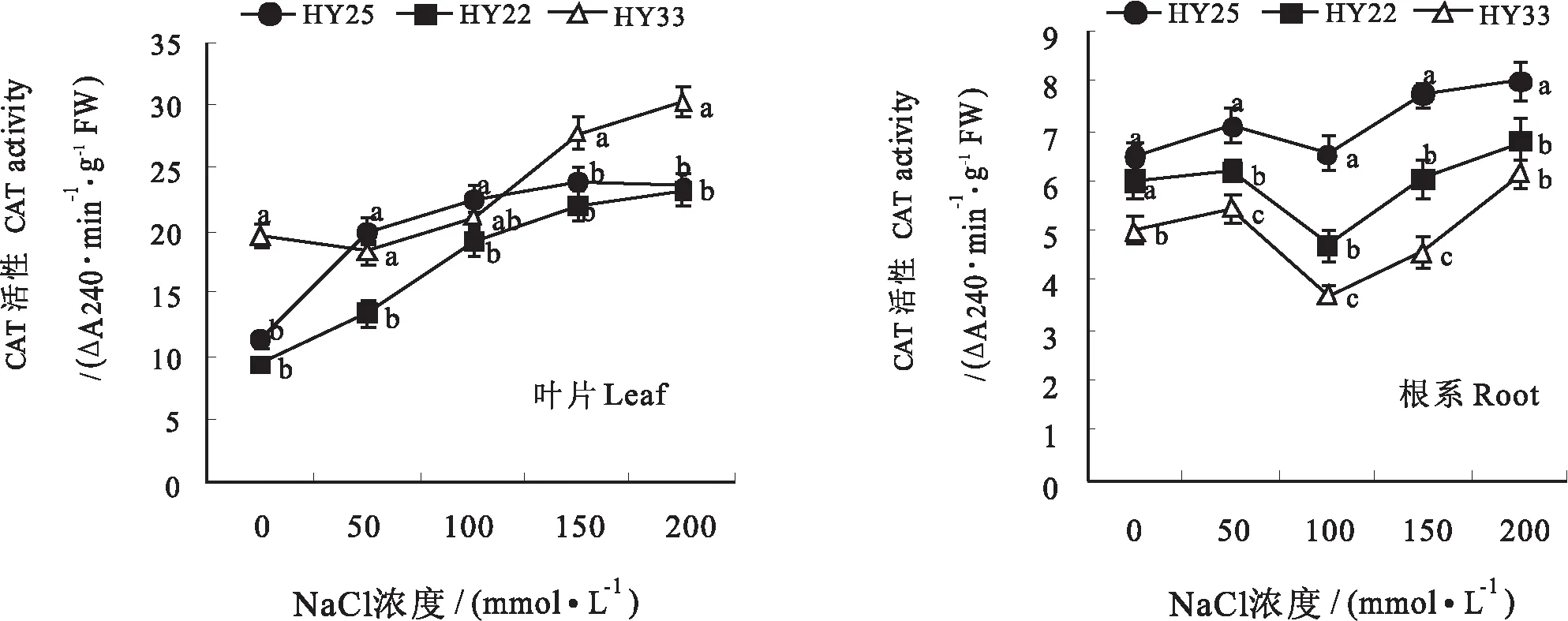
图3 不同耐盐性花生品种叶片及根系CAT活性的差异Fig.3 Differences of CAT activity in leaves and roots of peanut varieties with different salt tolerance
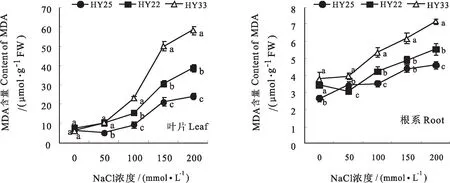
图4 不同耐盐性花生品种叶片及根系MDA含量的差异Fig.4 Differences of CAT activity in leaves and roots of peanut varieties with different salt tolerance
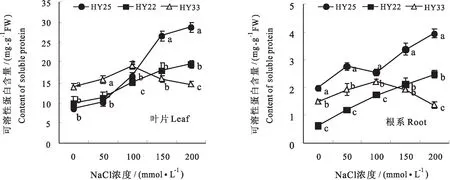
图5 不同耐盐性花生品种叶片及根系可溶性蛋白含量的差异Fig.5 Differences of the content of soluble protein in leaves and roots of peanut varieties with different salt tolerance
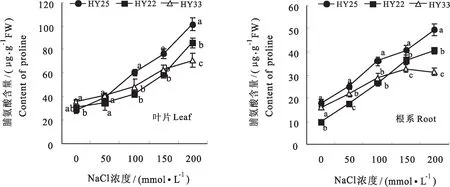
图6 不同耐盐性花生品种叶片及根系脯氨酸含量的差异Fig.6 Differences of the content of proline in leaves and roots of peanut varieties with different salt tolerance
2.8 不同耐盐性花生品种叶片及根系脯氨酸含量的差异
脯氨酸是一种重要渗透调节物质,其含量在一定程度上反映了植物的抗逆性。图6可见,不同耐盐性花生品种叶片及根系中脯氨酸含量均随NaCl浓度的增加呈逐渐上升的趋势,不同品种之间也表现出明显的差异,高度耐盐品种HY25的叶片及根系脯氨酸含量均显著高于耐盐品种HY22和盐敏感品种HY33,尤其在高NaCl浓度下差异更为显著,耐盐品种HY22的叶片及根系脯氨酸含量在低NaCl浓度下与盐敏感品种差异相对较小,在高NaCl浓度下,显著高于盐敏感品种HY33。
3 讨 论
3.1 盐胁迫对不同耐盐性花生品种形态发育的影响
不同作物耐盐性不同,同一作物不同品种间耐盐性亦存在基因型差异[13-14],生物量的高低是反映植物综合抗盐能力的重要指标[15],大量研究表明,盐胁迫对植物的生长发育影响总体表现为抑制作用,首先表现为植株生长减缓,根系的伸长受抑制,鲜重的增长及干物质积累、侧根的减少[5,16-17]。本研究结果与前人研究基本一致,地上部生物量均随盐浓度的增加呈逐渐降低的趋势,不同的是在一定盐浓度范围内(50~100 mmol/L NaCl),各品种根系生物量并没有降低,反而有所增加,使根冠比在一定范围内随着盐浓度的增加呈上升的趋势。盐胁迫下增加生物量在根部的分配是植物应对盐胁迫的方式之一[18],植物通过增加根系生物量来保证其对营养离子的吸收,而随着盐浓度的不断增加,根系由于吸收过多的盐离子,导致根系的生长发育受到抑制,造成生物量降低,这在其他植物的研究中得到过相似的结论[19]。本研究中,不同NaCl浓度下,盐敏感品种的花生根冠比均高于高度耐盐品种和耐盐品种,原因可能是NaCl胁迫对盐敏感品种地上部的抑制作用显著大于高度耐盐及耐盐品种,导致根冠比过高,这也是高NaCl胁迫下盐敏感品种耐盐性差的重要表现性状之一。
3.2 盐胁迫对不同耐盐性花生品种叶片光合色素含量的影响
叶片中光合色素含量是反映植物光合能力的一个重要指标,环境因子的改变会引起叶绿体色素含量的变化,进而引起光合性能的改变。然而,关于盐胁迫下植物光合色素的变化规律仍存在一定争议。大部分研究认为盐胁迫会使叶片内光合色素发生降解,叶绿体结构解体,使光合作用受阻[10],主要表现为叶绿素含量下降[21],叶片的光能吸收和转换效率降低[22]。然而也有研究者认为,盐胁迫能引起植物叶片叶绿素含量增加[23-24]。
本研究结果表明,从0~200 mmol/L NaCl浓度下,不同耐盐花生品种叶片叶绿素总量、类胡萝卜素含量及叶绿素a/b均呈先升高后降低的趋势,但是,在150 mmol/L NaCl浓度以内,不同花生品种叶片叶绿素含量及类胡萝卜素含量均高于对照,这说明一定程度的盐胁迫促进了光合色素的积累,原因可能是NaCl胁迫条件下植物叶片含水量过低、生长缓慢进而产生相对的“浓缩”效应;另一个原因可能是叶绿素的合成需要脯氨酸,而在NaCl胁迫下细胞中大量积累的脯氨酸在一定程度上促进了叶绿素的合成。随着盐浓度的进一步增加,叶绿素及类胡萝卜素含量迅速下降,均低于对照水平,其中,盐敏感品种的下降幅度大于高度耐盐及耐盐品种,这说明盐敏感品种对盐胁迫的反应较为敏感,而耐盐品种的光合色素含量变化相对较为稳定。因此,叶绿素含量的多少不能直接反映花生品种的耐盐性高低。
3.3 盐胁迫对不同耐盐性花生品种活性氧代谢的影响
盐胁迫能诱导植物体内活性氧积累,对脂质、蛋白质和核酸造成氧化伤害而严重破坏正常代谢[25]。为了避免活性氧过量产生及其产生的伤害作用,植物特别是耐盐植物在长期的进化过程中形成一套完善的清除活性氧系统,具有维持活性氧代谢水平、保持膜结构和功能稳定的作用。抗氧化酶系统是清除活性氧的重要保护酶系统,该系统中酶活性的变化是盐胁迫条件下的重要生理反应。本研究结果显示,随着NaCl浓度的增加,叶片和根系中SOD、POD及CAT活性的变化总体呈上升的趋势,超过一定浓度后活性逐渐降低,其中叶片中酶活性的变化幅度大于根系,说明叶片中抗氧化酶活性对NaCl胁迫的反应更为灵敏。不同耐盐性花生品种之间抗氧化酶活性存在显著差异,在较高NaCl浓度下,高度耐盐及耐盐品种的叶片SOD和POD活性均显著高于盐敏感品种,而CAT活性没有表现出明显优势,这说明NaCl胁迫条件下两个耐盐品种在叶片活性氧清除过程中SOD和POD两种酶发挥了主要作用,这与其他植物的研究结果有所差异[26-27],这可能与不同植物的活性氧代谢差异有关。盐胁迫下,盐敏感品种中较低的抗氧化酶活性,导致活性氧代谢速度缓慢,丙二醛(MDA)含量不断上升,加剧了膜脂的过氧化水平,这是盐敏感品种耐盐性差的重要生理反应之一。
3.4 盐胁迫对不同耐盐性花生品种渗透调节物质的影响
多数研究表明,盐胁迫条件下,植物体内会大量积累脯氨酸、可溶性蛋白等有机物质[31-33],且研究表明,盐敏感的水稻品种叶片在盐胁迫下会比耐盐品种积累更多的可溶性糖[17]。本研究结果与前人研究结果存在一定差异,随着NaCl浓度的增加,花生叶片和根系的可溶性蛋白和脯氨酸含量的变化趋势因花生品种的耐盐性不同而存在差异,耐盐品种的叶片及根系可溶性蛋白和脯氨酸含量均呈逐渐增加的趋势,高度耐盐品种高于耐盐品种,叶片中二者的上升幅度大于根系,盐敏感品种的叶片脯氨酸含量呈逐渐上升的趋势,根系脯氨酸含量及可溶性蛋白含量均呈先升高后降低的趋势,较高NaCl浓度(>150 mmol/L NaCl)下,其脯氨酸含量和可溶性蛋白含量均低于高度耐盐及耐盐品种,这说明NaCl胁迫下,高度耐盐及耐盐花生品种能够合成更多的可溶性蛋白和脯氨酸,来提高其渗透调节能力,而关于耐盐品种与盐敏感品种之间其他有机及无机渗透调节物质的代谢及生理差异仍有待于进一步深入研究。
