玉米叶片原生质体的制备及瞬时转化体系的建立
2018-08-28雷海英白凤麟郭亚冲乔楠茜
雷海英,白凤麟,冯 宇,郭亚冲,乔楠茜
(长治学院 生物科学与技术系,山西 长治 046011)
1 引言
植物原生质体是指植物细胞用一些手段如酶解法、机械法等除去细胞壁,形成由单层细胞膜包裹的细胞质[1]。原生质体由于没有细胞壁,相对容易摄取外源遗传物质,使外源DNA在原生质体中快速表达并可按既定方向进行培养,是植物作为遗传转化的理想材料[2],同时原生质体也是获得细胞无性系和选育突变的优良起始材料[3],因此,原生质体是开展基础研究的理想材料。玉米原生质体由于制备方法相对简单,转化效率较高,常用于植物瞬时表达系统。
植物瞬时表达检测是一种快速的、高通量、转化简单的分析系统,具有方便快捷的优点。结合报告基因的使用,使得研究基因的表达体系变得更加快捷,可广泛用于基因功能的研究[4]。原生质体的制备和纯化对植物瞬时表达体系的建立起着决定性的作用,对研究基因的功能和调控途径的研究具有重要意义。尽管玉米原生质体的制备研究已经有报道,但要获得质量且转化能力也高的原生质体尚需要不断摸索。
本实验以玉米自交系郑58为材料,对玉米原生质体的制备过程进行了优化,通过PEG法介导质粒转化原生质体,建立了玉米原生质体可高效转化的瞬时表达系统。
2 实验方法
2.1 材料与试剂
试验所用玉米(Zea mays L.)自交系材料郑58种子由山西省农业科学院生物技术研究中心提供。在本实验室花盆种植,培养箱中28℃遮光培养7 d左右,待玉米长至二叶期至三叶期时,取第二片嫩叶制备原生质体。所用纤维素酶R-10、离析酶R-10购自Yakult,Japan,其余试剂购自国内经销商。
2.2 玉米原生质体的制备
酶解液的配制:纤维素酶R-10、离析酶R-10、D- 甘露醇、0.05 moL/L KCl、0.4 moL MES(pH=5.7)混匀后55℃水浴至溶液清亮,待冷却至室温后加入0.2 moL/L CaCl2、β-巯基乙醇、BSA混匀备用。取种植7天的玉米第二片伸展的叶片约0.3 g,去除头尾,用11号无菌刀片蘸取适量的W5(NaCl 154 mmoL/L、CaCl2 125 mmoL/L、MES 2 mmoL/L),在无菌培养皿中将玉米叶片切成1 mm左右的细丝,将切好的玉米叶片迅速完全浸没在酶解液中,28℃,55 rpm/min,振荡,于黑暗中酶解4-6 h。停止反应后,用W5润湿200目的无菌滤网,取培养好的酶解液过滤,加入等体积的W5稀释,在光学显微镜下观察原生质体。
2.3 玉米原生质体的纯化
将过滤后的原生质体原液不同离心力离心2 min,弃上清,缓慢加入1 mL W5,指弹混匀,离心2 min,弃上清,加入100 μL W5观察,利用原生质体简易计数法计数[5]。
2.4 原生质体提取条件的优化
采用不同酶解浓度(纤维素酶和离析酶的浓度分别为0.5%、1.0%、1.5%)组成7种组合,对原生质体产量与质量进行分析;确定最佳的酶解组合过程中同时对不同渗透压浓度、离心力大小进行分析,得出提取完整好的原生质体最佳离心力,最终得出提取玉米原生质体最佳的体系。
2.5 原生质体的转化
取完整的纯化后的原生质体液中加入100 μL MMg(甘露醇 0.4 moL/L、MgCl2 15 mmoL/L、MES 2 mmoL/L)重悬,转化本实验室构建好的含有目的基因的 GFP标签重组载体:pCAMBIA1302-mGFP-m-c、pCAMBIA1302-mGFP-C、pCAMBIA1302-mGFP(空载体),转化质粒浓度为 10 μg/mL。混匀后加入 30%PEG-4000 CaCl2,23℃避光放置15 min。加入2倍体积W5终止反应,100 g离心2 min,弃上清,加入100 μL WI(4 mmoL/L MES、0.4 moL/L 甘露醇、5 mmoL/L KCl),混匀后加入24孔板中,加入WI至终体积为250 μL,23℃暗培养12-14 h,在激光共聚焦显微镜下(LSM 880,卡尔蔡司,德国)观察转化效果。
3 结果与讨论
所有的原生质提取结果如图1所示,产率最高一般为折线图最高点,但从转化结果看来,渗透压为0.5 mol/L时,转化效率低于0.4 mol/L时的甘露醇。具体结果如下。
3.1 不同酶组合对原生质体的影响
取不同浓度的离析酶R-10、纤维素酶R-10的组合配制酶解液,通过对原生质体进行观察和计数,得出提取原生质体时的最佳酶浓度为纤维素酶1.0%、离析酶 0.5%(表 1)。
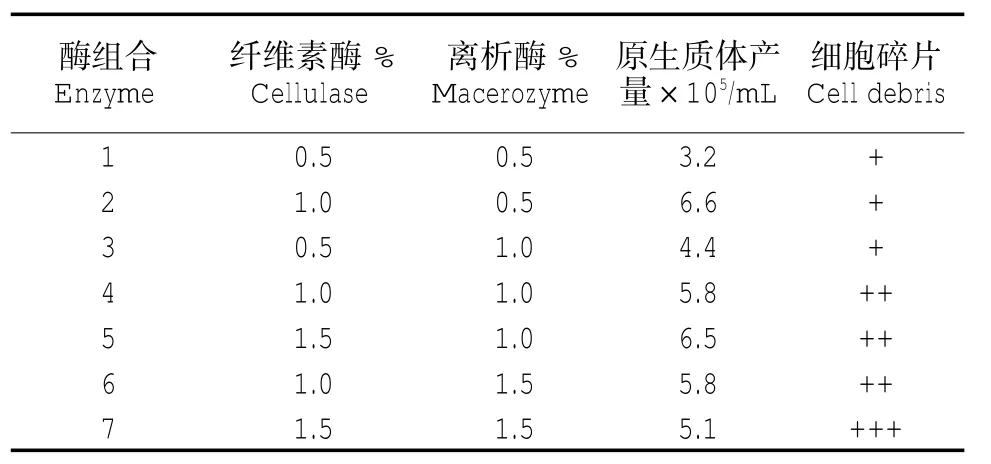
表1 不同酶组合对原生质体分离效果的影响Tab.1 Effects of different enzyme combinations for protoplast isolation effect
3.2 不同酶解时间对原生质体制备提纯的影响
酶解时间以0.5 h为时间间隔依次取样3 h、3.5 h、4 h、4.5 h、5 h、5.5 h、6 h 的原生质体,每次取2 mL样品,离心后用W5悬浮,用量100 μL,再在普通光学显微镜下观察原生质体的完整度并用血球计数板统计原生质体的产量。结果表明,当酶解时间过短时酶解不充分,酶解液中叶片几乎完整呈黄绿色,原生质体没有全部释放出来,原生质体产量不高;当酶解时间过长时破碎严重,推测是由于长时间的酶解使部分已解离的完整原生质体受到损伤进而破碎。最适酶解时间为5 h,其原生质体活力较高,完整度好,饱满(图1中A-C)。
3.3 不同渗透压对原生质体的影响
当甘露醇浓度在0.3 mol/L时,提取的原生质体的体积会吸水膨胀,可知酶解液渗透压低于原生质体渗透压;当甘露醇浓度在0.4 mol/L时,提取出的原生质体完整度较高,破损率低,原生质体渗透压与酶解液渗透压逐渐平衡,原生质体吸水涨破现象减少;当甘露醇浓度为0.5 mol/L时,提取的原生质体产量提高,但原生质体会收缩。
甘露醇浓度在0.4 mol/L时玉米原生质体与酶解液的渗透压相近,提取的原生质体完整度最高,产量适宜,破损率低(图1中D-F)。
3.4 不同离心条件对原生质体的影响
通过取离心力分别为 50×g、100×g、150×g、200×g、250×g、300×g,离心时间 1 min、2 min、3 min、4 min、5 min,从普通光学显微镜下观察到的原生质体完整度看来,当离心力为100×g时完整度较高,随着离心力的增大,玉米原生质体的完整度逐渐降低,当离心力达到400×g时原生质体破碎度严重,因而最佳离心力大小为100×g、离心1 min(如图 1 中 G-I)。
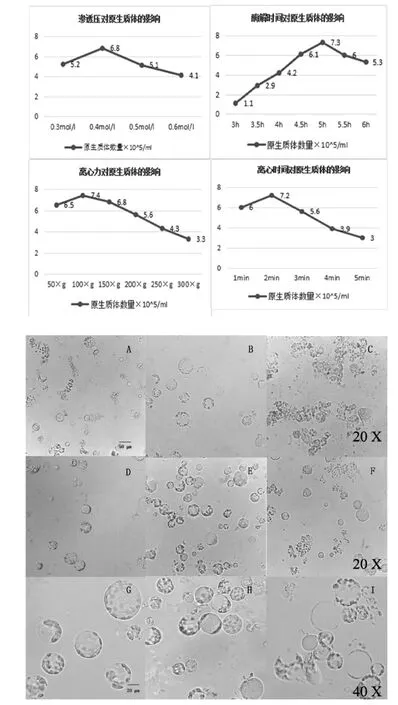
图1 不同条件下对玉米原生质体产量的影响及显微观察结果Fig.1 Yield of different factors protoplasts isolation from leaves of maize
3.5 原生质体瞬时转化
由图2所示,将本实验室研究基因[6-7]功能用带有绿色荧光蛋白标签(GFP)的空载体pCAMBIA1302-mGFP(A-C)有微弱的自发荧光,而含有研究的目的基因玉米中心蛋白基因(centrin)的重组载体pCAMBIA1302-mGFP-C(D-G)在细胞核位置表达较亮的绿色荧光,表明瞬时体系转化成功,且蛋白表达定位与细胞核中。
玉米原生质体制备及转化的关键,首先要选择暗培养一周左右的玉米的第二片叶片,此时的玉米叶片中的细胞活力高,利于原生质体的提取。其次玉米叶片要切的足够细,且切丝时间不能太长,会导致叶片变干从而影响原生质体的产量。离心:由于玉米原生质体非常脆弱,为减少对原生质体的破坏,实验过程中所有的离心步骤所用的均是平转子。渗透压:随着酶解液渗透压的增大,原生质体的产量逐渐提高。这是因为当酶解液渗透压低于玉米原生质体内部渗透时,部分原生质体会吸水破裂,酶解液渗透压增大后,原生质体渗透压与酶解液渗透压逐渐平衡,原生质体吸水涨破现象减少,玉米原生质体产量会提高[8]。可见渗透压浓度在0.4 mol/L时玉米原生质体与酶解液的渗透压相近。PEG浓度:PEG介导[9]原生质体转化时,实验中PEG的浓度不能太高,30%比较合适,因为它对细胞有一定的毒害作用,高浓度的PEG会导致细胞破碎。最后操作过程:所有操作过程都需柔和,以免激烈震荡使原生质体破损,影响后续实验。
4 结论
对玉米(Zea mays L.)自交系-郑58叶肉细胞原生质体的制备条件的优化后,沿着叶脉横切叶片,最佳酶浓度组合为纤维素酶1.0%,离析酶0.5%;最佳酶解时间为5 h;最佳渗透压甘露醇浓度为0.4 mol/L;离心力为100×g、离心1 min时原生质体的产量最高,并转化质粒获得了理想的结果,为今后研究目的基因的亚细胞定位及功能分析等奠定了基础。
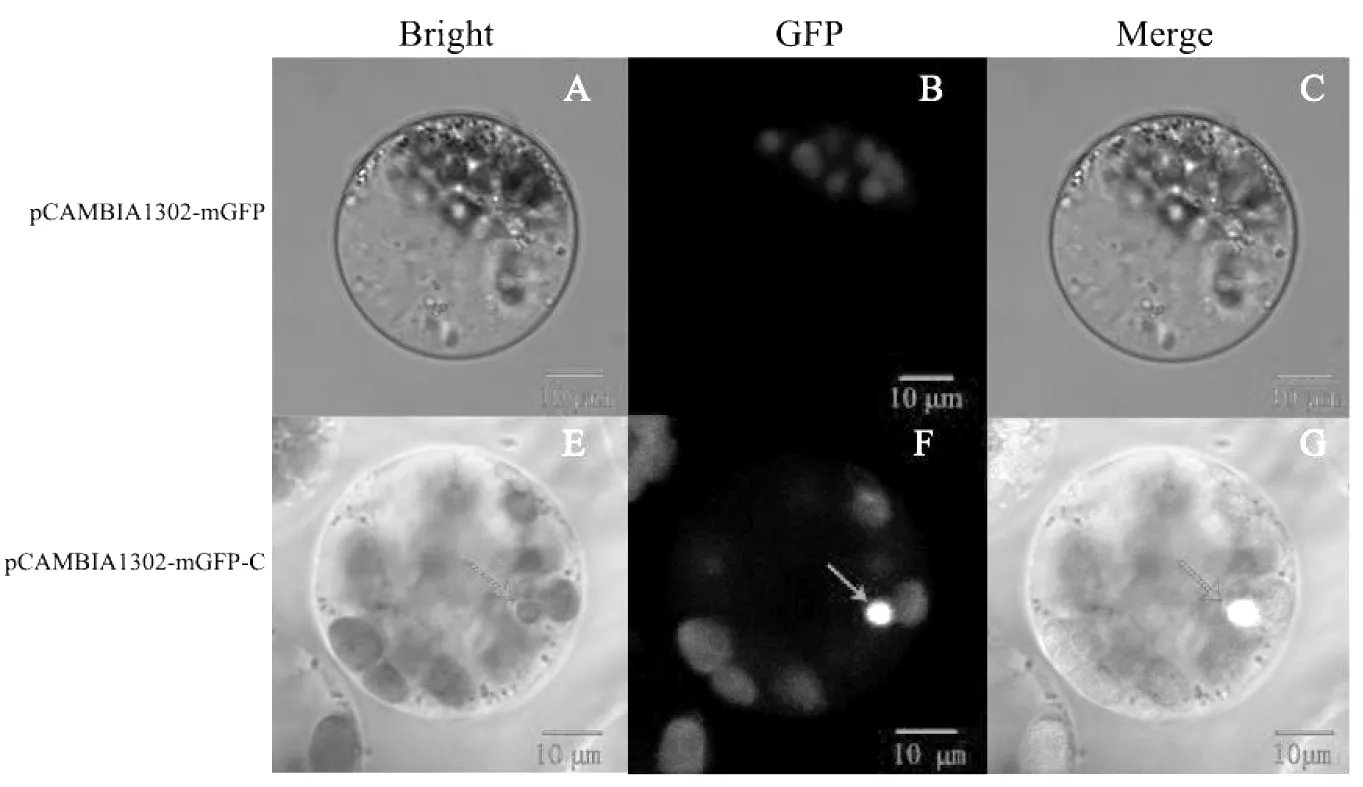
图2 载体瞬时转化玉米原生质体Fig.2 maize protoplasts transiently transfected with pCAMBIA1302-mGFP and pCAMBIA-1302-mGFP-C plasmids
