不同外源植物生长物质对柳枝稷种子萌发特性的影响
2018-08-23何学青
何学青, ·, , , ,
(西北农林科技大学动物科技学院, 陕西 杨凌 712100)
种子休眠指具有生活力的种子在适宜的环境条件下(温度、湿度、光照、土壤等)经过一定的时间后仍不能萌发的现象[1]。不同植物种子的休眠期长度、原因和破除方法一般不相同。通常来说,禾本科牧草种子的休眠与自身的生理状态密切相关,种子休眠主要是因为种子内部存在萌发抑制物[2]。
柳枝稷(PanicumvirgatumL.),禾本科,黍属,是多年生暖季植物,属于能源草,其具有生物质产量高、抗逆性强和种植成本低等特性,是一种重要的生物能源原材料[3]。柳枝稷还可起到水土保持和防风治沙的作用。我国目前柳枝稷的种植规模不大,处于引种的初级阶段[4]。已建成的柳枝稷对于变动环境有很强耐性,但是由于其种子具有休眠特性,使得柳枝稷的建成十分困难,因此破除种子休眠是降低柳枝稷建植风险及重播的第一步。柳枝稷作为栽培品种的时间很短,所以其种子的休眠率较高。
柳枝稷种子贮藏的时间、环境(温度、湿度、土壤盐分和肥力状况)以及种子的状况都影响着种子休眠的破除,柳枝稷种子的休眠属于生理性休眠[5]。休眠与萌发受种子结构及胚发育潜力因素的影响,而胚的发育潜力又决定于母本的复合物和胚自身产生的一些物质。植物生长物质是调节种子休眠、萌发的关键因子[6]。种子休眠的释放和萌发是多种植物生长调节剂之间相互作用的结果,某一种生长物质含量和敏感性的变化并不能完成这一复杂的生理过程,需要多种生长物质及外界环境多种因子的综合作用才能够完成[7]。因此,各种植物生长物质在调控种子萌发过程中既有功能的特异性,相互之间也存在着调控和制约[8]。本研究采用脱落酸(abscisic acid,ABA),赤霉素GA3(gibberellin GA3,GA3),赤霉素GA4+7(gibberellin GA4+7,GA4+7),6-苄氨基腺嘌呤(6-benzylaminopurine,6-BA),吲哚乙酸(indole-3-acetic acid,IAA)五种外源激素和氟啶酮(fluridone,FL),多效唑(paclobutrazol,PA)两种激素生物合成抑制剂处理柳枝稷种子,研究不同植物生长物质处理对柳枝稷种子萌发特性的影响,旨在阐明柳枝稷种子休眠萌发与植物生长物质调控的关系,探索室内快速有效的休眠破除方法,为柳枝稷种子的检验与栽培利用提供参考依据。
1 材料与方法
1.1 供试材料
供试草种为柳枝稷的Forestburg品种(Panicumvirgatum‘Forestburg’),种子由美国南达科他州立大学的Roger N. Gates教授提供,收种年份为2012年,产地美国。经风干清选后置于4℃冰箱中保存备用,试验于2016年9月在西北农林科技大学草业科学实验室进行。
1.2 化学试剂
试验所用化学试剂GA3、GA4+7、6-BA、IAA、ABA、FL与PA,购自上海源叶生物科技有限公司。
1.3 方法
1.3.1溶液的配置 根据试验所需植物生长物质的分子量,分别称取相应克数,将称取植物生长物质用少量酒精溶解并用去离子水配置成1 000 μmol·L-1的溶液,依次将上述溶液稀释成400,200,50,10 μmol·L-1,摇匀待用。
1.3.2不同浓度外源植物生长物质单独处理柳枝稷种子 每处理选取50 粒饱满的柳枝稷种子,放入铺设2层滤纸的直径为9 cm培养皿中,分别加入6 mL浓度为0,10,50,200,400,1 000 μmol·L-1的ABA,GA3,GA4+7,6-BA,IAA,FL,PA溶液浸湿,并封口,贴上标签[9],每处理3次重复。将所有处理的培养皿置于恒温光照培养箱内进行发芽试验,培养条件为:温度30±0.5℃,光照12 h;温度20±0.5℃,黑暗12 h。以胚根突破种皮作为发芽标准[10],一周后开始逐日统计发芽种子数,发芽时间为21 d,并按下列公式计算发芽率和发芽指数[11]。
发芽率(GR)=发芽种子数/供试种子数×100%;
发芽指数(GI)=∑(Gt /Dt) (式中,Gt指t日内发芽数,Dt指相应发芽天数)。
1.3.3不同外源植物生长物质混合处理柳枝稷种子 将浓度均为400 μmol·L-1的4种外源植物生长物质ABA,FL,GA3和PA两两之间进行等体积混合,混合后试剂最终浓度为200 μmol·L-1,以蒸馏水为对照进行萌发试验(同1.3.2)。
1.3.4不同外源植物生长物质处理后的萌发恢复率 发芽试验进行21 d后,种子萌发数目不再变化。在培养皿中选取未发芽的种子,用蒸馏水反复5次,使种子种皮上无残留激素。将冲洗干净的种子放入铺设2层滤纸的培养皿中,加入6 mL蒸馏水,封口,进行萌发恢复试验,条件同1.3.2,并按下列公式计算种子萌发恢复率[12]。
萌发恢复率=[(A-B)/(C-B)]×100% (式中,A表示全部萌发的种子数,B表示外源植物生长物质处理后的萌发种子数,C表示供试种子数)
1.4 数据分析
所有数据均用Excel 2003录入并用Sigmaplot作图,采用SPSS 21.0软件对数据进行One-way ANOVA双因素方差分析,采用Duncan’s法对均值作多重比较。
2 结果与分析
2.1 不同浓度外源植物生长物质单独处理对柳枝稷种子休眠与萌发的影响
外源植物生长物质种类、浓度以及其互作均能影响柳枝稷种子的萌发(图1)。从图1可知:与对照相比,较低浓度的10,200 μmol·L-1的IAA显著提高了种子萌发率(P<0.05),而高浓度的400,1 000 μmol·L-1显著抑制了种子萌发;10~200 μmol·L-1的GA3显著促进了种子萌发,1 000 μmol·L-1的GA3使种子的各项发芽指标降低;当GA4+7的浓度处于10~400 μmol·L-1时,种子的萌发指标都有所提高,其中最适浓度为200 μmol·L-1,而1 000 μmol·L-1使种子的各项萌发指标显著降低;各浓度的ABA均显著抑制了种子的萌发;用6-BA处理种子时,50 μmol·L-1起到了显著促进作用,当浓度大于50 μmol·L-1时,随着浓度的增加,萌发指标呈显著下降趋势;FL为ABA合成抑制剂,10 μmol·L-1的FL显著提高了种子的萌发指标,当浓度大于200 μmol·L-1时,随着处理浓度的增加,种子的各项萌发指标呈显著下降趋势;PA为GA3的合成抑制剂,当其浓度大于50 μmol·L-1时,开始对种子萌发产生明显的抑制作用。 总而言之,柳枝稷种子对不同激素浓度的敏感度不同,低浓度的IAA,GA3,GA4+7,6-BA,FL均有利于柳枝稷种子萌发,而高浓度会抑制其萌发,其中200 μmol·L-1的GA4+7对种子萌发的促进效果最好。
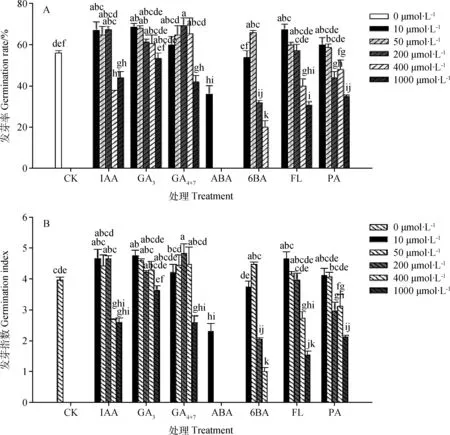
图1 不同浓度外源植物生长物质单独处理对柳枝稷种子萌发的影响:(A)发芽率; (B)发芽指数Fig.1 Effect of different plant exogenous growth substances with different concentrations on seed germination of switchgrass: (A)Germination rate (B) Germination index注:不同字母表示不同处理间差异显著(P<0.05),下同Note:Different letters indicate significant difference at the 0.05 level, the same as below
2.2 不同外源植物生长物质互作处理对柳枝稷种子休眠与萌发的影响
由图2可知,GA3+ABA, FL+ABA处理后柳枝稷种子几乎不萌发,与ABA单独处理的结果一致,与GA3和FL单独处理相比,种子萌发指标降低,表明在柳枝稷种子萌发过程中外源ABA的存在会缓解GA3与FL对种子萌发的促进作用;PA为GA3的合成抑制剂,经GA3+PA处理的种子萌发率为44%,与对照相比下降了12%,与相同浓度的GA3相比降低了17%,表明PA能缓解GA3对柳枝稷种子萌发的促进作用;FL+PA处理显著降低了种子萌发指标,相比于同浓度的FL单独处理萌发率下降了12%;GA3+FL处理对柳枝稷种子萌发无显著作用。

图2 不同外源植物生长物质互作处理对柳枝稷种子萌发的影响:(A)发芽率;(B)发芽指数Fig.2 Effect of different plant exogenous growth substances interactions on seed germination of switchgrass:(A) Germination rate; (B) Germination index
2.3 不同植物生长物质处理对柳枝稷种子萌发恢复率的影响
由图3可得,复萌处理后,种子经ABA 单独处理以及ABA+FL,ABA+GA3互作处理后,仍具有较高的萌发恢复率。50,200,400 μmol·L-1ABA处理的种子萌发恢复率均高于40%,而经1 000 μmol·L-1ABA处理的种子萌发恢复率为0,其它植物生长物质处理后的种子萌发恢复率与对照相比无显著差异性。

图3 不同处理柳枝稷种子的萌发恢复率:(A)不同浓度外源植物生长物质单独处理 ;(B)不同外源植物生长物质互作处理Fig.3 Recovery germination percentage of switchgrass after different treatments:(A) Different plant exogenous growth substances separately treated;(B)Different plant exogenous growth substances interaction
3 讨论
休眠是植物在长期繁殖演化中获得的,适应环境的一种生物学特性和适应性机制[13]。种子休眠并非是由单一因素控制的,而是一个及其复杂的生理调控过程,这个过程与激素平衡密切相关。休眠的解除与抑制物的消失、促进物的出现以及抑制物/促进物的比例有关[14]。在种子休眠获得和解除过程中, ABA和GA是一对相互拮抗、并起关键作用的内源信号分子,ABA获得并维持休眠,GA启动并促进种子萌发[15]。黄锦华等[16]研究发现,较高浓度的ABA直接影响了嵩草 (KobresiaL.)种子的萌发。低浓度外源ABA对羊草种子萌发无显著影响,而高浓度(>200 μmol·L-1)对种子萌发具有显著的抑制作用[10]。但本研究中发现各个浓度的ABA均对柳枝稷种子萌发产生显著抑制作用,这种抑制作用随着浓度的增加而增加。经较低浓度的ABA(<400 μmol·L-1)处理过的柳枝稷种子复水后,种子的萌发恢复率都显著高于对照。这可能是因为ABA透过种皮进入种子内部,因此复水后能够重新萌发,而经高浓度的ABA(1 000 μmol·L-1)处理过的种子复水后仍未萌发,可能是高浓度的ABA诱导柳枝稷种子进入二次休眠。罗富成等[17]在非洲狗尾草(Setariasphacelata)种子萌发的研究中表示,赤霉素可以使狗尾草中的化学抑制物钝化失效,同时激活内酶的活力,其中400 mg·L-1GA3处理效果最好。黄晓辉等[9]研究羊草(Laymuschinensis)种子休眠时发现,不同浓度的外源激素GA3对羊草种子萌发无显著促进作用,而GA4+7则可以显著提高种子的萌发率。在本研究中,较低浓度的GA3与GA4+7都可显著促进柳枝稷种子的萌发,但使用200 μmol·L-1GA4+7萌发效果最好。这可能是因为GA4+7分子极性更好,更容易进入柳枝稷种子内部,促进柳枝稷种子萌发。同时使用GA3和ABA 处理柳枝稷种子,种子基本不能萌发,这表明ABA缓解了GA3对种子萌发的促进作用,这可能是正负调控种子休眠的激素比例未达到解除休眠的标准,这需要进一步调整外源激素GA3与ABA的添加比例,来确定休眠破除时促进物与抑制物的适宜浓度。
刘建利[9]研究发现5 μmol·L-1的IAA能促进蒺藜状苜蓿(Medicagotruncatula)种子萌发,但吴元奇等[18]研究了激素含量在玉米(Zea mays)休眠中的变化,结果表明IAA与休眠无相关性,这一结论与本研究结果不一致。在本研究中,10~200 μmol·L-1IAA均对柳枝稷种子的发芽指标有显著促进作用,产生这种差异可能是由于不同种子本身的休眠程度、基因型不同而引起的。植物生长调节剂可以调节种子内源激素的分泌和合成,加快种子代谢过程,从而打破种子的休眠。雷雄等[19]在垂穗披碱草(Elynusnutan)种子休眠的研究中表明,低浓度(10~30 mg·L-1)的6-BA促进种子的萌发,高浓度(40 mg·L-1)抑制种子萌发。吴翠云等[20]研究了ABA对杜梨(Pyrusbetulaefolia)种子休眠的影响,结果表明ABA对种子的抑制作用可以在具有GA3的前提下被6-BA解除。本研究发现仅有50 μmol·L-16-BA对萌发有显著促进作用,表明适量浓度的6-BA可促进柳枝稷种子的萌发,但关于6-BA与GA3混合使用是否效果更好,仍需要进一步研究。
PA可以抑制内源赤霉素的合成,从而抑制种子萌发。裴润梅等[21]在研究多效唑对花生(ArachishypogaeaL.)萌发过程中发现,用多效唑浸种并不能提高种子的萌发率,反而抑制了胚轴的生长。但本研究结果显示低浓度PA(10~50 μmol·L-1)对柳枝稷种子萌发并无显著影响,而高浓度(>200 μmol·L-1)可以缓解GA3对柳枝稷种子萌发的促进作用。FL是ABA的合成抑制剂。冯丹[22]研究发现,FL可以抑制肉苁蓉(Cistanchedeserticola)种子内部ABA的合成从而促进种子萌发,但是对于外源大量抑制物没有作用,这与本研究结果相似。同时使用FL和ABA处理种子,FL对种子萌发的促进作用完全被ABA逆转,但是要得出上述结论,还需进一步验证柳枝稷种子刺破种皮和未刺破种皮时,FL与ABA互作对种子萌发的影响。PA可以抑制内源GA3的合成[23]。当FL与PA同时作用时,种子萌发率显著降低,但等比例加入FL与GA3时,对于种子萌发率无显著影响,这进一步说明内源GA3是种子萌发的前提物。
4 结论
10~200 μmol·L-1IAA和GA4+7, 10~50 μmol·L-1GA3, 50 μmol·L-16-BA及10 μmol·L-1FL均可对柳枝稷种子萌发产生促进作用,但是当其浓度过高时则会抑制柳枝稷种子萌发,诱导其进入二次休眠。PA对柳枝稷种子萌发较对照无显著作用,ABA会抑制柳枝稷种子萌发。GA4+7对柳枝稷种子萌发影响效果最好,其中200 μmol·L-1的GA4+7处理后柳枝稷种子萌发率最高为71%,较对照提高30%。
