芽孢杆菌BU108的分离鉴定及对马铃薯疮痂病的防治
2018-08-22向君亮申永瑞王佳琦殷奎德
宋 烨,向君亮,申永瑞,王佳琦,刘 权,殷奎德
(黑龙江八一农垦大学 生命科学技术学院,黑龙江 大庆163319)
马铃薯Solanum tuberosum是中国主要的粮食作物,黑龙江省的马铃薯种植面积一直居于前列,但近年来由疮痂链霉菌Streptomyces scrabies引起的马铃薯疮痂病日益严重,直接影响马铃薯的品质,造成了较大的经济损失[1]。马铃薯疮痂病首先会在马铃薯表面产生褐色的点状斑块,随着马铃薯的生长,点状斑块会随之扩大形成褐色圆形或不规则形的大斑块,感染后期斑块处细胞木栓化,致马铃薯表面形成凹陷或凸起的疮痂状粗糙硬斑块,严重影响马铃薯的外观品质和经济价值[2]。长期以来,马铃薯疮痂病的防治大多采用化学农药的方法,虽然短期内防治效果显著,但长期使用不仅污染环境和危害人类健康,还会造成土壤中的菌群失调,使得病原菌缺乏有效抑制而导致病害发生更加严重[3]。生物防治是马铃薯疮痂病防治的一个热点和趋势,该方法利用微生物及其分泌物来抑制病害的发生,不会对环境造成污染,是一种友好型的病害防治方法。目前,已报道了多种能够对马铃薯疮痂病具有防治效果的拮抗菌株,其中以芽孢杆菌Bacillus占多数,抑制效果也更加显著[4-5]。但是在前人利用芽孢杆菌作为生防菌防治植物病害的研究中,却发现有些生防菌株会出现异地防治效果不理想的状况,究其原因可能与菌株在土壤中的定殖能力以及受土壤中土著微生物的抑制有关[6-11]。生防菌株施用到土壤中,会面临生存环境的改变,抑菌物的分泌量可能会受到影响,进而影响生防菌株的抑菌效果。此外,不同地区土壤的菌群结构也存在差异,导致一个地区的生防菌株在另一个地区施用可能会由于不适应新的微生物菌群结构及生态环境,同样发挥不了理想的生物防治效果[12]。鉴于此,本研究从黑龙江省当地马铃薯疮痂病发病土壤中筛选鉴定适宜本地生态环境及土壤菌群结构的拮抗菌,对菌株的培养条件进行优化,通过盆栽实验检验菌株的实际防治效果,旨在为该菌应用到马铃薯疮痂病的生物防治提供理论依据。
1 材料与方法
1.1 材料
1.1.1 指示菌 病原菌疮痂链霉菌由本实验室保存提供。
1.1.2 样品 土样采自黑龙江省克山县马铃薯发病地块;马铃薯品种为 ‘大西洋’Solanum tuberosum‘Atlantic’。
1.1.3 培养基 YME 固体培养基: 麦芽糖 10.0 g·L-1, 酵母提取物 4.0 g·L-1, 葡萄糖 4.0 g·L-1, 琼脂20.0 g·L-1, pH 7.2; LB 固体培养基: 氯化钠(NaCl)10.0 g·L-1, 蛋白胨 10.0 g·L-1, 酵母浸粉 5.0 g·L-1,琼脂 20.0 g·L-1, pH 7.5; 发酵条件优化基础培养基[13]: 葡萄糖 10.0 g·L-1, 蛋白胨 10.0 g·L-1, 氯化钠 10.0 g·L-1,磷酸二氢钾(KH2PO4)1.5 g·L-1,硫酸镁(MgSO4·7H2O)1.5 g·L-1。
1.2 生防菌株的分离鉴定
1.2.1 菌株的筛选 采集有伤病的马铃薯周围的土壤带回实验室,土壤加水匀浆并倍比稀释至10-6,把10-4,10-5,10-6倍的土壤稀释液涂布。在平板上挑取单个菌落纯化培养,保存分离到的单个菌株,在涂有链霉菌的平板上做抑菌实验。
1.2.2 菌株的鉴定 形态观察:显微镜观察单菌的颜色、形状、状态。分子生物学鉴定:基于16S rDNA序列分析的生防菌株种属鉴定。50.0 μL聚合酶链式反应(PCR)反应体系:2.0 μL细菌基因组DNA,4.0 μL 10 mmol·L-116S 引 物 27f: 5′-AGAGTTTGATCCTGGCTCAG-3′和 1492R:5′-TACCTTGTTACGACTT-3′, 1.2 μL 10 μmol·L-1三磷酸碱基脱氧核苷酸(dNTPs), 4.0 μL 50 mmol·L-1氯化镁(MgCl2),5.0 μL 10×PCR缓冲液,0.3 μL DNA聚合酶。PCR扩增条件:95℃预变性3 min;95℃变性30 s,55℃退火30 s,72℃延伸90 s,40个循环,4℃无限循环。反应结果经8 g·L-1琼脂糖凝胶电泳进行条带检测,纯化后样品送交上海生工完成测序。所获得的碱基序列在美国生物技术信息中心(NCBI)数据库中进行Blast同源性对比,利用MEGA 5软件进行多序列比对并构建系统发育树。
1.3 发酵条件的优化
1.3.1 发酵方法及抑菌粗提液的制备 根据种子培养基的营养条件,分别更换不同质量浓度和种类的碳源、氮源及不同比例的无机盐离子和碳氮比(C/N)加入装有50 mL发酵液培养基的100 mL的三角瓶中,改变培养菌株的发酵条件(培养温度、pH值、培养时间等),将活化好的菌株接种到发酵液培养基中,37 ℃, 160 r·min-1恒温振荡培养 24 h 后。 菌液离心 4 min, 12 000 r·min-1, 菌液上清使用 0.22 μm 滤膜过滤后采用管碟法进行抑菌实验。
1.3.2 抑菌活性的测定 抑菌活性的测定采用管碟法,把培养好的病原菌用涂布棒涂匀在已制作好的平板,在平板上放牛津杯加入抑菌物粗提液。抑菌活性通过测量抑菌圈的半径,计算平均值比较大小进行确定。
1.3.3 适宜碳源的确定 根据培养基的营养条件,采用单因素多水平试验设计方法,分别加入10.0 g·L-1的葡萄糖、乳糖、麦芽糖、蔗糖作为不同的碳源,其他因素同种子液培养基,重复5次·水平-1,采用管碟法测定抑菌活性确定适宜碳源的种类。
1.3.4 适宜氮源的确定 在适宜碳源试验结果基础上,根据培养基的营养条件,设计氮源单因素多水平试验,分别加入10.0 g·L-1的蛋白胨、胰蛋白胨、大豆蛋白胨、酵母浸粉、牛肉粉作为不同的氮源,其他因素不变,重复5次·水平-1,采用管碟法测定抑菌活性确定适宜的氮源种类。
1.3.5 适宜C/N的确定 在适宜碳、氮源试验结果基础上,根据培养基的营养条件,设计C/N单因素多水平试验, 选取 C/N 分别为 1∶1, 1∶2, 1∶3, 1∶4, 1∶5 进行发酵试验, 其他因素不变, 重复 5 次·水平-1,采用管碟法测定的抑菌活性确定适宜的C/N。
1.3.6 无机离子正交试验 在适宜碳、氮源及C/N试验结果基础上,根据培养基的营养条件,选择培养基中的 KH2PO4, MgSO4·7H2O, NaCl为正交试验因素,设计3水平3因素试验(表1),设置空白项为对照(ck1)。 分别将不同水平的 KH2PO4, MgSO4·7H2O,NaCl加入发酵培养基中,培养基pH值调至
pH 7.0,其他因素不变,重复5次·水平-1,采用管碟法测定抑菌物活性确定适宜的无机离子。
1.3.7 最适pH值 在适宜碳,氮源,C/N,无机离子正交试验结果基础上,根据培养基的营养条件,设计初始最适pH值单因素多水平试验,分别调节初始pH值为pH 5,pH 6,pH 7,pH 8,pH 9,重复5次·水平-1,采用管碟法测定抑菌活性确定适宜的pH值。
1.3.8 最适温度 在适宜碳,氮源,C/N及pH值,无机离子正交试验结果基础上,根据培养基的营养条件,设计培养温度单因素多水平试验,分别调节初始温度为22,28,32,37,44℃,重复5次·水平-1,采用管碟法测定抑菌活性确定最适温度。
1.3.9 培养时间 在上述最佳培养条件确定基础上,根据培养基的营养条件,设计培养时间单因素多水平试验,分别设置8,10,12,14,16,18,20,22,24,26,28和30 h的培养时间,重复3次·水平-1,采用管碟法测定的抑菌活性确定适宜的培养时间。
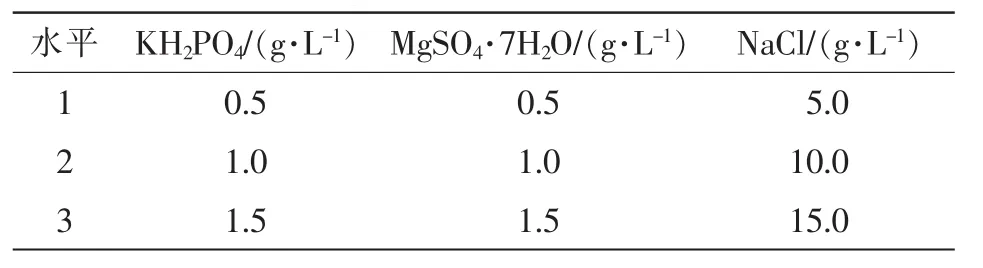
表1 无机离子实验因素质量浓度表Table 1 Level of orthogonal experimental factors of inorganic ions
1.4 菌株BU108对马铃薯疮痂病的防效盆栽实验
实验在黑龙江八一农垦大学大庆市重点实验室中进行,采用盆栽实验,实验用盆钵为28 cm×20 cm的聚乙烯塑料盆,钵装风干土为3 kg·盆-1,装入马铃薯疮痂病发病土壤。选取健康的有芽马铃薯,用清水冲洗干净,切成三角块,在盆钵土壤中植入2块有芽马铃薯,芽尖向上。同时制备发酵培养基,接种BU108生防菌。设置3组处理,重复6次·处理-1,分别为对照(ck2),低浓度BU108(1×108cfu·m-2)和高浓度BU108(1×1010cfu·m-2)。各个处理中菌液最终施用量为100 mL,在栽种时加入菌液,之后不再添加,栽种前浇水1 000 mL。根据马铃薯生长情况定量加水,待马铃薯成熟后,进行病斑数的统计与分析。
2 结果与分析
2.1 土壤中菌株的分离筛选和鉴定
从有病害马铃薯根际土壤中分离得到200余株菌株,命名按BU1,BU2,BU3等依次排列,对所有得到的菌株进行抑菌实验。结果显示:BU108与其他菌株相比抑菌圈半径最大,抑菌效果最为明显(图1)。BU108菌落形态白色不透明,边缘不整齐、干燥、中间有星状皱起;在液体培养基中色暗、皱褶、完整的膜、轻度混浊,可知BU108对疮痂链霉菌有抑菌效果。在16S rDNA序列分析的基础上进行NCBI序列比对,找到与目的菌株相似度最为接近的碱基序列。应用MEGA5软件对这些碱基序列进行分析,构建系统进化树。从图2可以看出:BU108属于芽孢杆菌属,但与目前鉴定到的芽孢杆菌种之间存在不同,与Bacillus sp.(KT583425.1)亲缘关系最近。
2.2 培养条件的优化
2.2.1 适宜碳源的选择 分别用葡萄糖、麦芽糖、乳糖、蔗糖代替培养基中的葡萄糖。结果显示:抑菌实验的半径平均值分别为11,7.6,7.8和8.2 mm。由图3可知:当葡萄糖作为碳源时,抑菌效果最为明显。由方差分析可知:组内间的差异较小,而且葡萄糖与其他的碳源有极显著差异(P<0.01),因此确定葡萄糖为最佳碳源。
2.2.2 适宜氮源的选择 在最佳碳源确定的基础上,分别用胰蛋白胨、蛋白胨、大豆蛋白、牛肉粉、酵母浸粉代替培养基中的蛋白胨。结果(图4)显示:抑菌实验的半径平均值分别为6.8,6.6,6.4,7.2和8.6 mm。当酵母浸粉作为氮源时,抑菌效果最为明显。由方差分析可知:酵母浸粉与其他的氮源有极显著差异(P<0.01),因此确定酵母浸粉为最佳氮源。
2.2.3 适宜C/N的选择 碳源和氮源之间的比例对微生物的生长和代谢同样重要。 在最佳碳、 氮源确定的基础上, 设置 C/N 为 1∶1, 1∶2, 1∶3, 1∶4, 1∶5。 结果显示(图 5): 抑菌圈的半径平均值分别9.0,12.5,7.3,7.8和7.0 mm。当C/N为1∶2时抑菌效果最为明显,与方差分析组内间的差异较小,与其他组间有极显著差异(P<0.01),因此确定最佳C/N为1∶2。
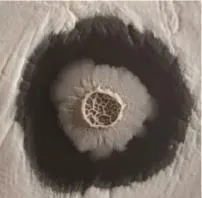
图1 BU108抑制疮痂链霉菌Figure 1 Inhibiton of BU108 against Streptomyces scabies
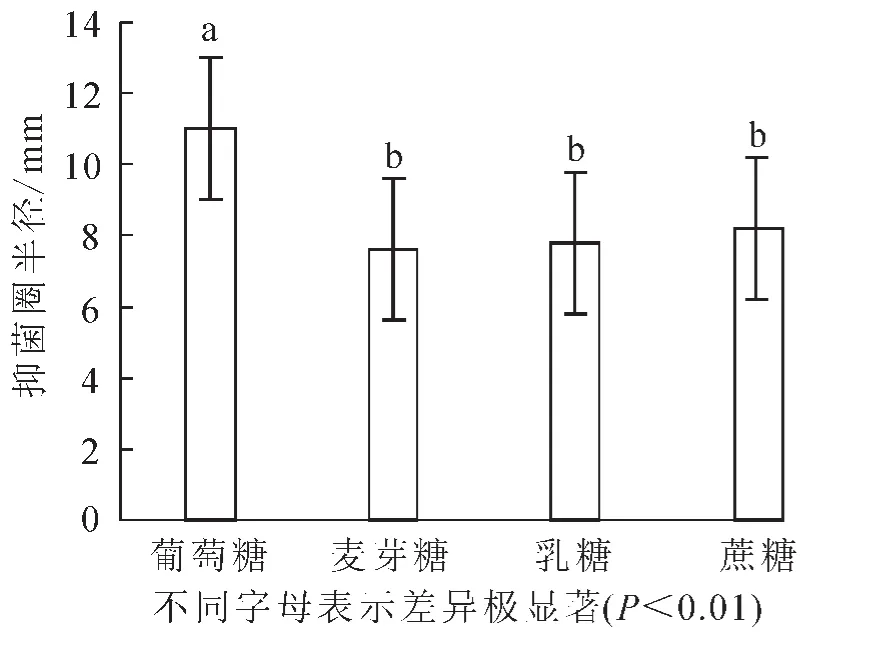
图3 碳源对芽孢杆菌BU108抑菌活性的影响Figure 3 Effect of carbon source on the activity of Bacillus BU108
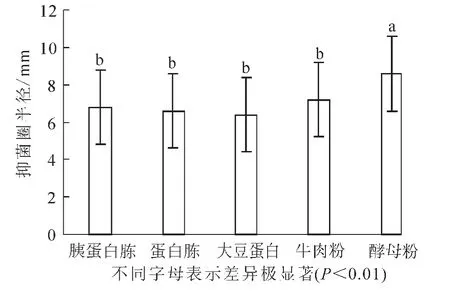
图4 氮源对芽孢杆菌BU108抑菌活性的影响Figure 4 Effect of nitrogen source on the activity of Bacillus BU108
2.2.4 适宜的无机离子 在最佳碳源、氮源和C/N确定的基础上改变无机离子的浓度,并检测无机离子对抑菌活性影响。由表2可知:NaCl对抑菌效果影响最大,极差R大小依次为NaCl>MgSO4·7H2O>KH2PO4>ck。由表3可知:NaCl对抑菌物的产生影响最大,影响最小的为KH2PO4。可见,NaCl质量浓度为5.0 g·L-1时对菌株的抑菌效果最佳。
2.2.5 最适pH值 在最佳碳源、氮源和C/N及无机离子比例确定的基础上,改变培养基pH为5,6,7,8,9。结果(图6)显示:抑菌圈的半径平均值分别为9.0,9.6,9.8,12.4和8.4 mm。当pH为8时,抑菌效果最为明显,由方差分析可知各个组内间的差异较小而且pH为8时与其他组有极显著差异(P<0.01),因此确定pH 8是最佳pH值。
2.2.6 培养温度 在最佳碳源、氮源、C/N和无机离子比例及pH确定的基础上,设置培养温度为22,28,32,37,44℃。结果(图7)显示:抑菌圈的半径平均值分别为9.0,12.6,9.0,8.2和7.0 mm。芽孢杆菌BU108在22,32,37℃下生长良好,在44℃下生长一般,28℃下生长情况最佳。由方差分析可知:培养温度为28℃时组内间的差异较小,与其他组相比具有极显著差异(P<0.01),因此28℃为最佳培养温度。
2.2.7 培养时间 培养时间过长营养物质消耗殆尽不利于菌株的生长,时间过短微生物代谢物质的分泌量不足影响菌株的抑菌效果。在最佳碳源、氮源、C/N、无机离子比例和pH值及培养温度确定的基础上,设置培养时间为8,10,12,14,16,18,20,22,24,26,28和30 h。结果显示(图8):抑菌实验的半径平均值分别5.2,5.2,6.7,7.2,7.7,8.3,8.7,11.7,9.0,7.7,7.0和6.3 mm。22 h时抑菌半径最大,抑菌效果最好。由方差分析可知:组内间的差异较小,与其他组相比具有极显著差异(P<0.01),因此最适培养时间为22 h。

图5 C/N对芽孢杆菌BU108抑菌活性的影响Figure 5 Effect of C/N on the antagonistic activity of Bacillus BU108
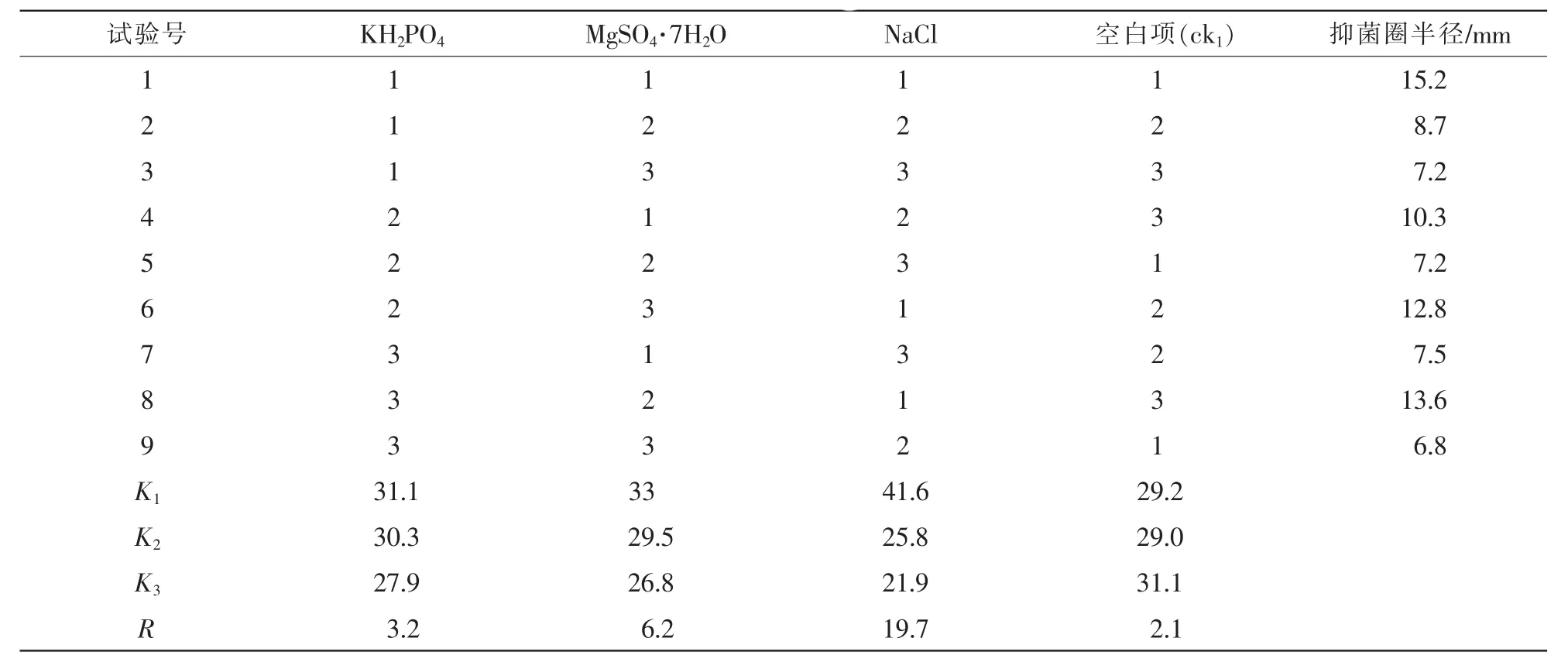
表2 无机离子对抑菌活性影响的正交试验结果Table 2 Results of orthogonal tests on the effect of inorganic ions on the yield of antimicrobial agents
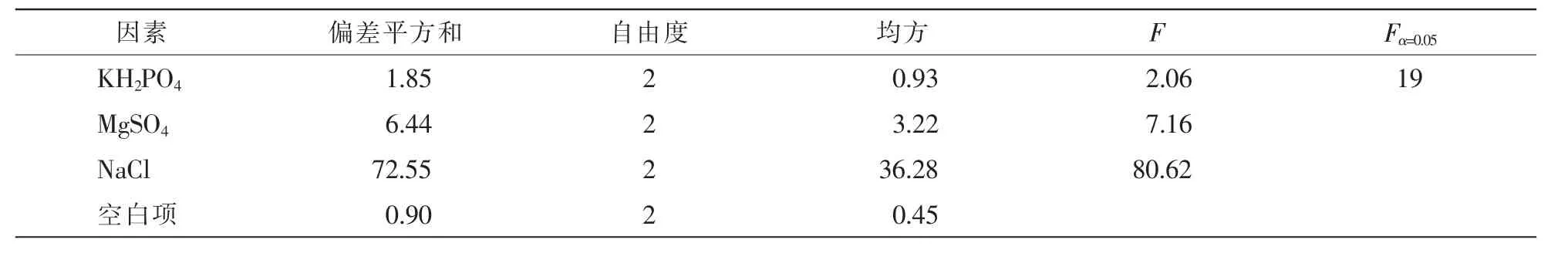
表3 无机离子对抑菌活性影响的方差分析Table 3 Variance analysis of the effect of inorganic ions on antibacterial activity
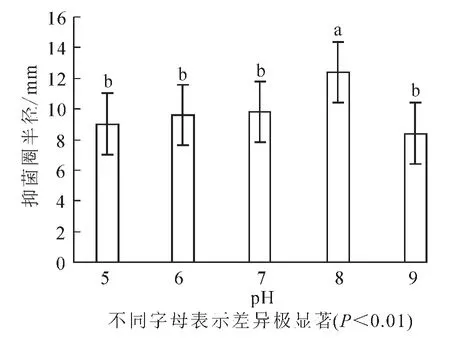
图6 pH对芽孢杆菌BU108抑菌活性的影响Figure 6 pH effect on the antibacterial activity of Bacillus BU108
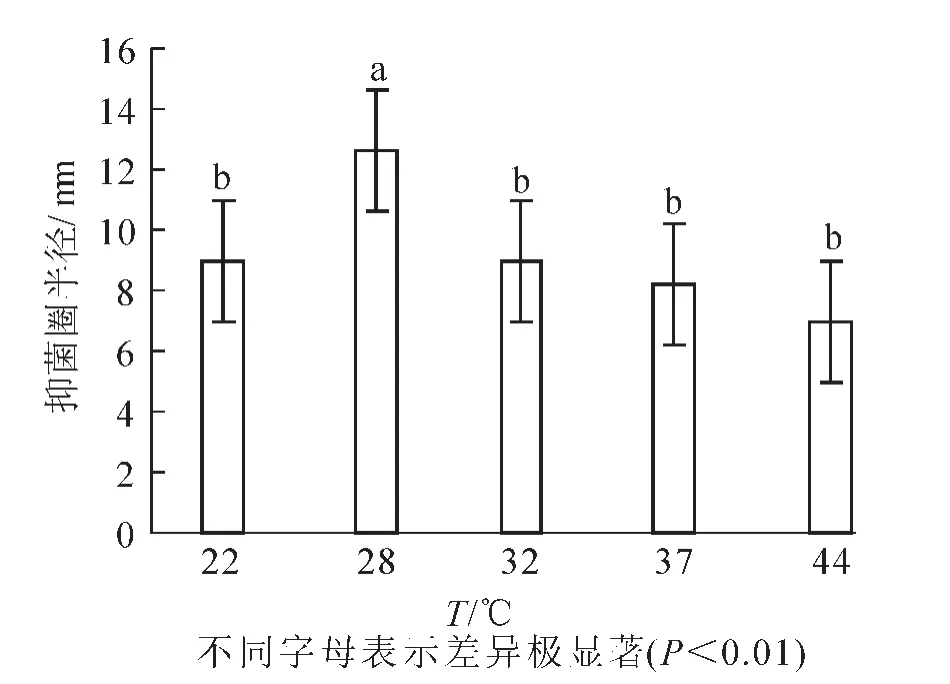
图7培养温度对芽孢杆菌BU108抑菌活性的影响Figure 7 Effect of culture temperature on the antibacterial activity of Bacillus BU108
2.3 菌株BU108对疮痂病的防治效果
对3组处理的盆栽实验的病斑数进行统计(图9):对照组的病斑数平均值为12.0,高浓度BU108组的病斑数平均值为1.0,低浓度BU108组的病斑数平均值为8.3。由方差分析可知:高浓度BU108组与其他组别间有极显著差异,抑制率为91.6%。低浓度BU108组与对照之间有极显著差异(P<0.01),抑制率为30.8%。表明芽孢杆菌BU108能够抑制马铃薯疮痂病的发生,且浓度越高,抑制效果越好。
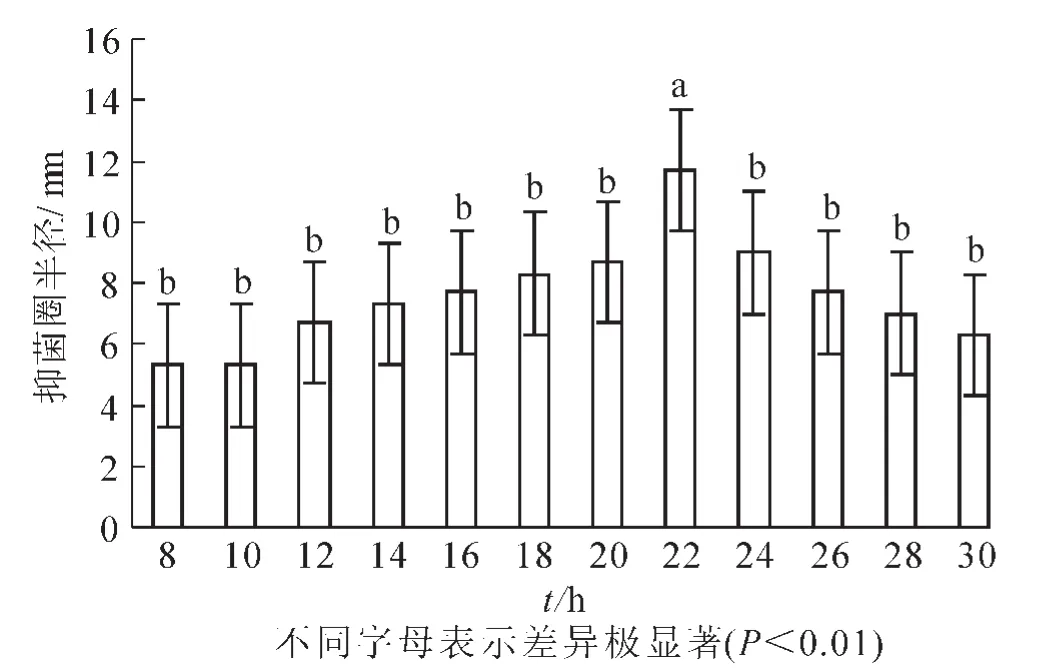
图8 培养时间对芽孢杆菌BU108抑菌活性的影响Figure 8 Effect of culture time on the antibacterial activity of Bacillus BU108
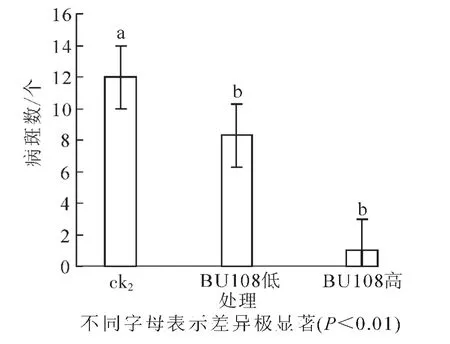
图9 芽孢杆菌BU108对马铃薯疮痂病的影响Figure 9 Effect of Bacillus BU108 on potato scab
3 结论与讨论
本研究通过平板涂布法、平板划线法分离单菌,利用本实验室提供的病原菌筛选拮抗菌,对200余株菌株做抑菌实验,测量抑菌圈的半径,发现菌株BU108抑菌圈半径最大,抑菌效果最为明显。通过形态学观察和菌株的进化树分析,初步确定BU108属于芽孢杆菌。因BU108与目前已知的芽孢杆菌序列之间存在较大不同,无法归类到具体的种。
通过摇瓶发酵对芽孢杆菌BU108抑菌活性物质的培养条件进行了研究,BU108的最佳培养条件:碳源为葡萄糖, 氮源为酵母浸粉,C/N为1∶2,无机离子KH2PO4为 0.5 g·L-1,MgSO4·7H2O为0.5 g·L-1,NaCl为5.0 g·L-1,pH 8,培养时间为22 h,培养温度为28℃。有些生防菌的最佳碳源为葡萄糖、氮源为大豆饼粉[14-15],最佳的pH偏酸性[16],而BU108的最佳碳源为葡萄糖、氮源为酵母浸粉,在偏碱性条件下生长良好并且抑菌效果最佳。证明其培养条件的不同对芽孢杆菌BU108菌株抑菌物的产生有很大影响。无机离子质量浓度对BU108菌株抑菌物的产生也有很大影响,在本研究中无机离子质量浓度最小时,抑菌效果最好。由此可见,生防菌株不同其培养条件相差很大,每个菌株都有其相应的营养要求和培养方式。
本研究采用盆栽实验检验了菌株BU108对马铃薯疮痂病的抑制效果。实验设置了不同浓度的生防菌发酵液处理土壤,发现抑菌效果与发酵菌液的浓度之间存在正相关,发酵液浓度高的处理组其抑菌效果也高。原因可能是低浓度的发酵液菌数少则抑菌物分泌量也相对较少,抑制率也低。本研究确定了BU108在土壤中具有抑制疮痂病发病的效果,可以作为生物防治的候选。本次盆栽试验为了保证马铃薯发病,盆栽土壤采用马铃薯疮痂病发病土壤,马铃薯发病和生防菌抑菌效果表现良好,但是在实际应用中面对复杂的土壤微生物,能否取得理想效果还有待检验。
在前人利用芽孢杆菌防治植物病害的研究中,芽孢杆菌多与其他微生物或药剂共同使用[17-20]。在今后的实际应用中也可以尝试与其他生防菌组合使用,增强对马铃薯疮痂病的抑制效果。
4 参考文献
[1] 郝智勇.马铃薯种薯疮痂病成因及防治措施[J].黑龙江农业科学,2017(1):158-159.HAO Zhiyong.Formation factors and prevention measures of potato scab [J].Heilongjiang Agric Sci,2017(1):158-159.
[2] 李洪浩,丁凡,余韩开宗,等.马铃薯疮痂病的发生及防治措施[J].四川农业科技,2017(2):25-26.LI Honghao,DING Fan,YU-HAN Kaizong,et al.Occurrence and control measures of potato scab [J].Sichuan Agric Sci Technol,2017(2):25-26.
[3] CAAMAÑO-ANTELO S,FERNÁNDEZ-NO I C,BÖHME K,et al.Genetic discrimination of food borne pathogenic and spoilageBacillusspp.based on three housekeeping genes [J].Food Microbiol,2015,46:288-298.
[4] 朱玥妍,刘姣,杜春梅.芽孢杆菌生物防治植物病害研究进展[J].安徽农业科学,2012,40(34):16635-16638.ZHU Yueyan,LIU Jiao,DU Chunmei.Research progress of biological control in plant diseases byBacillusspp.[J].J Anhui Agric Sci,2012,40(34):16635-16638.
[5] 齐爱勇,赵绪生,刘大群.芽孢杆菌生物防治植物病害研究现状[J].中国农学通报,2011,27(12):277-280.QI Aiyong,ZHAO Xusheng,LIU Daqun.Research of biological control in plant disease byBacillusspp. [J].Chin Agric Sci Bull,2011,27(12):277-280.
[6] 郭凤柳,张海颖,李勇,等.马铃薯疮痂病拮抗菌株B1的鉴定及防效测定[J].江苏农业科学,2013,41(5):90-93.GUO Fengliu,ZHANG Haiying,LI Yong,et al.The identification and determination of antibacterial effect against potato scab of antagonistic strain B1 [J].Jiangsu Agric Sci, 2013,41(5):90-93.
[7] 李勇.马铃薯疮痂病菌拮抗菌的鉴定及抑菌药剂室内筛选[D].保定:河北农业大学,2012.LI Yong.Identification of Antagonistic Bacterium and Screening of Bactericides Against Potato Common Scab Pathogens[D].Baoding:Agricultural University of Hebei,2012.
[8] 李美丽.枯草芽孢杆菌B2发酵工艺初探及其田间定殖和促生防病效果研究[D].兰州:甘肃农业大学,2008.LI Meili.Preliminary Study on Fermentation Technology of Bacillus subtilis B2and Its Effects on Colonization and Growth Promoting in the Field[D].Lanzhou:Gansu Agricultural University,2008.
[9] 张建平,哈斯,林团荣,等.不同杀菌剂对马铃薯疮痂病的防效试验[J].中国马铃薯,2013,27(2):83-86.ZHANG Jianping,HA Si,LIN Tuanrong,et al.Control efficacy of various fungicides on potato common scab [J].Chin Potato J,2013,27(2):83-86.
[10] 朱茂山,赵奎华,刘长远,等.枯草芽孢杆菌B18菌株对黄瓜枯萎病菌抑菌作用研究[J].辽宁农业科学,2003(3): 39.ZHU Maoshan,ZHAO Kuihua,LIU Changyuan,et al.Study on the bacteriostasis ofBacillus subtilisB18 to cucumber fusarium wilt[J].Liaoning Agric Sci,2003(3):39.
[11] 叶晶晶,曹宁宁,吴建梅,等.生防芽孢杆菌的应用研究进展[J].西北农林科技大学学报(自然科学版),2014, 42(8): 185 - 190.YE Jingjing,CAO Ningning,WU Jianmei,et al.Research progress on application of biocontrolBacillus[J].J Northwest A&F Univ Nat Sci Ed,2014,42(8):185 - 190.
[12] 陈志谊,刘永峰,刘邮洲,等.植物病害生防芽孢杆菌研究进展[J].江苏农业学报,2012,28(5):999-1006.CHEN Zhiyi,LIU Yongfeng,LIU Youzhou,et al.Research progress in biocontrol ofBacillusspp.against plant diseases [J].Jiangsu J Agric Sci,2012,28(5):999 - 1006.
[13] 马晓丹,张红星,钟思琼,等.枯草芽孢杆菌C3产抗菌物质发酵培养基的优化[J].中国酿造,2012,31(5): 10 - 14.MA Xiaodan,ZHANG Hongxing,ZHONG Siqiong,et al.Optimization of fermentation medium for antimicrobial substances fromBacillus subtilisC3 [J].Chin Brew,2012,31(5):10 - 14.
[14] 宋卡魏,王星云,张荣意.培养条件对枯草芽孢杆菌B68芽孢产量的影响[J].中国生物防治,2007,23(3):255-259.SONG Kawei,WANG Xingyun,ZHANG Rongyi.Culture conditions affecting spore production ofBacillus subtilisB68 [J].Chin J Biol Control,2007,23(3):255 - 259.
[15] 郝林华,孙丕喜,姜振波,等.枯草芽孢杆菌(Bacillus subtilis)液体发酵条件[J].上海交通大学学报(农业科学版), 2006, 24(4): 380 - 385.HAO Linhua,SUN Peixi,JIANG Zhenbo,et al.Liquid fermentation conditions ofBacillus subtilis[J].J Shanghai Jiaotong Univ Agric Sci,2006,24(4):380 - 385.
[16] YOUNIS M A M,HEZAYEN F F,NOUR-ELDEIN M A,et al.Optimization of cultivation medium and growth conditions forBacillus subtilisKO strain isolated from sugar cane molasses [J].Ame-Eur J Agric Environ Sci,2010,7(1):31 - 37.
[17] 时新瑞,范书华,邵广忠,等.利用新型土壤颗粒剂防控马铃薯疮痂病[J].中国马铃薯,2015,29(6):362-364.SHI Xinrui,FAN Shuhua,SHAO Guangzhong,et al.Prevention of potato scab using new soil granules [J].Chin Potato J,2015,29(6):362 - 364.
[18] 孙静,金光辉,刘喜才.不同药剂及施用方式对马铃薯疮痂病的防效[J].中国马铃薯,2015,29(2):107-111.SUN Jing,JIN Guanghui,LIU Xicai.Control effect of different fungicides and application methods on potato common scab disease [J].Chin Potato J,2015,29(2):107 - 111.
[19] 张露,艾玉廷,马健,等.不同比例氟啶胺对马铃薯块茎疮痂病防治效果[J].中国马铃薯,2013,27(3):175-178.ZHANG Lu,AI Yuting,MA Jian,et al.Control efficacy of various leaves of fluazinam on potato tuber common scab[J].Chin Potato J,2013,27(3):175 - 178.
[20] 陈志谊.芽孢杆菌类生物杀菌剂的研发与应用[J].中国生物防治学报,2015,31(5):723-732.CHEN Zhiyi.Research and application of bio-fungicide withBacillusspp. [J].Chin J Biol Control,2015,31(5):723-732.
