烟草PVY抗病机理研究现状及展望
2018-08-20朴世领
万 悦, 冯 月, 朴世领
(延边大学农学院,吉林 延吉 133002)
烟草马铃薯Y病毒病又称“脉带病”、“脉坏死病”,于1931年由Smith首次发现,是危害农作物的重要病毒之一,在全球广泛传播并造成了严重的经济损失[1]。作为一种系统侵染烟草的病害,它由马铃薯Y病毒(Potato virus Y,PVY)引起,发病时间为烟株的成长期(主要集中在5月中下旬~6月上旬),主要通过烟蚜介体传播,引起烟株花叶、斑驳、矮化、畸形、脉带坏死等症状,严重影响烟叶的质量与产量。发病时会造成烟株生长发育迟缓,甚至停滞,该病常和TMV、CMV等多种病毒复合侵染,造成严重危害[2]。烟草作为中国种植历史悠久的重要经济作物[3],对经济发展具有重要作用[4],并且烟草行业为国家提供了大量财政收入[5]。烟草为易感病作物,如南方烟区普遍发生的重要细菌性病害烟草青枯病(Ralstonia solanacearum)[6]以及本文主要研究的PVY病毒病都对烟草的生长具有重要影响。当PVY感染烟株更为严重时,病叶烤晒后色泽和烟味较差,品质显著降低,烟碱降低、总氮、硝酸盐含量有所上升,导致其失去商品价值,给烟农带来重大经济损失。PVY在85 ℃高温条件下仍能保持活性[7],主要通过蚜虫和汁液摩擦的方式传播,当病叶与健叶间稍有摩擦,叶片上的茸毛受到损伤,健叶就有可能感染病毒,使烟株表现出花叶斑驳、畸形、脉带坏死等症状[8]。因此,烟草PVY具有传播范围广、途径多的特点。
目前国内育种利用的PVY抗源数量少、大量烟草种质资源抗性不明,我国主要栽培的烟草品种(系)如云烟87、K326、吉烟9号、吉烟10号等均不是PVY抗病品种[9]。目前在PVY病毒病的防治上仍然以治蚜防病和农业防治为主,但经过多种作物分子辅助育种的实践证明,最根本、最经济和最有效的抗病手段是利用分子育种手段选育高抗PVY的新型烟草品种。因此,在PVY病害日渐严重的情况下,在种质资源库中筛选高抗PVY 供体亲本资源,选育抗性和农艺性状兼优的新品种,对选育高抗PVY的烟草品种具有重大意义。
1 马铃薯Y病毒(PVY)的生物学特性
1.1 马铃薯Y病毒(PVY)的形态结构
马铃薯Y病毒(PVY)属于马铃薯Y病毒科(Potyviridae)马铃薯Y病毒属(Potyvirus),微弯曲线状粒体结构,长约680~900 nm,宽约11~12 nm,由约2 000个CP亚基包裹的基因组RNA组装而成,病毒颗粒核衣壳螺旋的螺距为 3.3~3.5 nm,每圈7~8个CP亚基,PVY的基因组长约9 700 nt,不同株系间序列差异明显。外壳蛋白(CP)是该病毒唯一的外包结构蛋白,具有3个球状空间结构域:N端、C端和抗胰蛋白酶的核心区,由单一多肽链构成,主要由特异性抗原决定簇构成,其内部有一单链正义RNA,不同的N端长度和差异会使CP长度和氨基酸序列受到影响而产生差异。
1.2 马铃薯Y 病毒(PVY)的株系分化
1931年Smith 首次命名PVY,至今仍有许多新的PVY 株系陆续被发现、进化并传播到一些新的地区[10-15]。在PVY病毒感染烟草的过程中,感染初期是根据PVY病毒在烟草的不同品种和其它寄主上所出现的症状反应,并通过其表现出的症状将PVY大概分成3个株系,即:烟草脉坏死株系(Tobacco veinal necrosy strains,PVYN)、点刻条纹株系(Stipple streak strains,PVYC)和普通株系(Common strains,PVYO)。1953年起PVY病毒首先在欧洲马铃薯种植区广泛流行,随后20世纪90年代初在亚洲开始呈现上升趋势。吉林烟区除上述3种株系外还有PVYNS,即茎坏死株系[1], 该株系表现为叶主脉和茎先变为褐色,然后坏死。目前4种株系暴发流行严重[16]。
到20世纪90年代,人们发现了1个新的PVY 株系称为PVYZ,该株系具有克服抗病基因Nz的抗病性,在马铃薯品种(如Maris Bard 和PentlandIvory) 上可以引起过敏反应。在这之后又鉴定出PVYE株系,该株系具有可以克服抗病基因Nz的马铃薯品种(如Maris Bard)使其致病的作用[17-18]。现如今生物信息学已经成为对于更加深入研究PVY的进化、多样性以及PVY的地理起源的重要手段,即利用生物信息学技术对比分析PVY全基因序列或者是其部分序列。随着生物技术与分子生物学的发展,对于PVY的研究重点开始从寄主植物反应向着分析PVY的核酸序列差异、分子特征及PVY与寄主间的分子互作方向发展,经研究发现和证实了越来越多不同个数的重组位点以及重组型PVY株系。在美国和德国依次发现了Eu-PVYN和NA-PVYN/NTN重组型PVY[13、19],随后证明了若PVYN和PVYO在HC-Pro编码区有1个或2个位点发生重组则产生新的株系PVYN : O,有些类型最多可具有4个重组位点[20-22]。即PVYN,PVYC,PVYO,PVYZ和PVYE为基础株系;PVYNS,Eu-PVYN,NA-PVYN/NTN和PVYN:O为变异株系。2015年万秀清等[23]采用多重PCR技术预测手段,鉴定分析了黑龙江省烟叶产区的107份疑似PVY样品,结果表明,4个有代表性的 PVY 分离物 HLJ-SH8、HLJ-SC2、HLJ-SC6 和 HLJ-MDJ4,都包含的开放读码框(ORF),编码1个由3 061 个氨基酸组成的多聚蛋白。对这 4 个 PVY 分离物进行系统进化树分析,结果表明分别为 PVYNTN、PVYN、PVYNW和 PVYNTN/NW株系。
1.3 马铃薯Y病毒(PVY )的分子特征
PVY粒体呈弯曲线状, 单链有义RNA 基因组的大小约10 kb,相对分子质量约3.1×106~3.5×106。PVY基因组是一个长的开放阅读框,5′端存在1个以共价键结合的基因组相关蛋白(VPG),基因组的3′端有1个Poly(A)尾巴,首先翻译成1个多聚蛋白,之后通过自身编码的蛋白酶将多聚蛋白加工成多个成熟的蛋白来行驶其各种功能。从5′端到3′端的蛋白依次是 P1、HC-Pro、P3、C1、NIa、NIb和CP蛋白(图1)。
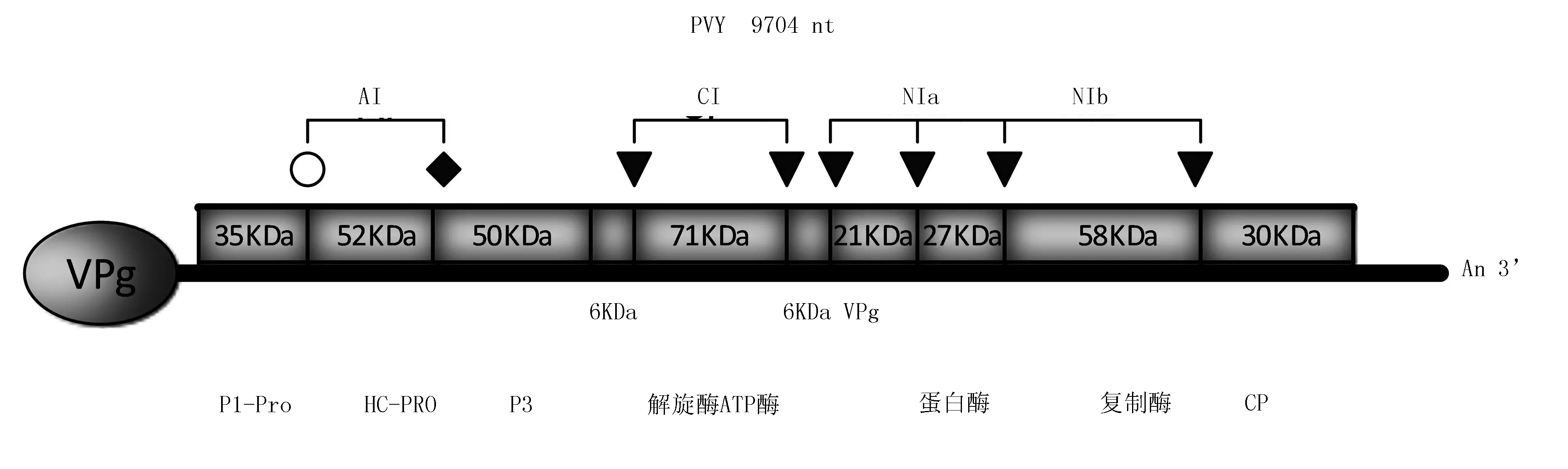
图1 马铃薯 Y 病毒基因组及其产物(陈荣平等,2000)
病毒基因组会编码1个长为350 kDa的多聚分蛋白,而后切割出8~10个产物,NIa、HC-Pro以及P1这3种蛋白酶就是病毒所编码的蛋白酶,切割、加工和翻译过程由这3种蛋白酶共同作用。在这之中P1的主要功能是和单链 RNA 结合,并作用于基因的扩增,HC-Pro是1种多功能蛋白酶,其功能包括:将蛋白质水解,蚜传,可使病毒RNA得到积累以及在病毒RNA的系统移动方面发挥作用,并且在抑制基因沉默方面也起到一定作用[24]。这个多聚蛋白被蛋白酶NIa催化,在其3’端的2/3长度内各个位点切割断裂。NIa蛋白酶作用于整个多聚蛋白3′端2/3,催化切割各个位点,使其断裂,共形成6个 NIa蛋白酶的切割位点,分别命名为 A、B、C、D、E、F,HC-Pro和P1,再分别对其余1/3长度内进行催化切割,形成HC-Proh及P1(图2)。研究发现这个区域对于催化水解过程和识别各自切割位点有重要作用。
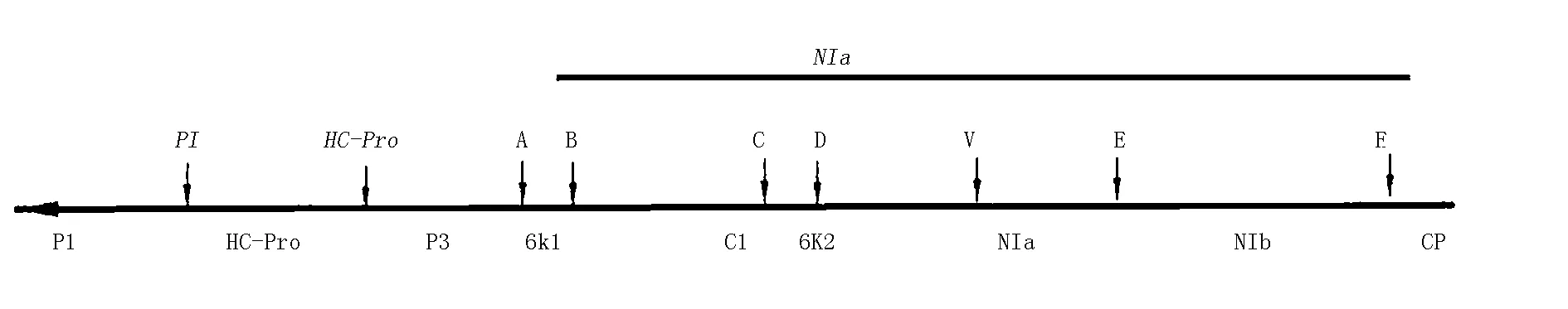
图2 NIa 蛋白酶催化水解的位点(Jose Luis Riechmann,et al,1992)
2 马铃薯Y病毒(PVY)属的致病机理
通过研究[25]表明,大多数Potyvirus能够引发明显的症状,决定症状特征和严重程度的主要因素除了病毒和特定株系之外,寄主生理环境和发育条件发生改变也是重要的影响因素,即发病时表现出的症状是寄主与病毒间复杂细胞与超细胞相互作用的结果。病毒复制和积聚水平通常由亲和性寄主和病毒组合后症状的严重性来反映。现在已经表明Potyvirus症状的形成和几个区域基因组有着一定程度的联系。利用对TMVTobacco (vein mottling virus)基因组的突变进行分析研究,发现P1/HC-Pro 编码区尤其是P1/HC-Pro的5’端编码区对烟草症状起到决定性作用。Johansen等[26]对2个PSbMV(Pea seed-borne mosaicvirus)株系进行重组杂种的构建证明了对豌豆症状产生的重要影响因素是编码PSbMV的NIa和NIb蛋白片段。而2个分离的TEV(Tobacco etch virus)基因组片段将对Tabasco辣椒的萎焉症状产生影响[27],分别覆盖P3蛋白编码区的3’端和CI、6K的3’端、NIa 编码区的5’端。另外,当对PPV(Plum pox virus)的P3-6K1切割位点进行插入突变,症状情况有轻重的改变[28]。经过对PPV更加深入的研究后发现在5’NTR从127~145核苷酸发生缺失的时候,只能使克利夫兰烟草的症状有所减轻[29]。TVMV的3’NTR,14个腺嘌呤和尿嘧啶的4次重复结构也可以起到减轻烟草患病症状的作用。
但是,对这些症状仍然不能采用同一个原理来说明形成原因。尽管在没有接种情况下其他病毒属有某些特意的病毒基因产物对症状有诱导作用[30-32],但对于Potyvirus来说,证据还不够充分。一部分病毒蛋白与寄主蛋白的相互作用伴随着生物分子荧光补充分析和酵母双杂交系统等技术发展应用已经被证实,如:Potyvirus的VPg 蛋白与植物的eIF4E(eukaryotic translation initiation factor 4E)基因[33]、HC-Pro蛋白与拟南芥的20S蛋白酶体、HC-Pro蛋白与NtMinD蛋白(与烟草叶绿体形成有关)和CP 与NtCPIP(与烟草胞间连丝运输有关)这4者之间的相互作用[34-37]。在研究协同侵染多种Potyvirus的时候发现,在HC-Pro蛋白对寄主干扰并限制病毒侵染的防卫反应时致病力效果得到加强[38-39]。多个平行系列的研究表明,HC-Pro对转录后基因沉默(post-transcriptional gene silencing,PTGS)有抑制作用,提高病毒复制数量,报告基因的功能在报告基因(uidA、gfp)出现PTGS 的转基因株系与表达P1/HC-Pro 转基因株系进行杂交后,其子代得以恢复[40-41],沉默的报告基因可以通过HC-Pro 的PVX(Potato virus X)表达载体得到恢复,并且其恢复之后在转基因体内的表达水平高于野生型PVX的表达。已经有证据[39-41]表明,HC-Pro 中心区有协同基因沉默的抑制和共侵染的作用,并且P1蛋白的存在加强了HC-Pro 的此特性。因此,寄主防卫机制是PTGS的潜在机制,该机制通过限制感染细胞内病毒的聚积,可以使病毒移动延缓[38、42-43]。
目前对病毒蛋白功能和其性状表现还并不是很了解,导致依然缺乏对寄主蛋白与病毒蛋白相互作用的认识,仅通过实验证明PVY可引起寄主PR1等一些病程相关蛋白的表达差异[44-46]。
3 烟草PVY 抗源与抗性遗传规律及研究现状
60年代初,在田间试验中发现烟草品种间对马铃薯Y病毒病存在抗性差异,并发现了可利用的抗性资源。在番茄、辣椒、马铃薯等茄科植物抗PVY的研究过程中虽然有很多文献报道过eIF4E基因都起到了一定的作用,但在烟草中该基因的抗病机制并不明确。目前,烟草对PVY的抗原主要分为2大类:1) 自然界中的野生种,如Sievert从62个品种中鉴定出N.miersii、N.benavidesii、N.knighttiana等8个完全免疫PVY的品种;2) 突变种,如美国G.Koellent在1961、1962以及1964年的研究中发现的PVY 抗源,主要集中在栽培品种Virgin A的变种 Virgin A Mutan(tTI1406)上,可以认为其对PVY的抗性由隐性单基因位点(va)控制,它对于 PVY 的一般株系表现抗性。
目前,已知的烟草抗马铃薯Y病毒病品种多以VAM为亲本育得,如NC745、TN86和TN90 等种质[25、47],抗PVY育种工作中主要是以va基因座作为抗源。Noguchi等[48]认为,va基因对PVY表现出的抗病性由感PVY的Va位点的缺失造成。Acosta-Leal和 Xiong[49]提出,VAM对PVYN的抗性是通过维管束的va1限制病毒在细胞间的运动并阻断病毒进入维管束以及va2在病毒细胞内的积累受到抑制实现的。Fraser认为,当宿主本身具有的抗性基因或在病毒繁殖过程中索要依赖的宿主的某个成分发生突变或缺失时,病毒就无法正常繁殖。感病植株中PVY病毒通过控制蛋白合成的eIF4E 基因的繁殖从而引发植株感染病毒病;但当eIF4E基因发生某一个片段的缺失或者该基因发生点突变时,就会使eIF4E基因的表达发生异常或无法表达,这样病毒就无法通过eIF4E蛋白侵染植株,使植株无法患病,这样植株对马铃薯Y病毒产生了抗性。目前,云南省烟草农业科学院已经对va基因位点的一抗PVY的隐性基因,即eIF4E-1,也就是感PVY基因。这个基因是真核生物翻译起始因子(Eucaryotic initiation factor,简写为eIF)的其中一种类型[50]。
皮金鹏等[51]构建了烟草eIF4E基因沉默表达载体(图3),具有保守区的靶标片段的沉默载体可以使整个eIF4E基因家族都沉默,从而全面的了解eIF4E基因家族在烟草中的抗病作用机理,以及该基因在烟草生长发育等表型上所起到的作用,为该基因应用到抗烟草马铃薯Y病毒病的抗病育种工程奠定基础。
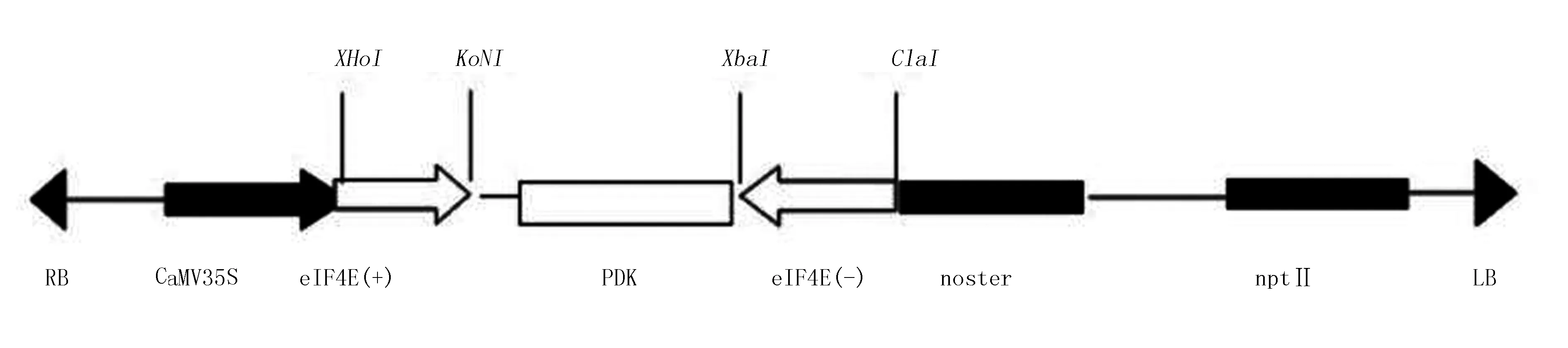
图3 pART27-pK-Ci-SA和pART27-pK-3i-SA的T-DNA区结构简图(皮金鹏等,2012)
4 烟草抗PVY的分子标记技术
分子辅助选择技术是利用目标基因紧密连锁的分子标记对单株是否带有目标基因进行的选择,从而大大加快育种进程。Bindler[52]利用2个烟草品种 Hicks Broadleaf和Red Russian进行杂交,利用该杂交产生的F2代186个单株构建了一张烤烟SSR标记遗传连锁图,与目前标记的其他烟草图谱相比,该遗传图谱共包含24个连锁群,2 317个SSR标记,覆盖长度达到3 267 cM,平均图距小于1.5 cM,其标记长度最长,密度最大,这为未来在烟草基因组中定位,以及对PVY抗性基因的深入研究提供了基础。Julio[53]发现,TN86中与va等位基因Va连锁的标记PVYME1二者间的遗传距离为5.1 cM。王贵[54]用RY5筛选出与抗PVY基因相对应的显性等位基因(Va)紧密连锁的2个分子标记。RAPD标记O12V3695和Va之间的遗传距离为2.10 cM,而SCAR标记和Va之间的遗传距离为2.52 cM。陈万胜[50]利用BSA方法,从大量引物组合中筛选出2个在抗病池和感病池之间表现多态性的引物组合,并将其命名为F3R13610和F26R23450。它们与PVY抗性基因的遗传距离分别为6.51和14.13 cM。
刘磊等[55]确定了cDNA-AFLP 技术在烟草中最适合的选择性碱基数目,调整为3个较为合适,为研究烟草抗PVY病毒病的分子技术提供了技术依据。刘勇等[56]对eIF4E-1 基因进行了特异分子标记检测,证明NC55等的PVY抗性确实与eIF4E-1基因缺失有关。2017年刘勇等[57]进行了进一步研究,E9119-1Z-R14-2株系为抗性稳定的突变体,并命名为pvyr1。将其与感PVY品种与抗PVY品种NC55杂交 F1 代抗性鉴定结果初步表明,pvyr1 是一个抗PVY新资源。王凤龙等[58]利用辣椒中的一种抗病基因eif4E-pvr2,利用叶盘法转化到烟草基因组中,但该基因应用的可行性还需进一步研究。
对烟草PVY的抗(感)病基因或与之紧密连锁的基因进行分子标记对烟草品种的抗病性鉴定具有重要意义, 这项技术不受植株生长发育时期的影响,而且操作简单方便、检测速度快、结果可靠,在烟草抗PVY品种选育上应用这一项技术,可以使选育时间得到明显的缩短,是选择效率大大提高。
5 烟草PVY抗病技术的展望
PVY寄主种类繁多,不同作物间通过蚜虫等传毒介体均可感染。近年来,东北地区气候趋于变暖,蔬菜生产四季不断,为毒源提供了完整的四季循环积累,加之我国烟草抗PVY病品种少,烟农防治不到位,使得烟草马铃薯Y病毒病愈演愈烈。因此,鉴定烟草抗病品种,选育优势品种具有非常重要的意义。大多数植物病害包括烟草PVY都将受到环境和人为因素等条件的影响,因此通过人工对抗性鉴定的结果一般情况下是不稳定的,所以筛选与抗病基因紧密连锁的分子标记是可以从根本上解决人工鉴定不稳定问题的方法之一。而植物抗性遗传分析和分子标记的准确性直接影响到鉴定结果的准确性,影响鉴定结果准确性的主要因素有:1) 抗源本身就具有抗性,可以使质量性状的抗性的结果准确性大大提高;2) 接种时期以及接种方法也会影响鉴定准确性;3) 在鉴定的过程中应有效排除其他病害的干扰以及污染;4) 环境因素同样影响确定性如温度湿度等。因此,在实验中注意这些细节会大大提高鉴定结果的准确性。王贵等[53]所做的实验采用正反交的F1和F2群体同时鉴定,相互验证,可以有效提高鉴定结果的准确性。植物病害给人类带来严重的危害,因而人类与植物病害的斗争贯穿于农业的发展与进步之中。近年来,分子生物学理论和技术的不断发展完善,使人们不但能够从分子水平上进一步研究植物与病原菌的相互作用机制,而且还可以通过基因工程这一现代生物技术直接、快速、高效地培育抗病作物品种[59]。
到目前为止,研究烟草抗PVY的遗传机理,探索抗PVY 种质资源,增加抗PVY品种选育及现有资源的改良依然是接下来工作的重点,并将分子标记辅助选择(MAS)技术与常规育种手段相结合,可以为新品种的选育提供极大的技术支持。借助(MAS)进行烟草品种的抗性鉴定,无需大田实验的复杂操作,在实验室即可简单、快捷、准确的进行检测,在烟草抗PVY品种选育上应用这一项技术,可以使选育时间得到明显的缩短,将使选择效率大大提高。
