生物反应器中金线莲丛生芽的增殖及酚和黄酮积累的研究
2018-08-20金美玉李金蓉廉美兰朴炫春
田 文, 金美玉, 于 垚, 李金蓉, 廉美兰, 朴炫春
(延边大学农学院, 吉林 延吉 133002)
金线莲是一种十分珍稀的中草药,可全草入药,其味甘,性微寒,具有清热解毒的功效[1]。金线莲目前在临床上的应用比较广泛,如治疗肺炎、肝炎、糖尿病、高血压和风湿病等[2]。其植株含有黄酮、酚、多糖、生物碱等多种成分[3],其中,黄酮类化合物具有抗菌、消炎、护肝、利尿、抗氧化、抗癌、防癌、抑制脂肪酶、预防心血管疾病等效果[4-8]。酚类物质是体内具有较强生理学效应的内源性活性物质[7],具有抗氧化、抗诱变、抗衰老和抗病毒等作用[8-10],具有广阔的开发利用前景。但是,野生金线莲对自然环境的要求十分严格,且因毁灭性的开采,资源遭到严重破坏;而传统的人工栽培植物生长缓慢,有效物质含量较低,很难满足市场需求。因此,亟待探寻一种有效生产金线莲植物材料的方法。
植物组织培养手段是取代传统的植物材料繁殖的主要途径[11],这种方式结合生物反应器可实现通过大量培养植物材料,高效、稳定地生产有效物质的目的[12]。目前,金线莲组培有许多研究报道,主要通过研究激素、外植体、光照和培养方式对金线莲试管苗的影响,获得优质金线莲种苗[13-14]。但通过生物反应器培养生产金线莲有效物质的研究较少。生物反应器植物器官培养过程中,培养方式对培养物生物量的影响很大[15]。在前期研究中发现,金线莲丛生芽在无 “载桥”反应器内进行悬浮培养时,随着生物量的增加,丛生芽沉积于生物反应器底部的气体分布器上,这些丛生芽在培养中后期变褐,甚至死亡。另外,培养时期的选择是有效进行生物反应器培养的重要条件。通过对培养物生长和物质合成动态研究,可确定适宜的培养周期[16]。此外,在植物细胞培养中,许多研究都采用生物和非生物刺激的方法进行培养,这种方法是促进有效物质积累的重要措施[17],因此,本文在起升式生物反应器中不同位置架设“载桥”后进行丛生芽培养,确定最佳的反应器培养方式;同时通过动态研究筛选适宜金线莲丛生芽培养的适宜时期。为提高金线莲丛生芽中总酚与总黄酮的含量,采用水杨酸(SA)、茉莉酸甲酯(MeJA)以及酵母提取物(YE)等作为诱导子,研究了诱导子种类、处理时间与处理浓度的影响,筛选最佳的诱导子及其使用方法。
1 材料与方法
1.1 材料
将金线莲 (Anoectochilusroxburghii(Wall.) Lindl.) 试管丛生芽接种于增殖培养基中,增殖培养基[13]为3/4MS基本培养基附加 6-苄氨基嘌呤(6-BA)2.0 mg/L + 激动素(KT)0.2 mg/L+ 萘乙酸(NAA)0.2 mg/L+ 蔗糖30 g/L+琼脂7 g/L,培养基的pH值调节为5.8。在温度(25±2) ℃,光照强度为1 600 lx,每天光照16 h条件下进行增殖培养。培养30 d后,将丛生芽切成单体作为该试验的材料。
1.2 方法
1.2.1 生物反应器培养方式对丛生芽增殖及总酚与总黄酮含量的影响
利用3 L气球型气升式生物反应器,设置3种培养方式(UN、NB和NM)进行丛生芽培养(图1)。
1) UN:生物反应器内无“载桥”;2) NB:在生物反应器球体底部架“载桥”;3) NM:在离生物反应器球体底部5 cm处架“载桥”。每个生物反应器中加入2 L丛生芽增殖培养基(3/4 MS+6-BA 2.0 mg/L+KT 0.2 mg/L+NAA 0.5 mg/L+蔗糖35 g/L),培养基pH值调节为5.8。每个反应器接种20 g(鲜重)的丛生芽外植体,通入气体400 mL/min。在温度(25 ±2) ℃,光照强度为1 600 lx,每天光照16 h条件下进行培养(下同)。培养30 d后调查丛生芽生物量(鲜重和干重),并计算增殖系数,同时测定丛生芽中总酚和总黄酮含量,并计算其生产量。增殖系数和酚及黄酮的生产量按以下公式进行计算。
增殖系数=(收获后丛生芽鲜重-接种丛生芽鲜重)/接种丛生芽鲜重
酚(黄酮)生产量/(mg/L)= 酚(黄酮)含量/(mg/g)×收获后丛生芽干重/(g/L)
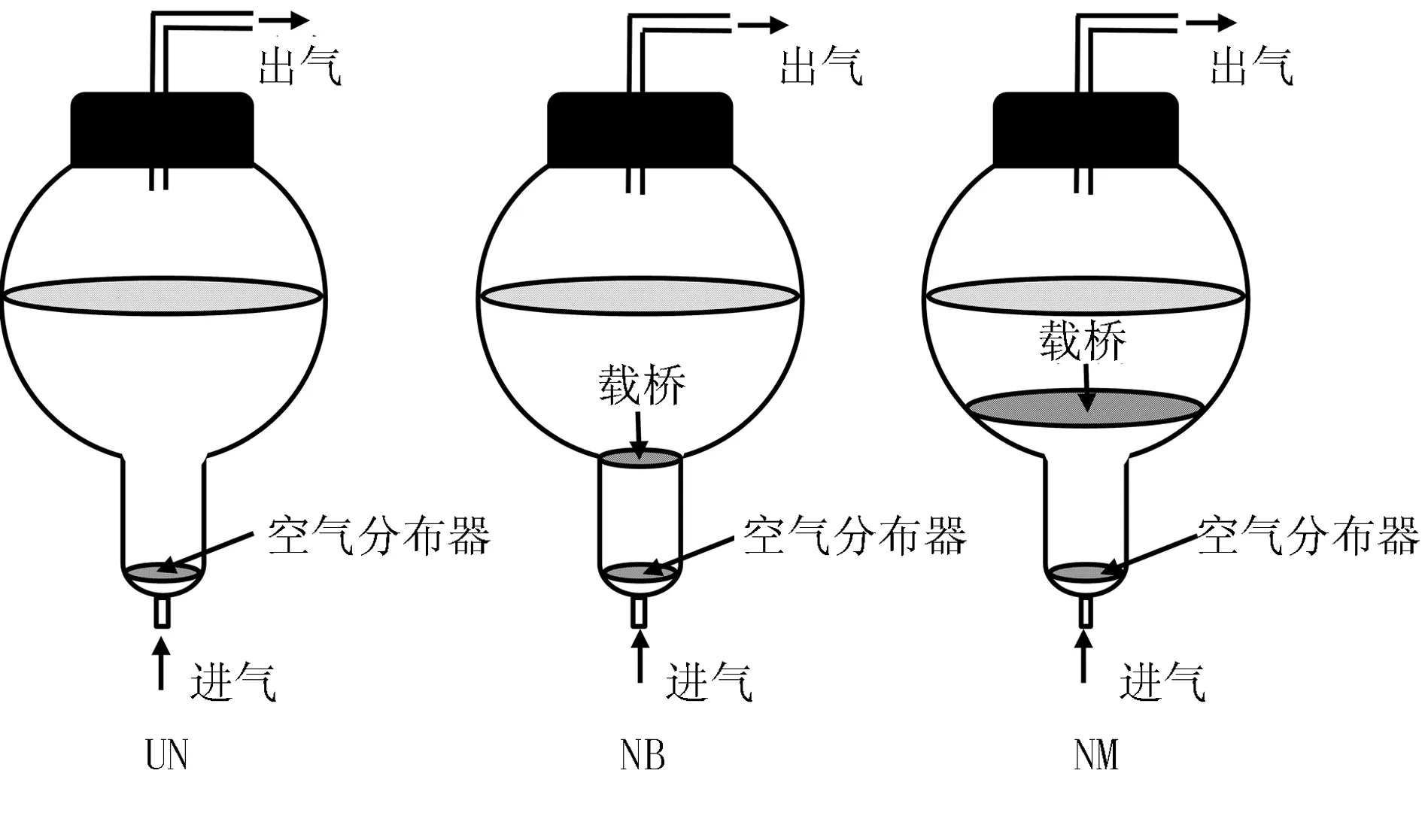
图1 生物反应器培养方式
1.2.2 生物反应器丛生芽培养动态
采用NB培养方式进行研究。将20 g(鲜重)丛生芽外植体接种于含2 L增殖培养基的反应器中。从接种第1天开始,每隔5 d收获丛生芽样品,直至40 d。通过测定不同培养时期丛生芽总酚和总黄酮的含量及分析其生产量,探明其动态变化,确定最佳的培养周期。
1.2.3 诱导子对丛生芽中总酚与总黄酮含量的影响
取3 g(鲜重)丛生芽外植体接种于含100 mL丛生芽增殖培养基(液体)的250 mL锥形瓶中,进行振荡培养(振幅为120 rpm),培养30 d后分别用SA、MeJA和YE进行处理。为了筛选最适处理时间,用500 μM的SA和MeJA分别处理0、4、8、10、12、14、16、20 d,用100 μM的YE处理0、2、4、5、6、8、10 d。之后进行诱导子浓度的筛选,SA和MeJA处理浓度设置为0、400、450、475、500、525、550、600 μM,处理时间SA为12 d,MeJA为16 d;YE浓度设置为0、25、50、75、100、125、150 μM,处理时间为4 d。
最后比较3种诱导子对生物反应器内丛生芽中酚及黄酮积累的影响。利用3 L反应器,采用NB法培养丛生芽,30 d后,分别加入500 μM的SA处理12 d,525 μM的MeJA处理16 d和75 mg/L的YE处理4 d,以未加诱导子为对照(CT)。丛生芽收获后,测定总酚和总黄酮含量。
1.3 测定方法
1.3.1 生物量的测定
收获的丛生芽用自来水清洗2~3次,除去表面水分并沥干后称鲜重。之后,丛生芽放入干燥箱中,45 ℃下干燥48 h,称干重。
1.3.2 总酚含量的测定
总酚含量的测定参照Folin等[18]方法。称取丛生芽的干燥粉末100 mg,加入80%甲醇15 mL,80 ℃煮2 h,冷却后4 ℃离心15 min(500 r/min)。取上清液定容至25 mL,利用紫外分光光度计,以没食子酸作为标准品,在760 nm波长下测定吸光值。
1.3.3 总黄酮含量的测定
总黄酮含量的测定参照吴荣志等[19]方法,称取丛生芽的干燥粉末100 mg,加入70%乙醇15 mL,60 ℃煮2 h,冷却后4 ℃离心15 min(500 r/min)。取上清液定容至25 mL,利用紫外分光光度计,以芦丁作为标准品,在510 nm波长下测定吸光值。
1.4 数据分析
试验数据为3次重复的平均值±标准误差,用Excel 2010和SPSS 22软件进行分析,采用邓肯氏新复极差法(P<0.05)进行比较。
2 结果与分析
2.1 生物反应器培养方式对金线莲丛生芽增殖及总酚与总黄酮含量的研究
培养方式对金线莲丛生芽增殖和总酚与总黄酮含量有显著影响。在有“载桥”反应器(NB和NM)中进行丛生芽培养,30 d后发现丛生芽增殖生长明显好于无“载桥”反应器(UN)培养(图2)。在NB培养方式中,丛生芽鲜重和干重分别达到142.19和18.71 g,显著高于NM和UN,且增殖系数也最高,为13.22(表1)。
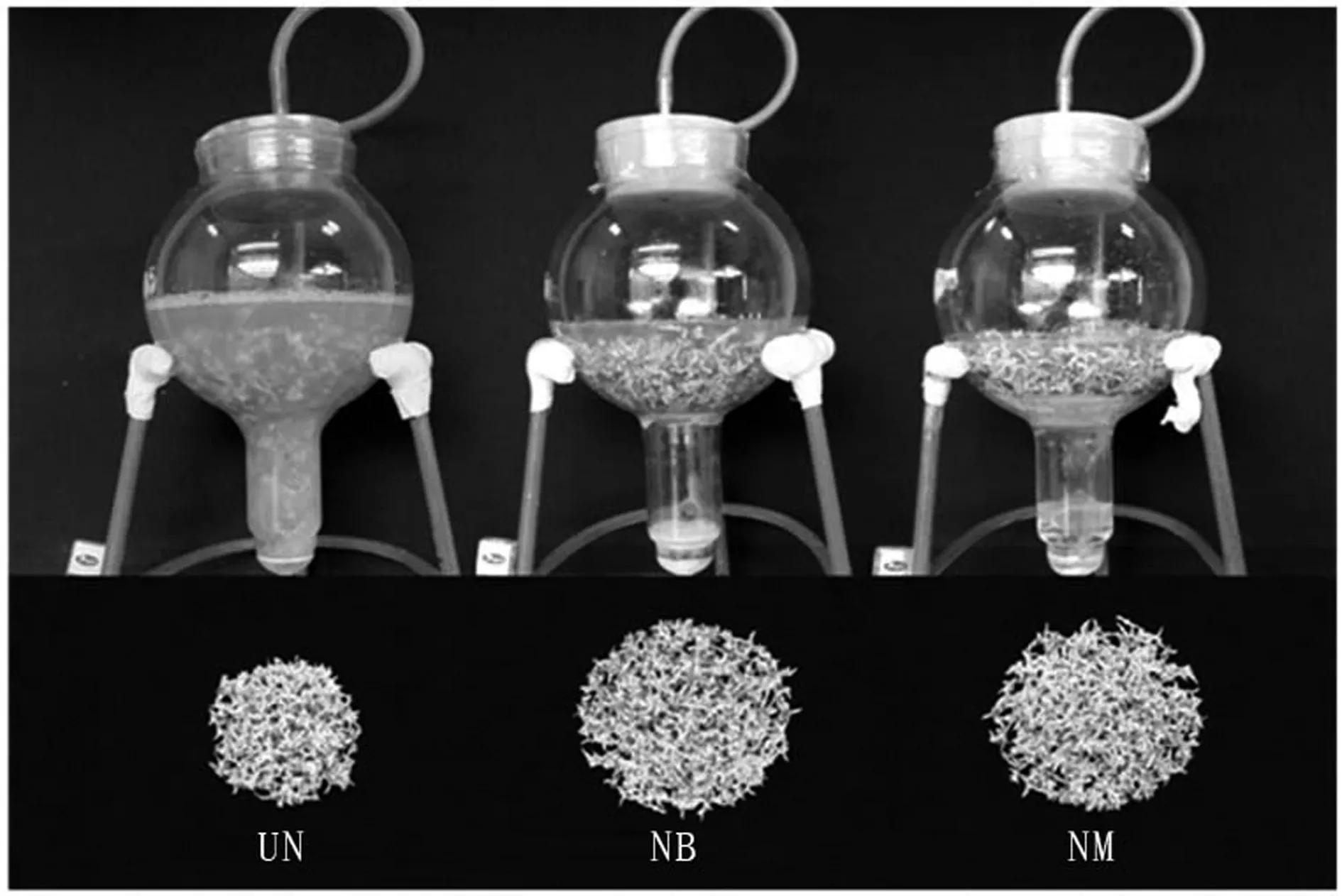
UN:无“载桥”培养;NB和NM:有“载桥”培养
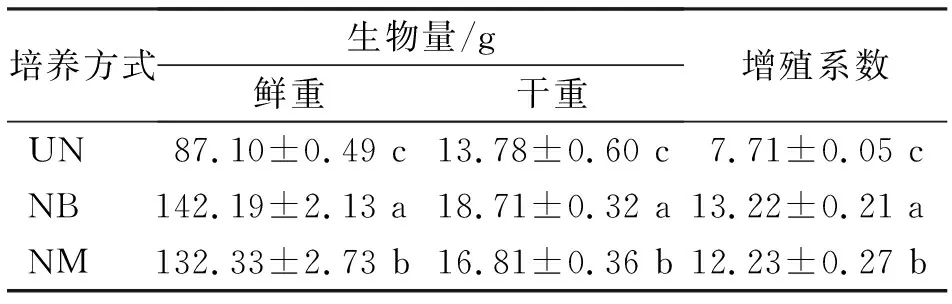
培养方式生物量/g鲜重干重增殖系数UN87.10±0.49 c13.78±0.60 c7.71±0.05 cNB142.19±2.13 a18.71±0.32 a13.22±0.21 aNM132.33±2.73 b16.81±0.36 b12.23±0.27 b
注:UN:无“载桥”培养;NB和NM:有“载桥”培养。数值为平均值±标准偏差(n=3)。不同字母表示0.05水平上差异显著,下同。
培养方式对丛生芽中酚与黄酮积累影响也很大(图3)。NB与NM培养中,总酚与总黄酮含量无显著性差异,2种培养方式中总黄酮含量显著高于UN;但总酚含量在NB,NM低于UN。对总酚和黄酮生产量进行分析结果,NB中总酚生产量(46.12 mg/L)与总黄酮生产量(41.44 mg/L)最高,其次为NM(总酚42.12 mg/L,总黄酮37.23 mg/L),UN最低(总酚37.90 mg/L,总黄酮27.42 mg/L)。因此,NB培养方式也有利于酚和黄酮积累,是生物反应器内进行金线莲丛生芽培养的一种适宜培养方式。
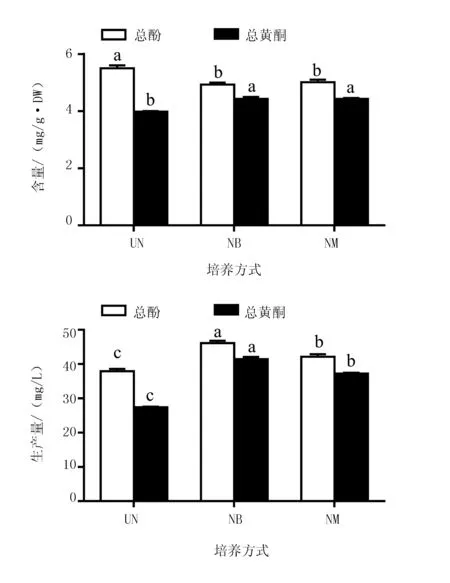
图3 生物反应器培养方式对金线莲丛生芽总酚与总黄酮积累的影响
2.2 生物反应器丛生芽培养动态研究
由图4可知,在金线莲丛生芽生物反应器培养过程中,丛生芽中酚与黄酮积累发生动态变化。在培养30 d内,丛生芽中总酚和总黄酮含量随着培养天数的增加而提高,培养第30天时最大,此时总酚
含量达到6.7 mg/g,总黄酮含量达到4.4 mg/g。但培养天数超过30天后,总酚和总黄酮含量呈下降趋势。对总酚和黄酮生产量(丛生芽干重物质含量)进行分析的结果与物质含量的变化趋势一致,在培养第30天时,2种物质的生产量均达到最大,总酚和总黄酮生产量分别为58.8 mg/L和39.2 mg/L。因此,可以确定金线莲丛生芽生物反应器培养时,30 d为适宜的培养周期。
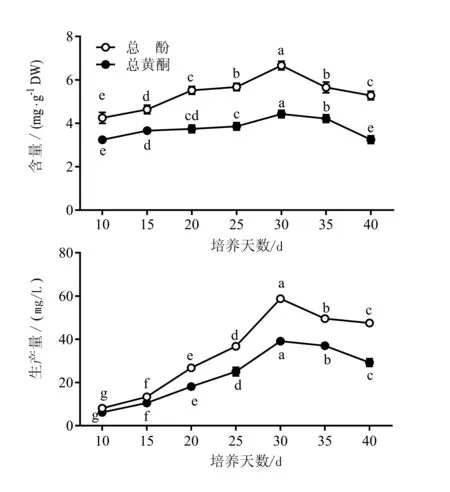
图4 金线莲丛生芽生物反应器培养过程中酚与黄酮积累的变化
2.3 诱导子对丛生芽中总酚与总黄酮含量的影响
诱导子处理时间对金线莲丛生芽中总酚与总黄酮含量有显著的影响(图5)。对于SA,10 d时总酚和总黄酮含量最高,分别为8.5 mg/g和4.4 mg/g;对于MeJA,处理16 d时总酚和总黄酮的含量最高,分别为8.57 mg/g和4.24 mg/g;而对于YE,处理4 d时总酚与总黄酮含量最高,分别为7.43 mg/g和5.13 mg/g。
诱导子浓度的影响如图6所示,SA浓度为500 μM,MeJA浓度为525 μM,而YE浓度为75 mg/L时,丛生芽中总酚和总黄酮含量最高。
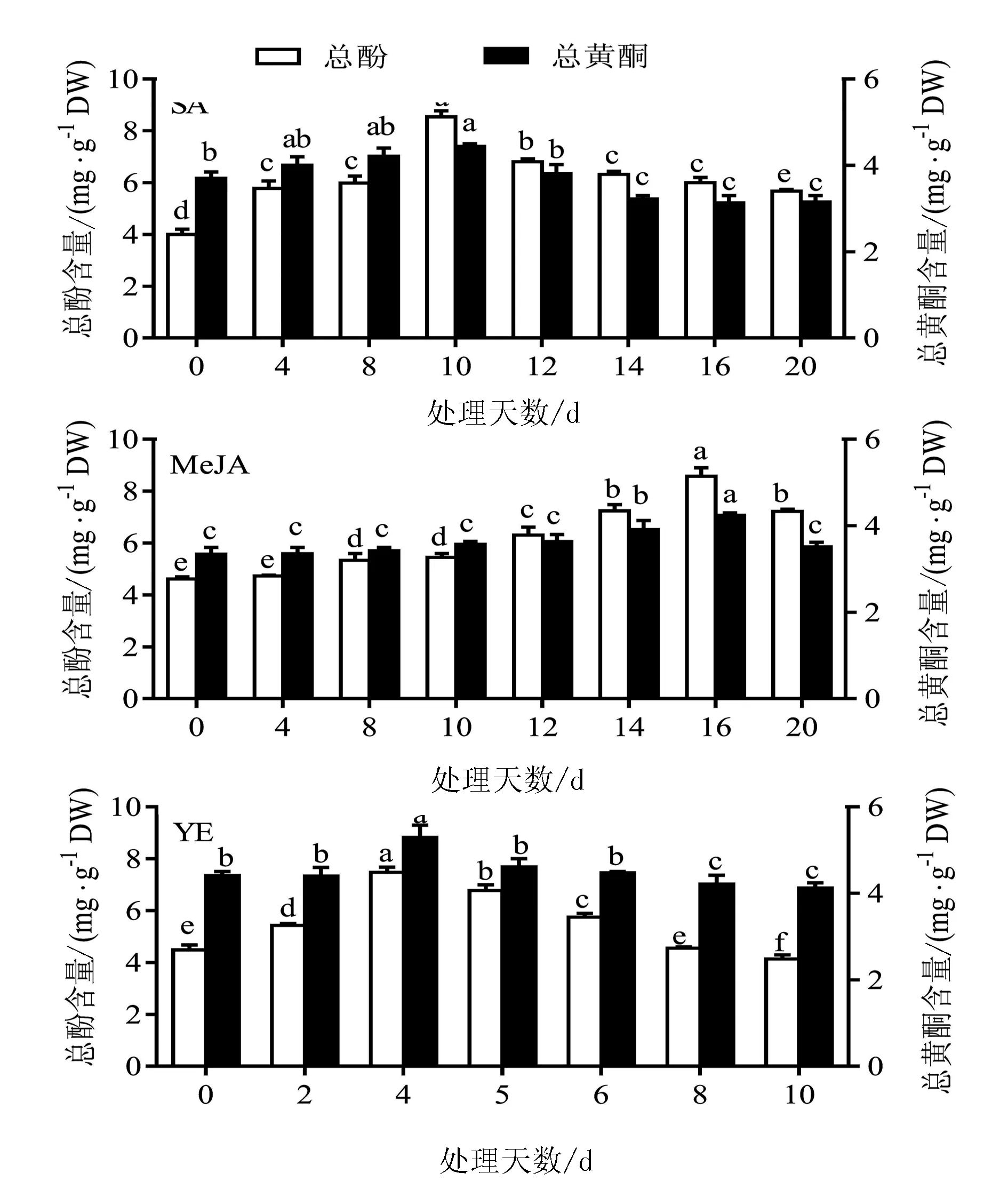
图5 诱导子处理天数对金线莲丛生芽中总酚与总黄酮含量的影响
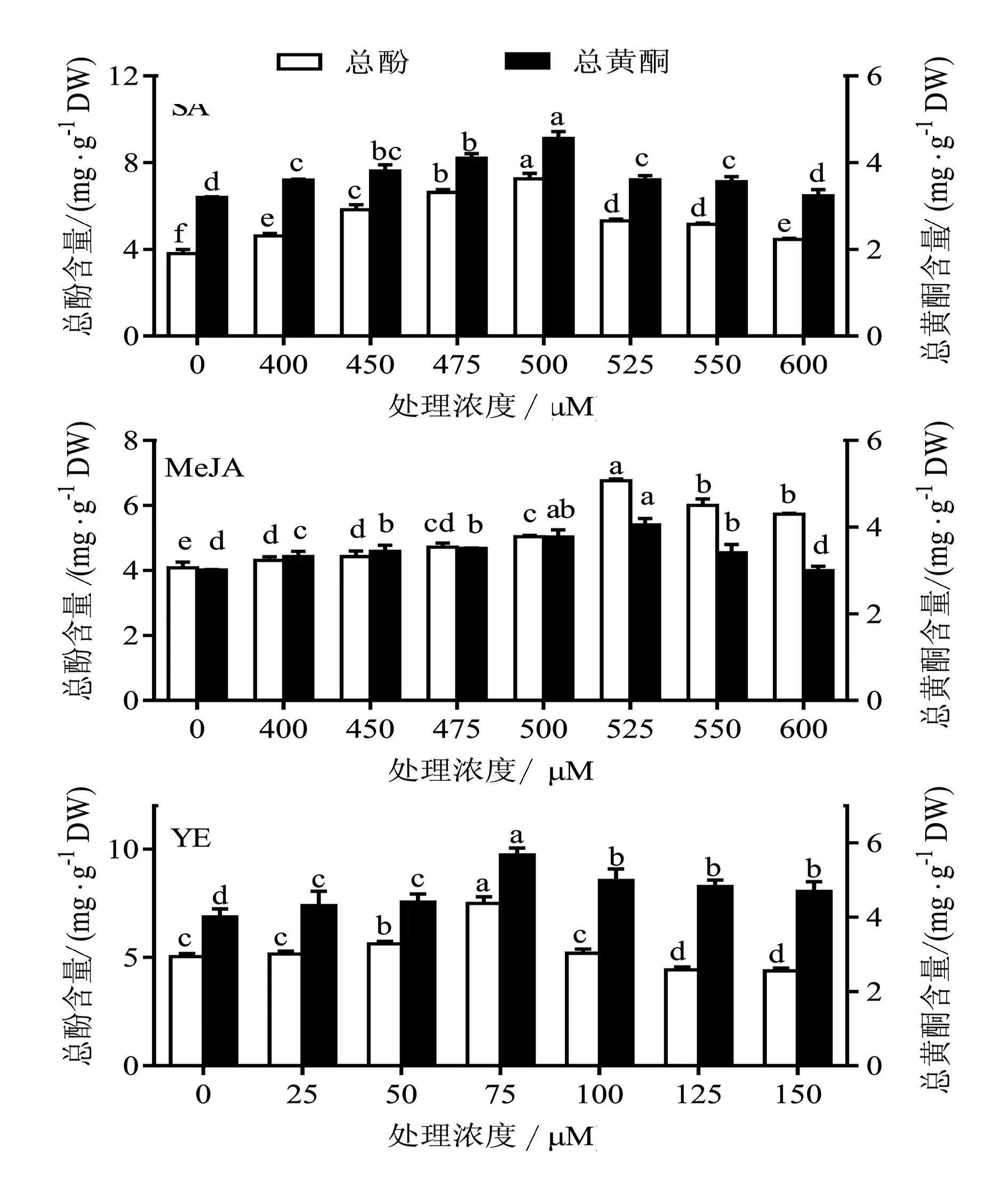
图6 诱导子处理浓度对金线莲丛生芽中总酚与总黄酮含量的影响
3种诱导子最佳处理时期和处理浓度确定后,在生物反应器丛生芽培养至30 d时,分别用3种诱导子进行处理,通过总酚和总黄酮含量的测定,比较了3种诱导子的处理效果。由图7可见,3种诱导子对丛生芽中总酚和总黄酮含量均具有促进效果,SA、MeJA和YE处理均显著高于未处理的丛生芽(CT),但诱导子处理间总酚含量无显著性差异。对于黄酮,MeJA处理中黄酮含量(6.13 mg/g)显著高于其他处理,依次是SA(4.95 mg/g)和YE(4.71 mg/g)处理。3种诱导子处理的黄酮含量均显著地高于CT。因此,在金线莲丛生芽生物反应器培养过程中,为了提高酚和黄酮的积累,可在丛生芽培养30 d时加入525 μM的MeJA处理16 d。
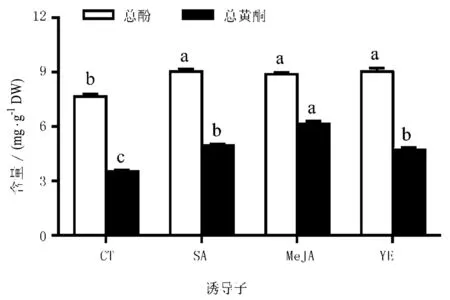
图7 诱导子对总酚与总黄酮含量影响的比较
3 讨论与结论
利用气升式反应器进行金线莲丛生芽的培养过程中,由于丛生芽生物量的增加,通气动力难以使丛生芽上浮,导致丛生芽下沉至反应器底部,在空气分布器上堆积,这一方面抑制气体通入,使培养物无法随培养液进行流动,另一方面又使沉积于底物的丛生芽受到气体胁迫而影响其进一步的生长[20]。反应器内架设支持网(载桥),有利于植物器官生物反应器培养,韩璐等[21]在进行白鹤芋组培苗培养时,通过架设“载桥”得到的优质、高产的组培苗,这与本文在反应器中架设“载桥”培养的结果一致。但是,同样是反应器“载桥”培养,NB的生物量与有效物质积累好于NM,这可能是因不同位置的“载桥”对通入气体有不同程度的阻遏,导致NB和NM中实际含气量不同,从而使丛生芽生物量和物质积累出现差异。在利用生物反应器进行植物组织培养的过程中,通过对不同培养时期培养物中有效物质的测定,可以确定最佳的培养周期。张万博等[22]为了探明生物反应器培养狼爪瓦松愈伤组织中黄酮类物质积累的最佳时期,对培养5~30 d内愈伤组织中黄酮积累的动态变化进行了分析,最终确定25 d为狼爪瓦松愈伤组织培养的最佳时间。然而,该研究在进行金线莲生物反应器研究时,培养30 d时可获得最多的酚和黄酮,因此,30 d为最佳的培养周期。这种结果表明,在生物反应器内培养不同植物、不同外植体时的最佳培养周期不同,应针对不同植物选择适宜的培养周期。
SA参与植物体内信号转导,通过调控次生代谢途径关键酶的活性来影响次生代谢产物的合成,或通过增加苯丙烷类代谢途径关键酶的活性,促进相关代谢产物的积累[23]。研究表明,一定浓度SA能有效地提升茜草细胞中有效物质的含量[24],这与本文研究结果一致。MeJA可诱导植物体内多种抗逆基因的表达,促进各种酶的合成,提高培养物总酚与总黄酮的生产,从而为获得目标次生代谢物提供了有效手段[25]。外源施加MeJA对葡萄悬浮培养细胞中总酚含量有明显促进作用[26],这中结果本研究中MeJA对金线莲丛生芽总酚和总黄酮含量的作用效果相似。YE可活化次生代谢物生物合成相关酶,提高次生代谢物的积累量。郭双等[27]研究结果表明,YE可以提高颠茄毛状根有效物质的积累量。本试验中YE也可提高金线莲丛生芽总酚与总黄酮的含量,这为YE可作为金线莲组织培养生产总酚与总黄酮的诱导子提供了理论依据。通过比较SA、MeJA和YE,MeJA对酚和黄酮积累效果最佳,因此,建议在生物反应器培养金线莲丛生芽时,可用MeJA作为诱导子来使用。
