高脂饲料中添加绿原酸对草鱼生长性能和脂质代谢的影响
2018-08-15杨天俊陈彦良刘文舒郭小泽唐艳强刘玉廷黎徳兵李思明
杨天俊 陈彦良 刘文舒 郭小泽 唐艳强 刘玉廷 黎徳兵 李思明*
(1.江西省农业科学院,南昌 330200;2.四川农业大学动物科技学院,成都 611130)
鱼类因消化道较短,消化酶活力低,对饲料蛋白质利用率低[1],易导致水体氨氮含量过高,制约鱼类生长和引发鱼类疾病。为降低水体环境中的氮磷含量,预防鱼类爆发疾病,实际养殖过程中在保证饲料营养均衡的条件下,普遍采取减少饲料蛋白质水平和适量提高脂肪水平的策略[2],这种养殖策略可达到促进鱼体生长、保护养殖水域的目的[3]。正常情况下,草鱼饲料脂肪需求水平为3%~6%[4],当饲料脂肪水平过高时易致使鱼体脂肪蓄积过量,肝胰脏等组织受到损伤,反而导致鱼体生长缓慢,饲料系数上升[5-8],养殖效益下降。
草鱼摄食量大,对高脂饲料利用能力低,摄食高脂饲料极易使鱼体脂肪沉积过多,机体脂质代谢发生紊乱[9]。有报道指出,忍冬属或杜仲属中草药植物中提取的绿原酸(chlorogenic acid,CGA)具有抗菌、消炎、抗氧化的特性[10-12]。亦有大量研究报道CGA具有促生长,降脂糖等效用[13-15]。CGA作为饲料添加剂对凡纳滨对虾生长性能[16]及对草鱼肌肉品质的影响[17]已有文献报道,但CGA对鱼类脂质代谢的研究尚未见报道。为此,本试验拟在高脂饲料(粗脂肪含量约为9.00%)中添加不同水平CGA,研究CGA对草鱼生长性能和脂质代谢的影响,旨在探索解决由高脂饲料引起鱼脂肪蓄积过多而致鱼体生长缓慢、脂质代谢紊乱等问题,为CGA应用于草鱼等水生动物养殖和开发新型水产添加剂提供理论依据。
1 材料与方法
1.1 试验饲料
由于草鱼脂肪需要水平范围为3%~6%,本试验设计饲料中豆油添加水平为8%(饲料粗脂肪含量约为9.00%)。CGA(购自Sigma公司,纯度≥95%)添加水平参考张纯[18]、王芸等[19]对建鲤、凡纳滨对虾的研究报道,分别在基础饲料中添加0(C)、200(200CGA)、400(400CGA)、600 mg/kg CGA(600CGA),以微晶纤维素为填充物调节各饲料总量一致。饲料原料粉碎后经60目筛筛出粉料,过筛粉料逐级混匀,豆油在所有粉料混匀之后添加,待豆油混匀之后,加入适量蒸馏水拌匀,以小型制粒机制作直径为1~2 mm的粒状饲料,制备的饲料颗粒于阴凉干燥处配合风扇风干48 h,然后密封于自封袋中,-20 ℃条件下贮存备用。试验饲料组成及营养水平见表1。
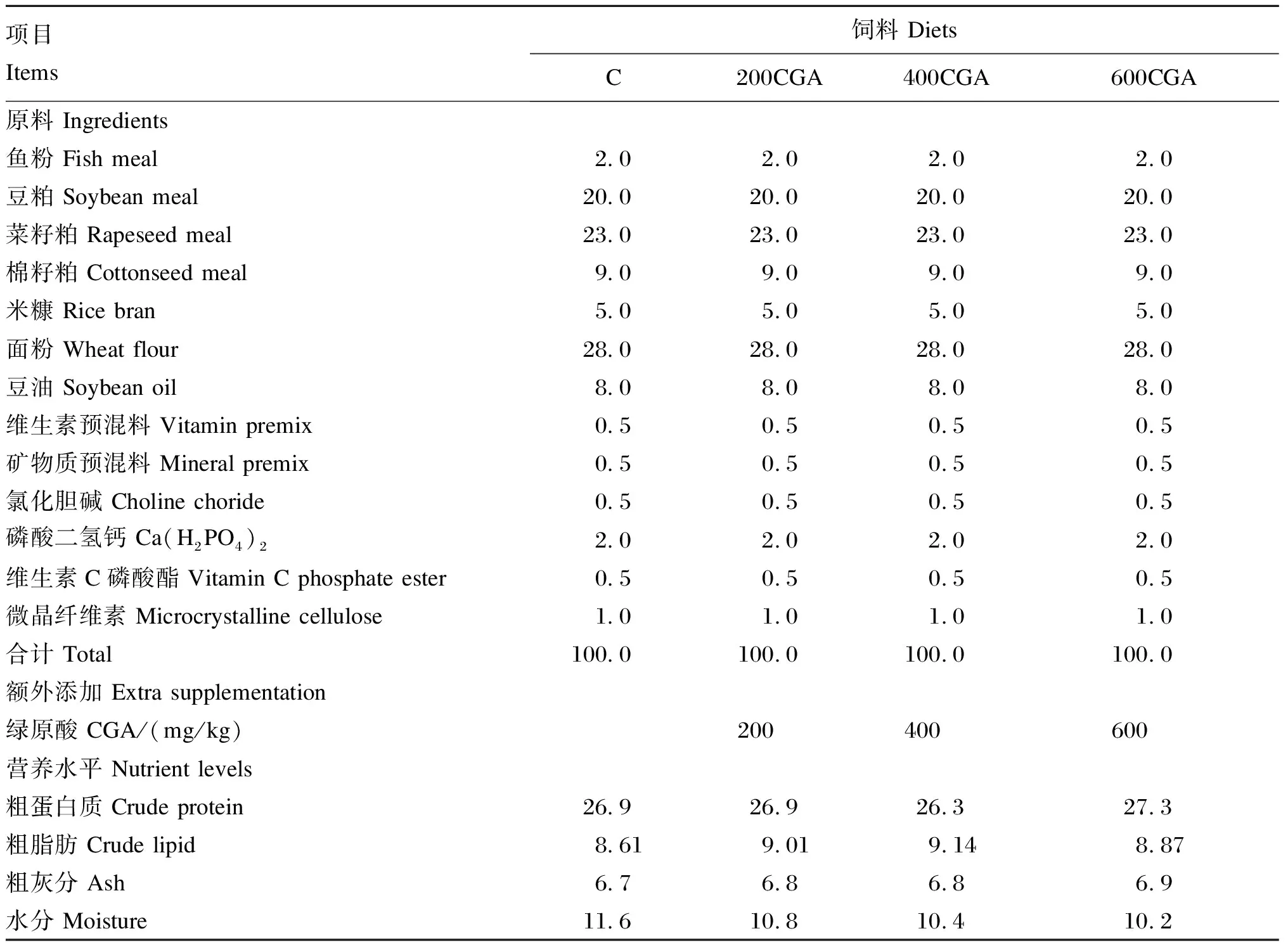
表1 试验饲料组成及营养水平(风干基础)Table 1 Composition and nutrient levels of experimental diets (air-dry basis) %
1)每千克维生素预混料含有 Contained the following per kg of the vitamin premix:VA 350 000 IU,VD3450 000 IU,VE 20 g,VK37.5 g,VB110 g,VB210 g,VB612 g,VB1220 mg,烟酰胺nicotinamide 40 mg,叶酸folic acid 3 g,泛酸钙calcium pantothenate 30 g,生物素biotin 100 mg,VC 60 g,肌醇inositol 60 g。
2)每千克矿物质预混料含有 Contained the following per kg of the mineral premix:NaH2PO4100 g,KH2PO4215 g,Ca(H2PO4)2·2H2O 265 g,CaCO3105 g,乳酸钙 Ca-lactate 165 g,MgSO4·7H2O 100 g,AlCl3·2H2O 12 g,ZnSO4·7H2O 5.11 g,柠檬酸铁 Fe-citrate 0.61 g,MnSO4·4H2O 1.43 g,KI 0.58 g,CuCl20.51 g,CoCl2·6H2O 1.76 g,KCl 28 g。
1.2 试验设计及饲养管理
试验所用草鱼由江西省水产研究所提供,鱼苗运抵江西省农科院畜牧研究所经高锰酸钾消毒及水温适应后放养于室内循环养殖系统,该系统含20个直径100 cm,高80 cm的圆形养殖桶,可进行水温控制,养殖用水氨氮含量小于0.05 mg/L,pH为7.5左右,溶氧含量大于5 mg/L。养殖过程中24 h曝气增氧,预试期10 d,之后选取活力强体质优大小为(7.53±0.30) g草鱼360尾,随机分为4组,分别饲喂1种上述试验饲料,每组3重复,每重复30尾,每个重复的30尾放养于1个养殖桶。每日09:00和16:00按分组进行投喂,日投喂量为草鱼体重的5%~7%,每周换水以及虹吸排污2~3次,每次换水约为养殖桶水体总量的1/3。正试期于2016年8月24日开始,2016年11月8日结束,为期11周。
1.3 样本采集
正试期结束前24 h停止投喂,对整池的草鱼进行称重计数,每组鱼随机选取18尾(每重复6尾)进行体长、体宽的测量,置于解剖盘中完整取其内脏,磷酸盐缓冲液(PBS)洗净,经由滤纸吸干后称重。再每组随机抽取6尾鱼进行全鱼的常规营养成分测定,所抽取的全鱼样本整理编号后贮存于-80 ℃中保存待测。
每组鱼随机取18尾(每重复6尾)试验鱼,麻醉后用量程为1或2 mL的一次性注射器进行尾部静脉采血,于4 ℃条件下自然凝固,过夜,冷冻离心机3 500 r/min离心15 min,采集血清置于-20 ℃中保存待测,草鱼血液采集完毕后置于解剖盘中,打开腹腔,完整取出内脏,分离出肝胰脏并用PBS洗净,滤纸除去表面水分,于-80 ℃环境下贮存待测。
1.4 制备肝胰脏匀浆液
肝胰脏匀浆液的制备:保存于-80 ℃条件下的肝胰脏样本逐级解冻(-20、4 ℃)后[20],取出肝胰脏样本并精确称重,在量程为20 mL的玻璃匀浆器中按照肝胰脏重量精准地加入9倍体积温度为4 ℃的0.68%生理盐水,冰浴条件下缓慢研磨3~5 min,匀浆液在低温冷冻离心机中3 000 r/min离心10 min,用洁净的、消毒过的棉签清除匀浆液表层脂质,小心吸取离心后上清液,分装编号,于-80 ℃条件下储存待测。
1.5 肝胰脏透射电镜切片
取出草鱼肝胰脏,用PBS冲洗3遍,切取1 mm左右的肝胰脏于2.5%戊二醛固定4 h以上,然后用PBS漂洗2次,每次1 h,再经1%锇酸固定1 h,PBS漂洗2次,每次5 min,后乙醇脱水。样本用1,2-环氧丙烷漂洗2次,每次漂洗10 min,环氧丙烷与环氧树脂(1∶1)混匀后,将样本浸没其中,静置1 h后包埋在带标签纸的模型中,放置过夜后放入60 ℃烘箱48 h,然后切片(透射电镜50~60 nm),染色(透射电镜:1%铀染色10 min),最后进行图片采集和分析(每组9个样本)。
1.6 指标测定
1.6.1 生长性能指标测定
记录初始体重(initial body weigh,IBW)、终末体重(final body weight,FBW),饲料摄入量等数据,计算增重率(weight gain rate,WGR)、饲料系数(feed coefficient,FC)、脏体指数(viscerosomatic index,VSI)、肥满度(condition factor,CF)、蛋白质效率(protein efficiency ratio,PER)、成活率(survival rate,SR),计算公式如下:
WGR(%)=[(We-Ws)/Ws]×100;FC=(We-Ws)/Wf;VSI(%)=(Wv/We)×100;CF(g/cm3)=We/L3;PER(%)=[(We-Ws)/Wp]×100;SR(%)=(ne/ns)×100。
式中:We为FBW(g);Ws为IBW(g);t为试验持续时间(d);Wf为饲料干物质摄入量(g);Wv为内脏重(g);L为体长(cm);Wp为饲料中粗蛋白质含量(%);ne、ns分别为草鱼养殖期间终末和初始鱼尾数。
1.6.2 全鱼营养成分测定
草鱼全鱼水分含量测定采用105 ℃恒温烘干失重法(GB 5009.3—2010);粗蛋白质含量测定采用凯氏定氮法(GB 5009.5—2010);粗脂肪含量测定采用索氏抽提法(GB 5009.4—2010);粗灰分含量测定采用马福炉高温灼烧法(GB 5009.4—2010)。
1.6.3 脂质代谢指标测定
脂质代谢指标血清和肝胰脏甘油三酯(TG)、总胆固醇(T-CHO)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)含量及肝胰脏肝脂酶(HL)、脂蛋白脂酶(LPL)、总脂酶(TL)活力测定试剂盒购于南京建成生物工程研究所,按试剂盒说明书测定脂质代谢指标。
1.7 数据统计分析
试验数据采用SPSS 20.0软件进行单因素方差分析,若差异显著,进一步进行Duncan氏法多重比较,差异显著水平设定为P<0.05,结果以平均值±标准差表示。
2 结果与分析
2.1 高脂饲料中添加CGA对草鱼生长性能的影响
由表2可知,各组草鱼终末体长、脏体指数无显著差异(P>0.05);随着CGA添加水平的提高,终末体重、增重率、蛋白质效率均显示出先升高后下降的趋势,400CGA组最高,与C组差异显著(P<0.05),其中终末体重增加15.90%,增重率提高22.96%,蛋白质效率提升17.75%;与C组对比,试验组饲料系数呈现集体下降,400CGA组显著低于C组(P<0.05),降低了14.86%;鱼体肥满度随着CGA添加水平提高而升高,600CGA组显著高于C组(P<0.05);各组草鱼存活率均为100%。

表2 高脂饲料中添加CGA对草鱼生长性能的影响Table 2 Effects of chlorogenic acid supplementation in high-fat diets on growth performance of grass carp
同行数据肩标不同小写字母表示差异显著(P<0.05)。下表同。
Values in the same row with different small letter superscripts mean significant difference (P<0.05). The same as below.
2.2 高脂饲料中添加CGA对草鱼全鱼营养成分的影响
由表3可知,各组全鱼水分含量无显著差异(P>0.05);400CGA组全鱼粗蛋白质含量显著高于其他组且粗脂肪含量显著低于其他组(P<0.05);C组全鱼粗灰分含量显著高于400CGA组(P<0.05)。

表3 高脂饲料中添加CGA对草鱼全鱼营养成分的影响Table 3 Effects of chlorogenic acid supplementation in high-fat diets on conventional nutrient composition of whole body of grass carp
2.3 高脂饲料中添加CGA对草鱼血清及肝胰脏中脂质指标的影响
2.3.1 血清中脂质指标
由表4可知,草鱼血清中各组的TG含量差异不显著(P>0.05);C组血清T-CHO含量显著高于200CGA、400CGA组(P<0.05),与600CGA组差异不显著(P>0.05);C组血清HDL-C含量显著低于各试验组(P<0.05);C组血清LDL-C含量显著高于400CGA、600CGA组(P<0.05),与200CGA组差异不显著(P>0.05)。
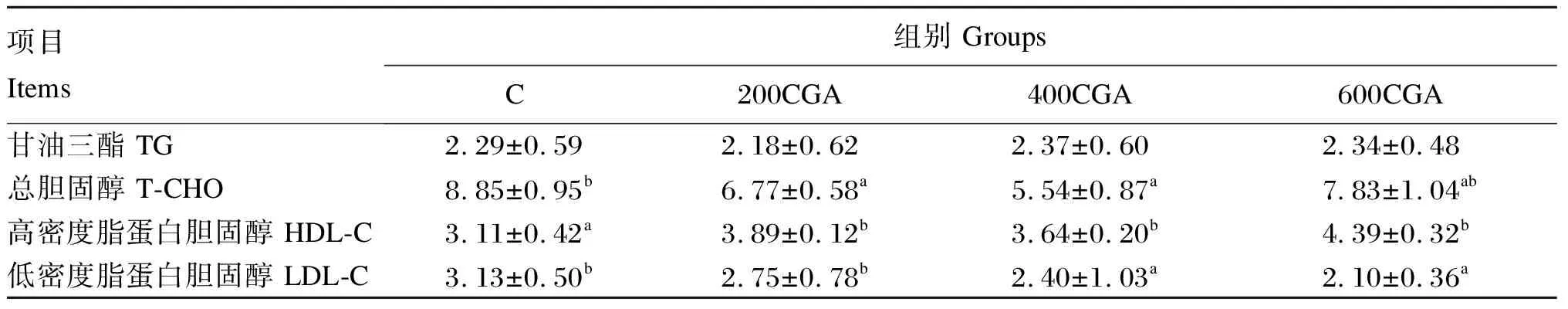
表4 高脂饲料中添加CGA对草鱼血清中脂质指标的影响Table 4 Effects of chlorogenic acid supplementation in high-fat diets on lipid indicators in serum of grass carp mol/L
2.3.2 肝胰脏中脂质指标
由表5可知,C组肝胰脏中TG、T-CHO含量显著高于其余各组(P<0.05),400CGA、600CGA组肝胰脏中HDL-C含量显著高于C组(P<0.05),但C组与200CGA组差异不显著(P>0.05);C组肝胰脏中LDL-C含量显著高于其余各组(P<0.05)。
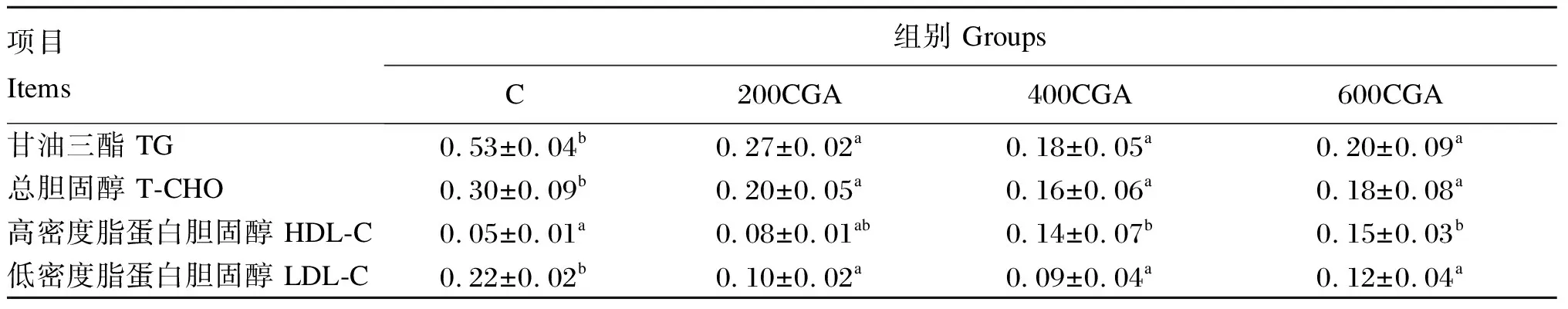
表5 高脂饲料中添加CGA对草鱼肝胰脏中脂质指标的影响Table 5 Effects of chlorogenic acid supplementation in high-fat diets on lipid indicators in hepatopancreas of grass carp mol/mg prot
2.4 高脂饲料中添加CGA对草鱼肝胰脏中脂质代谢酶活力的影响
由表6可知,试验组肝胰脏中HL活力显著高于C组(P<0.05);400CGA组肝胰脏中LPL活力显著高于C组(P<0.05);试验组肝胰脏中TL活力均显著高于C组(P<0.05)。

表6 高脂饲料中添加CGA对草鱼肝胰脏中脂质代谢酶活力的影响Table 6 Effects of chlorogenic acid supplementation in high-fat diets on lipid metabolism enzyme activities in hepatopancreas of grass carp U/mg prot
2.5 高脂饲料中添加CGA对肝胰脏细胞中脂质沉积的影响
组织切片中肝胰脏细胞脂质经锇酸还原后呈黑色,见图1。由图可知,C组脂滴分布密集,数量较多,且体积较大,大量脂质沉积于肝胰脏细胞中;与C组相比,试验组脂滴的体积都明显变小,且脂滴的分布也较稀疏,脂质沉积变少,尤以400CGA、600CGA组明显;进一步比较400CGA和600CGA组可看出,400CGA组中肝胰脏中脂滴数量、大小、分布密度均小于600CGA组。
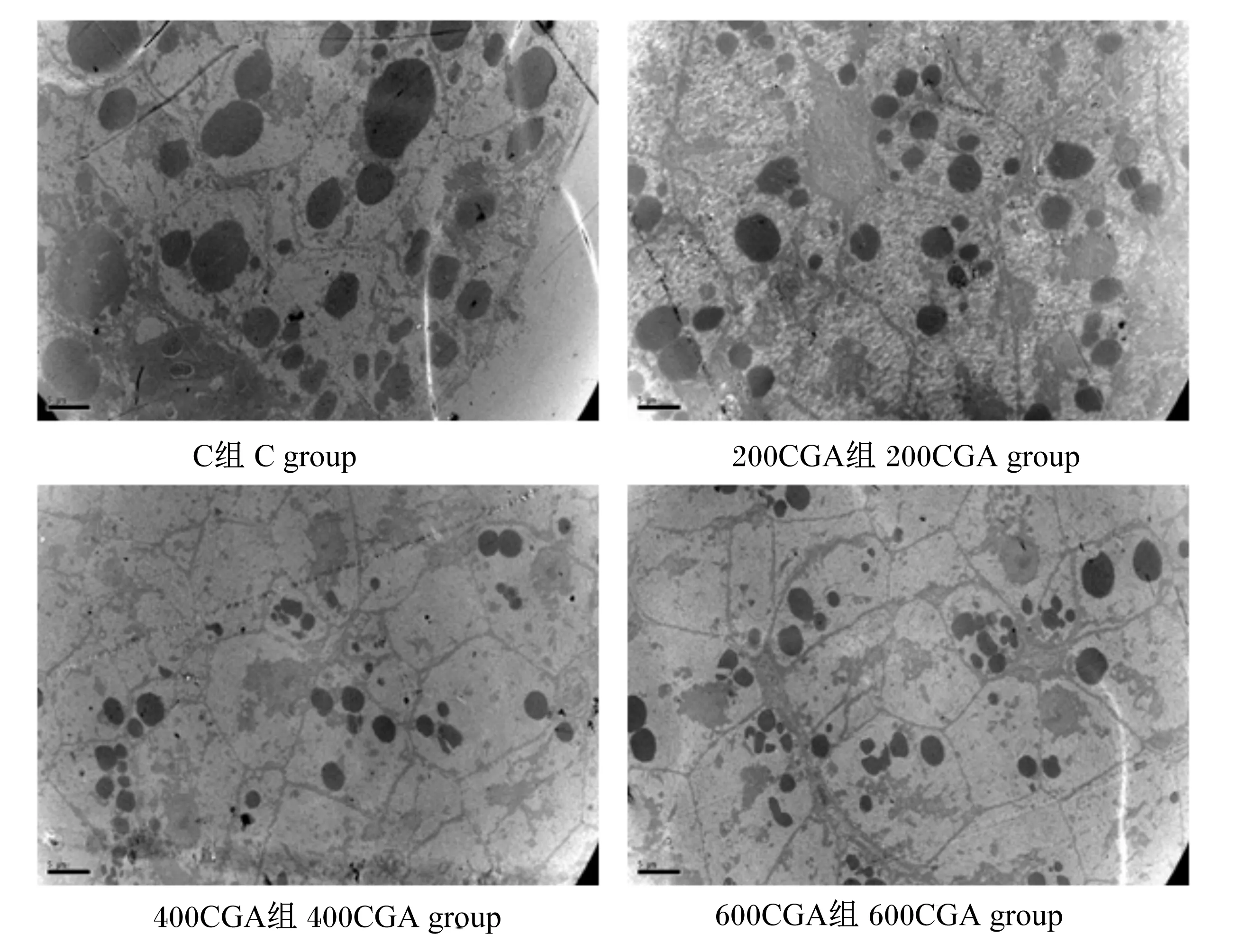
图1 透射电镜下肝胰脏细胞中脂质沉积情况(标尺:5 μm)Fig.1 Lipid deposition in hepatopancreas under transmission electron microscope (scale: 5 μm)
3 讨 论
3.1 高脂饲料中添加CGA对草鱼生长性能的影响
CGA作为脂类物质,在胃和小肠中以原型的方式被吸收,进入血液后发挥其抗氧化和降脂等作用[21-22]。目前,CGA对畜禽的促生长、抗氧化、降脂、降糖等作用已被广泛关注,且CGA作为饲料新型添加剂在水产养殖中应用研究已有零星报道。肖洋[23]报道饲料中添加200 mg/kg CGA能够提高中华鳖生长性能;张纯[18]研究表明,建鲤饲料中添加200 mg/kg CGA显著提高了建鲤鱼体的增重率,且CGA对肠道发育具有促进作用,建鲤生长性能改善可能与此有关。本试验结果显示,与C组对比,添加400 mg/kg CGA显著提高了草鱼终末体重、增重率和蛋白质效率,其中草鱼终末体重增加15.90%,增重率提高22.96%,蛋白质效率提升17.75%,饲料系数显著降低了14.86%;肥满度随着CGA添加水平提高呈现缓慢提升趋势,添加600 mg/kg CGA显著提高了肥满度。由以上试验结果可知,400 mg/kg CGA的添加使草鱼生长性能得到提高,可较好促进草鱼生长。本试验与上述相关研究结果在获得较好生长性能的添加水平上不尽相同,分析原因可能与鱼的种类、饲养周期、饲料中营养成分含量以及CGA来源等有关。
3.2 高脂饲料中添加CGA对草鱼全鱼营养成分的影响
本试验发现,高脂饲料中添加CGA对全鱼粗脂肪、粗蛋白质、粗灰分含量均产生显著的影响,400CGA组全鱼粗蛋白质含量显著高于其他组,说明添加400 mg/kg CGA促进了草鱼对饲料蛋白质的利用,这一结果与朱卫等[24]在点篮子鱼中研究结果有所差异。罗非鱼、比目鱼、鲈鱼研究报道发现,饲料中所含粗脂肪含量过高时,多余的未被代谢脂肪会沉积于鱼体内[6-7,25]。本试验中,400CGA组全鱼粗脂肪含量显著低于其余组,表明添加400 mg/kg CGA可有效地降低鱼体脂质的沉积。CGA的添加均可降低全鱼粗灰分含量,且C组显著高于400CGA组,究其原因可能是C组缺乏CGA辅助草鱼机体脂质代谢,致使鱼体脂质沉积增加,而多余的脂质可促进机体对维生素A、维生素D、维生素E、维生素K的吸收,并在机体内沉积大量的能量源物质[26],并且这些脂溶性维生素参与鱼体多种生理生化反应,从而增加了鱼体的无机盐沉积,导致了粗灰分含量增高,目前这一推测还有待论证。本试验中,与C组相比,添加400 mg/kg CGA对全鱼粗脂肪、粗蛋白质含量均有显著影响,说明高脂饲料中添加400 mg/kg CGA可以有效地提高草鱼的营养价值。
3.3 高脂饲料中添加CGA对草鱼脂质代谢的影响
3.3.1 血清和肝胰脏中脂质代谢
Shimoda等[27]报道了口服CGA可减少大鼠内脏脂肪的蓄积,降低大鼠机体脂质含量;De Sotillo等[28]通过给予小鼠静脉注射CGA,发现大鼠肝脏和血浆中的TG含量显著下降;Frank等[29]研究也证明,在大鼠饲料中加入CGA后,降低了肝脏的T-CHO含量;张兰涛等[30]发现灌服20 mg/mL的CGA可显著降低小鼠肝脏、骨骼肌TG含量;王强等[31]报道了金银花提取物CGA能有效降低血清和肝脏的T-CHO的含量。本试验发现,添加CGA有效地降低了血清中T-CHO、LDL-C含量以及提高了血清中HDL-C含量,由此可知CGA的添加对血清中脂质代谢具有良好的调节作用,且400CGA组以上3个指标均表现出显著变化,故认为添加400 mg/kg CGA可有效调节血清中的脂质代谢。CGA对草鱼肝胰脏的降脂作用亦体现较为明显,本试验条件下,C组草鱼肝胰脏中的TG、LDL-C含量均显著高于试验组,而肝胰脏中HDL-C含量则显著低于400CGA、600CGA组,与200CGA组差异不显著,同样说明添加CGA可促进肝胰脏脂质代谢,此试验结果与Shimoda等[27]、De Sotillo等[28]的研究结果基本一致,均证实CGA对脂质代谢具有较好的调节作用。
本试验结果显示,添加400和600 mg/kg CGA均可增强脂质代谢能力,根据400CGA、600CGA组试验结果中相关脂质代谢指标的含量,与C组结果对比,探讨最佳添加水平。400CGA组血清中T-CHO、HDL-C、LDL-C含量的变化均达到显著水平,故认为添加400 mg/kg CGA对血清中脂质代谢的调节能力最佳。400CGA、600CGA组各项肝胰脏脂质代谢指标均显示出与C组的显著差异,与C组相比,400CGA组肝胰脏中TG、T-CHO、LDL-C分别降低了64.73%、47.05%、57.95%,肝胰脏中HDL-C含量提高了74.95%,600CGA组肝胰脏中TG、T-CHO、LDL-C分别降低了60.07%、41.16%、45.35%,肝胰脏中HDL-C含量提高了76.04%,由此可见,400 mg/kg CGA对肝胰脏脂质代谢的调节作用强于600 mg/kg CGA。综合得出,400 mg/kg CGA的对血清和肝胰脏的脂质代谢调节作用较好。
3.3.2 肝胰脏中脂质代谢酶
LPL主要作用是分解乳糜微粒、极低密度脂蛋白和中密度脂蛋白中的TG为游离脂肪酸和甘油,以供机体组织储存和氧化利用[32]。HL主要分解乳糜残粒中的TG,并参与高密度脂蛋白的重构、极低密度脂蛋白的代谢以及T-CHO的逆向转运的调节[33]。本试验中,添加CGA可有效地提高肝胰脏中脂质代谢酶的活力,且在400CGA组与C组差异达显著水平,与C组组对比,400CGA组肝胰脏中LPL、TL、HL活力分别提高了57.95%、74.95%、86.24%,可知添加400 mg/kg CGA可大幅提高肝胰脏脂质代谢酶活力,且添加400 mg/kg CGA使肝胰脏中TG、T-CHO含量显著降低,推测此结果可能是CGA添加致使肝胰脏LPL与HL活力升高,促进肝胰脏中TG分解为游离脂肪酸,从而降低肝胰脏中TG、T-CHO含量。由此可知,添加400 mg/kg CGA可增强草鱼肝胰脏在高脂环境下的脂质代谢能力。
3.3.3 高脂饲料中添加CGA对草鱼肝胰脏细胞中脂质沉积的影响
锇酸与脂质反应生成黑色锇和脂质复合物,不溶于固定过程中的二甲苯等有机溶剂,因而锇酸染色能精确的显示细胞中脂肪滴的大小及数量[34]。本试验中,肝胰脏切片锇酸染色后经透射电镜观察发现,C组脂滴数量较多且脂滴体积也相对较大,脂滴密集分布于肝细胞中,表明在肝胰脏中有大量的脂质沉积,长期饲喂高脂饲料使草鱼肝胰脏产生了严重的脂质代谢负担,若不能及时降解肝胰脏中的脂质,易使脂质大量沉积在肝胰脏组织中,造成营养性脂肪肝等疾病,影响肝脏正常生理功能[35]。与C组相比,试验组脂滴体积都明显较小,且分布较稀疏,说明高脂饲料中添加CGA降低了肝胰脏中脂质含量,减少脂肪沉积,尤其以400CGA和600CGA组最为明显。进一步观察比较,400CGA组中肝胰脏中脂滴数量、体积大小、分布密度均小于600CGA组,可知400CGA组肝胰脏脂质沉积少于600CGA组,CGA添加水平为400 mg/kg时肝胰脏脂质代谢能力优于添加水平为600 mg/kg时。由此可以说明,高脂饲料中CGA添加水平为400mg/kg时能促进肝胰脏脂质代谢。
4 结 论
本试验条件下,草鱼幼鱼阶段的高脂饲料中添加CGA 400 mg/kg可增强草鱼脂质代谢能力,促进草鱼生长。
