GLP-1减轻糖基化终末产物对肾小管上皮细胞(HK-2)重吸收功能的影响
2018-08-07尹卫芹许世清娄晋宁
尹卫芹 ,许世清 ,翟 敏 ,王 在 ,娄晋宁 ⋆
(1.中国医学科学院 北京协和医学院 研究生院,北京 100730;2.中日友好医院 临床医学研究所,北京 100029)
糖尿病肾病(diabetic nephropathy,DN)是引起终末期肾脏疾病的主要原因,也是导致糖尿病患者生活质量下降及高死亡率的的主要原因[1,2]。长期高血糖导致还原糖在非酶促作用下与蛋白氨基反应形成的复合物,经过一系列的结构重组及脱水,产生了糖基化终末产物(advanced glycation end products,AGEs)[3~5]。 AGEs 在糖尿病肾病的发生及发展过程中起着重要作用,我们前期研究发现其不仅损伤肾小球而且影响肾小管的功能。
胰高糖素样肽 1(glucagon-like peptide 1,GLP-1)是主要由肠道分泌的一种肠源性激素,在进食后促进胰岛β细胞分泌胰岛素[6],是目前临床治疗2型糖尿病的辅助药物。近年来多项实验研究证实其对糖尿病肾病也具有一定疗效:Ren X等人曾发现GLP-1可减轻糖尿病动物的肾小球病变[7],我们前期研究发现GLP-1也可以减轻糖尿病大鼠的肾小管损害,其机制之一可能是减轻了肾间质的炎症反应[8]。但动物实验不能完全排除GLP-1降糖作用对肾脏的保护作用,因此,本研究利用体外培养的人肾小管上皮细胞系HK-2细胞,用AGEs培养模拟糖尿病状态,分析GLP-1对肾小管上皮的直接作用及其机制。
1 材料和方法
1.1 主要材料及试剂
人近端肾小管上皮细胞 (human proximal tubular epithelial cells,HK-2)(本实验室自存)。GLP-1(7-36)(上海华依科技发展股份有限公司惠赠)。AGEs(Abcam公司,英国)。甘精胰岛素(Insulin, 赛诺菲公司,法国)。 兔抗 PKA、PKC-β、iNOS、SOD-1抗体(Abcam 公司,英国)。鼠抗 βactin抗体、辣根过氧化物酶 (HRP)标记羊抗兔IgG、HRP标记兔抗鼠 IgG(Sigma公司,上海)。
1.2 细胞分组及处理
将对数生长期的HK-2细胞分成4组,培养基使用5%血清的M199培养基,各组分别添加药物情况如下:对照组(N):不添加任何药物;AGEs组:添加AGEs终浓度为 400μg/ml;AGEs+GLP-1组: AGEs 400μg/ml+GLP-1 10-8M;和 AGEs+Insulin组: AGEs 400μg/ml+Insulin 1IU/ml。 各组细胞均培养24h后进行后续检测。检测PKA和PKC通路的干预作用时,另外设AGEs+GLP-1+PKCa组:在AGEs+GLP-1组处理前30min给予PKC激动剂 PMA 200nM;AGEs+GLP-1+PKAi组:在AGEs+GLP-1组处理前30min给予PKA抑制剂H-89 10μM。
1.3 HK-2细胞白蛋白吸收能力的检测
将人HK-2细胞接种于96孔板,按上述分组,每组设4个平行孔,处理细胞24h,然后将FITC标记的白蛋白加入到培养基内,终浓度20μg/ml,孵育 30min。 PBS 洗 3 次,每次 3min,彻底洗去培养基中的白蛋白。每孔添加100μl基础培养基,在倒置显微镜下观察细胞的荧光强度,使用连续光谱荧光仪检测各孔细胞的荧光强度,并用每孔细胞的总蛋白进行标准化以避免细胞数量不同导致的误差,通过比较荧光强度/μg蛋白,分析各组细胞在同样数量下对白蛋白的吸收能力。
1.4 实时荧光定量PCR
收获细胞,按Trizol说明书提取各组细胞总RNA,按TaKaRa公司说明书进行反转录,使用SYBR染料法在ABI7500系统上进行实时荧光定量PCR扩增。所用引物见表1。总反应体积25μl,反应条件:预变性95℃2min,扩增条件为95℃5s、60℃ 30s,40 个循环。
1.5 Western blot检测
使用SDS裂解液提取细胞总蛋白,每孔加入40μg细胞总蛋白进行10%SDS-PAGEs分离,然后将蛋白转印至PVDF膜,5%脱脂奶粉室温封闭PVDF 膜 1h,分别加入抗 PKC-β(1:1000)、 PKA(1:1000)、SOD-1 (1:800)、iNOS (1:800) 和 βactin(1:10000)抗体,4℃过夜。 洗膜后加入 HRP标记羊抗兔IgG(1:5000)和 HRP 标记兔抗鼠(1:5000)的二抗,室温孵育1h。洗膜后加入ECL化学发光剂,凝胶成像系统显影。

表1 PCR扩增的引物

图1 B 连续光谱荧光仪测定结果
1.6 统计学方法
应用SPSS17.0软件进行统计学分析。两组间比较采用t检验,多组间比较采用单因素方差分析。
2 结果
2.1 GLP-1对AGEs处理的人HK-2细胞白蛋白吸收能力的影响
荧光显微镜下可观察到:HK-2细胞经AGEs处理后,细胞吸收白蛋白的能力明显低于正常对照组,同时给予GLP-1组,HK-2细胞仍维持较好的白蛋白吸收能力,与对照组无差别,但同时给予AGEs和Insulin组与AGEs组的白蛋白吸收能力相似(图1A,封二)。应用连续光谱荧光仪测定各孔细胞的荧光强度,为避免因各组细胞数量不同导致误差,用每孔细胞的总蛋白进行标准化,荧光强度的结果与镜下观察的一致(图1B)。
2.2 GLP-1对HK-2细胞上Megalin和Cubilin表达的影响
在 AGEs处理组,Megalin(图 2A)和 Cubilin(图2B)的mRNA水平和蛋白质水平表达均明显低于正常对照组。同时给予AGEs和GLP-1组,HK-2细胞内Megalin和Cubilin的表达明显高于AGEs处理组。但同时给予Insulin组与AGEs组无显著性差异(图2)。
2.3 GLP-1对AGEs处理的HK-2细胞内PKA和PKC-β表达的影响
在检测细胞内PKA(图3A)和PKC(图3B)水平时发现,与正常对照组相比,AGEs处理组的PKA 表达明显降低(P<0.05),而 PKC-β 的表达明显升高。与AGEs处理组相比,AGEs+GLP-1处理组的PKA表达明显升高,PKC-β的表达明显降低(P<0.05)。 然而,AGEs+Insulin 处理组与 AGEs组无显著性差异。提示GLP-1可部分阻断AGEs的作用,但Insulin无显著效果。
2.4 GLP-1对AGEs诱导的人HK-2细胞内iNOS和SOD-1表达的影响
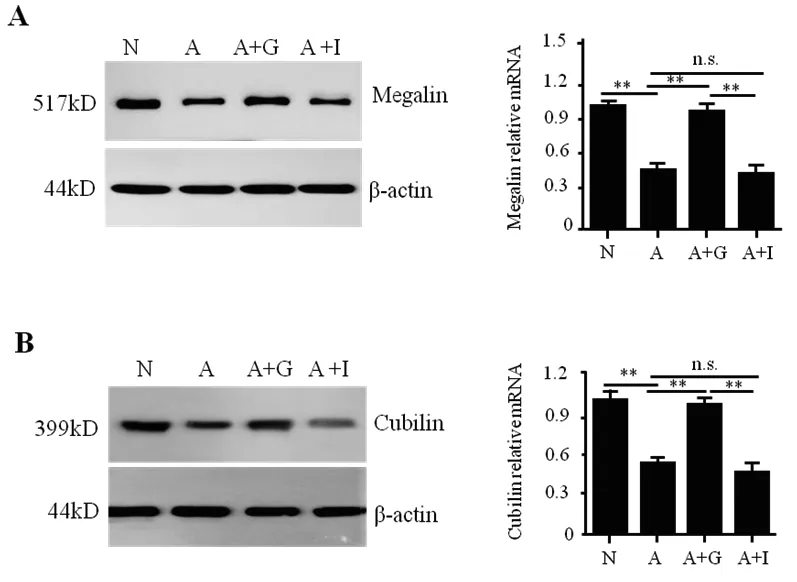
图2 GLP-1对AGEs诱导的HK细胞内Megalin和Cubilin表达的影响
通过RT-PCR和Western blot发现,iNOS在正常HK-2上有基础表达,给予AGEs处理后表达明显增加。与AGEs组相比,GLP-1+AGEs组的表达明显降低,而AGEs+Insulin组表达无显著变化(图4A)。同时,AGEs组的SOD-1表达明显低于正常组,且与AGEs组相比,GLP-1+AGEs组的SOD表达显著升高,而AGEs+Insulin组的表达无显著变化(图4B)。
2.5 PKC抑制剂和PKA激活剂对人HK-2细胞内iNOS和SOD-1表达的影响

图3 GLP-1对AGEs处理的人HK-2细胞内PKA和PKC-β表达的影响
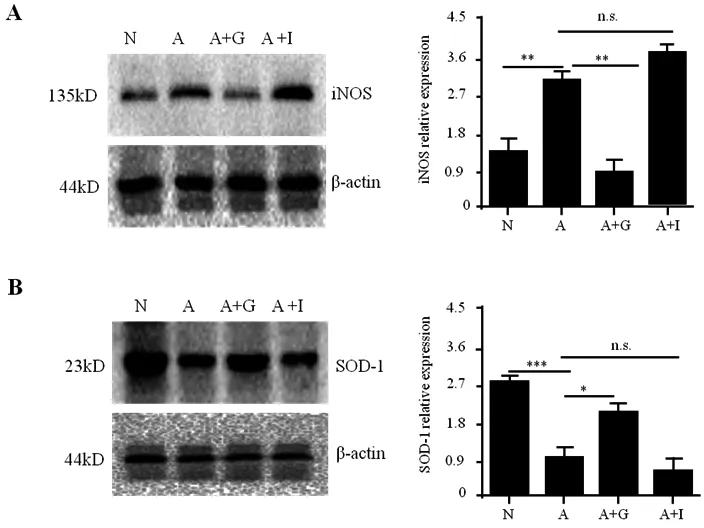
图4 GLP-1对AGEs处理的人HK-2细胞内iNOS和SOD-1表达的影响

图5 干预PKA或PKC通路对GLP-1调节iNOS和SOD-1表达的影响
为分析PKA和PKC的表达变化是否参与GLP-1对iNOS和SOD的调节,在AGEs+GLP-1组的基础上分别给予PKA抑制剂和PKC激动剂,结果发现,给予干预后,GLP-1对iNOS(图5A)和SOD(图5B)的影响被部分阻断。提示GLP-1通过影响PKA和PKC通路发挥抗氧化应激作用。
3 讨论
生理条件下,GLP-1调节了机体的营养和能量代谢。自从GLP-1类药物被用于糖尿病的治疗后,对其作用的研究越来越深入,由于GLP-1通过与其受体结合发挥作用,而目前发现GLP-1的受体在肾脏组织中有较高水平的表达,因此,GLP-1在糖尿病肾病中的作用日益受到关注[9]。为分析GLP-1的作用是否不依赖于促胰岛素分泌而是直接作用于肾脏,本研究采用HK-2细胞研究了GLP-1对肾小管上皮细胞的直接作用。
糖尿病肾病时,患者尿白蛋白的产生不仅由于肾小球的滤过作用受损,也与近端肾小管对白蛋白的重吸收作用降低有关[10]。通过观察HK-2细胞对荧光标记的白蛋白的吸收作用,我们发现GLP-1可以防止AGEs处理导致的HK-2细胞白蛋白吸收能力的降低。近端肾小管上皮细胞对白蛋白重吸收的作用是通过2个蛋白受体Megalin和Cubilin完成[11]。这2个蛋白受体表达的改变,能够影响近端肾小管对白蛋白吸收作用[12,13]。在本研究中,我们的结果证实GLP-1保护了HK-2细胞内与近端肾小管蛋白重吸收2个蛋白受体Megalin和Cubilin的表达水平,因此维持细胞对白蛋白的正常吸收功能。
我们前期对糖尿病肾间质病变的研究发现,PKA的降低和PKC的升高参与糖尿病肾病的发生,并且与肾小管的重吸收功能有关。由于PKA和PKC与引起糖尿病肾病损伤的氧化应激密切相关[14,15],因此,我们随后检测了 GLP-1 对 PKA、PKC以及氧化应激的影响,结果证实,GLP-1可减轻AGEs处理后HK-2细胞内的氧化应激,且机制与GLP-1升高PKA和降低PKC水平有关。
本研究结果提示,糖尿病时肾小管上皮细胞内PKA和PKC等多条信号通路活性发生改变,而GLP-1可直接作用于肾小管上皮细胞,通过调节PKA和PKC信号通路,维持细胞对白蛋白的正常重吸收功能,从而减轻蛋白尿。
