甜菜红素的生物活性研究
2018-07-31吕思润吴玉梅代翠红罗成飞程大友
吕思润,吴玉梅,代翠红,罗成飞,程大友*
(1.哈尔滨工业大学化学与化工学院,黑龙江 哈尔滨 150086;2.黑龙江大学农作物研究院/中国农业科学院甜菜研究所/农业部糖料产品质量安全风险评估实验室(哈尔滨),黑龙江 哈尔滨 150080)
0 前言
天然色素具有巨大的健康效益,能够避免各种各样的危害,特别在慢性疾病的形成和发展方面,被认为是理想的保健食品。常用的天然色素有类胡萝卜素、叶绿素、花青素和甜菜色素[1,2]。
甜菜红素是杂环酪氨酸衍生的色素,酚部分和环状胺基使这类化合物具有还原性[3,4]。体外实验中,甜菜红素在无机体系和有机体系中都表现出抗氧化的能力,抑制低密度脂蛋白氧化的效果良好[4,5],具有促进免疫系统和预防心血管疾病、神经变性疾病及化学治疗癌症的作用[6]。因此,甜菜红素可以应用于食品、制药和化妆品行业。本实验通过测定甜菜红素的体外化学抗氧化和体外细胞抗氧化水平,与阳性物质Vc作比较,获得甜菜红素的生物活性水平,为甜菜红素的抗氧化机制研究奠定理论基础。
甜菜色素是一类天然色素,目前已经发现,甜菜色素具有50多种结构,主要分成两大类,一类是紫红色的甜菜红素(betacyanin),一类是黄色的甜菜黄素(betaxanthin)[7]。这些色素主要存在于植物的根或者花中,也在一些真菌中发现过[8]。甜菜根中甜菜色素的含量明显大于其他植物,是提取甜菜红素或者甜菜醛酸的重要资源。有意思的是,甜菜红素和花青素在植物中是相斥的,也就是说一种植物产生甜菜红素,就不会产生花青素,但是甜菜色素的合成前体酪氨酸和花青素的合成前体乙酰辅酶A都来源于苯丙氨酸[15]。由于甜菜色素的氧化还原电位,它们具备还原能力,可以充当脂质自由基清除剂来增加人体LDL对氧化的抵抗能力[9]。甜菜红素对膜脂质过氧化、亚油酸乳化(细胞色素C催化)和H2O2激活的的高铁肌红蛋白或脂氧合酶具有抑制作用[10]。甜菜色素能够保护血管内皮细胞免受细胞因子诱导的氧化还原状态的改变,血管内皮细胞是炎症反应中氧化应激的直接靶点[11]。此外,红甜菜的其他成分也显示出显著的抗氧化性能,如环多巴葡萄糖苷、羟基肉桂酸及其衍生物[12]。因此,红甜菜被美国防癌协会列为30种有防癌作用的果蔬之一[13]。
1 材料与方法
1.1 实验材料与仪器设备
1.1.1 实验材料
本实验中采用的原料为新鲜红甜菜块根,细胞为人类结肠癌HT29细胞系。实验中所用的其他主要化学试剂主要为化学纯试剂。
1.1.2 实验仪器设备
本实验中使用的主要仪器设备紫外可见分光光度计,北京普析通用仪器有限公司;酶标仪(Eon)基因有限公司;荧光酶标仪(Infinite M200PRO)帝肯贸易有限公司;台式高速冷冻离心机(3K15)北京五洲东方科技发展有限公司;台式离心机(TGL-16G)上海安亭科学仪器厂;冷冻干燥机(Zirbus)嘉盛(香港)科技有限公司;二氧化碳细胞培养箱(SW-CJ-2FD)苏州安泰空气技术有限公司。
1.2 研究方法
1.2.1 DPPH·自由基清除能力的测定
(1)实验试剂的配制
DPPH·溶液:称取DPPH·(二苯代苦味酰自由基)10.00 mg,用无水乙醇溶解,并定容至250 mL棕色容量瓶中,得到浓度为0.1 mM的DPPH·溶液,避光4℃保存;
甜菜红素溶液:4 mg/mL(w/v),用时稀释;
Vc溶液:4 mg/mL(w/v),用时稀释。
(2)实验方法
按照表1,准确吸取S、S0、C和C0四组样液加入到96孔板中,S、S0、C和C0分别为样品、样品空白、对照和对照空白的反应体系,立即检测517 nm处吸光值;室温避光孵育30 min后,再次测定517 nm处吸光值,按照公式(1)计算DPPH·自由基的清除率。
(1)
其中:Dr:DPPH·自由基清除率(DPPH· clearance rate);As: 甜菜红素/Vc清除DPPH自由基体系的吸光值;As0: 甜菜红素/Vc空白组的吸光值;Ac: 对照组的吸光值;Ac0:对照空白组的吸光值。
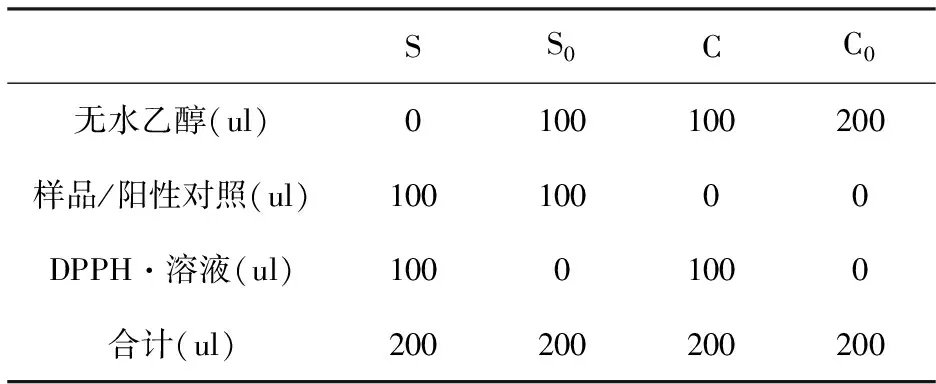
表1 DPPH·自由基清除反应体系
注:甜菜红素溶液的浓度为50 ug/mL、100 ug/mL、200 ug/mL、400 ug/mL和800 ug/mL;Vc溶液的浓度为50 ug/mL、100 ug/mL、200 ug/mL、400 ug/mL和800 ug/mL。
1.2.2 阳离子自由基清除能力的测定
(1)实验试剂的配制
过硫酸钾溶液:称K2S2O80.166 g,定容到250 mL,配制成2.45 mM的溶液;
ABTS溶液:准确称取ABTS(2,2-联氮基双乙基苯并噻挫啉-6-磺酸二氨盐)粉末0.192 g,用2.45 mM过硫酸钾溶液溶解,并定容至50 mL棕色容量瓶中,得到浓度为7 mM的ABTS溶液,室温避光保存12 h后,即可使用。实验开始前,将ABTS溶液稀释至吸光值为0.70(±0.02),浓度约为0.07 mM。
(2)实验方法
按照表2准确吸取S、S0、C和C0四组样液加入到96孔板中,S、S0、C和C0分别为样品、样品空白、对照和对照空白的反应体系。室温避光反应6 min后立即测其在734 nm处吸光值,根据公式(2)计算ABTS·﹢的清除率。
(2)
其中:Ar:ABTS·﹢clearance rate(ABTS﹒阳离子自由基清除率);As:甜菜红素/Vc清除ABTS阳离子自由基体系的吸光值;As0:甜菜红素/Vc空白组的吸光值;Ac:对照组的吸光值;Ac0:对照空白组的吸光值。
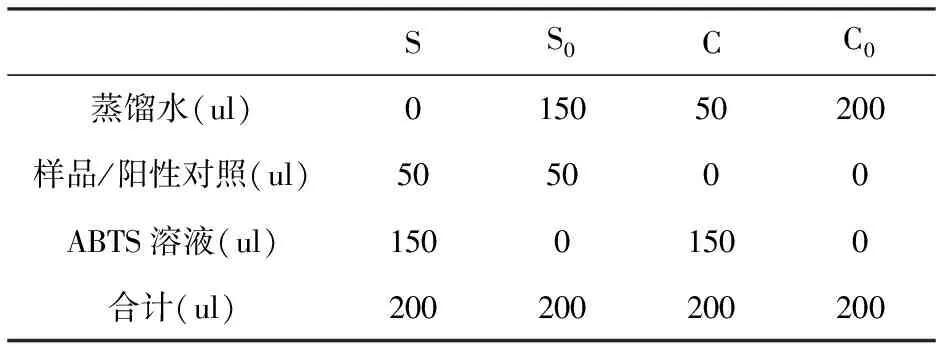
表2 ABTS·阳离子自由基清除反应体系
注:甜菜红素溶液的浓度为50 ug/mL、100 ug/mL、200 ug/mL、400 ug/mL和800 ug/mL;Vc溶液的浓度为5 ug/mL、10 ug/mL、15 ug/mL、25 ug/mL和50 ug/mL。
1.2.3 羟基自由基清除能力的测定
(1)实验试剂的配制
磷酸盐缓冲液:A溶液即0.2 mol/L K2HPO4·3H2O 11.41 g,定容至250 mL;B溶液即0.2 mol/L KH2PO4溶液,称取KH2PO41.36 g,定容至50 mL;取A溶液160 mL,B溶液40 mL,得到pH为7.4,浓度为0.2 mol/L的磷酸缓冲溶液;
邻菲罗啉溶液:2.5 mM;
硫酸亚铁溶液:7.5 mM;
过氧化氢溶液:1%,30%过氧化氢溶液稀释30倍。
(2)实验方法
取4 mL离心管,按照表3,准确吸取S、S0、C和C0四组样液,S、S0、C和C0分别为样品、样品空白、对照和对照空白的反应体系。依次加入PB缓冲溶液,邻菲罗啉溶液,充分混匀后加入硫酸亚铁溶液,每加一管立即混匀。然后加入过氧化氢溶液,37℃保温1 h,在536 nm处测定吸光值,根据公式(3)计算羟自由基清除率。
(3)
其中:As: 甜菜红素/Vc组的吸光度值;As0: 甜菜红素/Vc的空白组的吸光度值;Ac0: 空白损伤组的吸光度值;Ac: 空白组的吸光度值。
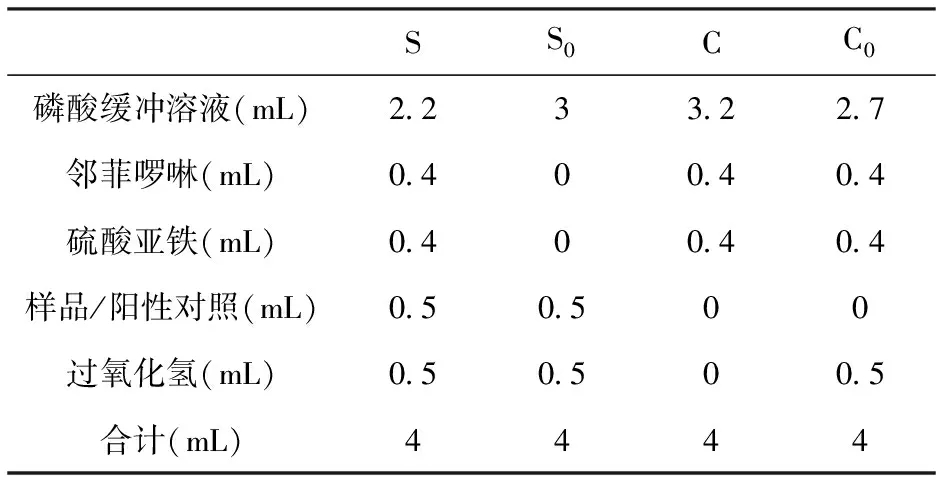
表3 羟基自由基清除反应体系
注:甜菜红素溶液的浓度为50 ug/mL、100 ug/mL、200 ug/mL、400 ug/mL和800 ug/mL;Vc溶液的浓度为50 ug/mL、100 ug/mL、200 ug/mL、400 ug/mL和800 ug/mL。
1.2.4 超氧阴离子清除能力的测定
(1)实验试剂的配制
Tris-HCl缓冲液:吸取2.1 mL浓盐酸,加蒸馏水定容至250 mL,得到0.1 M的盐酸溶液;称取三羟甲基氨基甲烷3.03 g,加入约114.5 mL 0.1 M HCl溶液,用蒸馏水定容至500 mL,得到pH值为8.2,浓度为50 mM的Tris-HCl溶液;
邻苯三酚溶液:用0.01 M HCl溶液配制浓度为3 mM的邻苯三酚溶液。
(2)实验方法
取4 mL离心管,按照表4准确吸取S和C两组样液,S、C分别为样品和对照的反应体系。依次加入缓冲液,蒸馏水,样品或对照品,然后在26℃恒温水浴20 min。
吸取200 uL水浴后的溶液到96孔板中,再加入15 uL邻苯三酚溶液,立即混匀,在325 nm下测定吸光度值,每间隔40 s记录一组数据,共反应6 min。在同一浓度条件下,以时间为横坐标,吸光度值为纵坐标,做回归直线方程,方程的斜率即为邻苯三酚的自氧化速率,根据公式(4)即可得出样品或阳性对照在该浓度时的超氧自由基清除率。
Sr=(A0-A)/A0×100%
(4)
其中:A0:空白对照组的邻苯三酚的吸光度;A:实验组的邻苯三酚的吸光度。
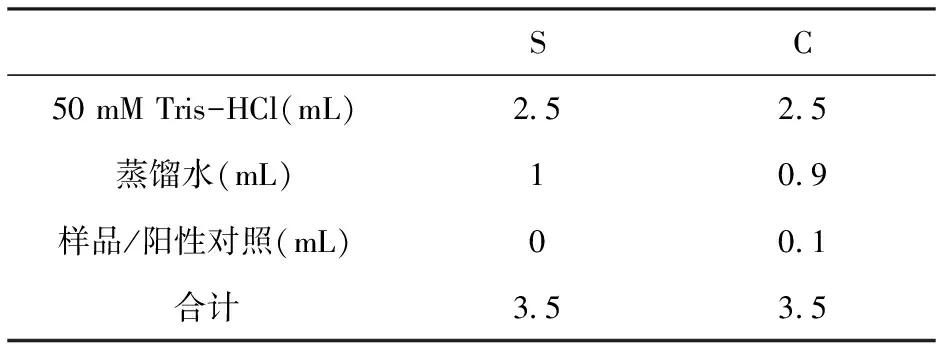
表4 超氧自由基清除反应体系
注:甜菜红素溶液的浓度为200 ug/mL、400 ug/mL、600 ug/mL、800 ug/mL和1 000 ug/mL;Vc溶液的浓度为200 ug/mL、400 ug/mL、600 ug/mL、800 ug/mL和1 000 ug/mL。
1.2.5 还原能力的测定
(1)实验试剂的配制
磷酸盐缓冲液:A溶液即0.2 mol/L Na2HPO4·12H2O,称取Na2HPO4·12H2O 7.16 g,定容至100 mL;B溶液即0.2 mol/L NaH2PO4溶液,称取NaH2PO4·2H2O 3.12 g,定容至100 mL;取A溶液37.5 mL,B溶液62.5 mL,得到pH为6.6,浓度为0.2 mol/L的磷酸缓冲溶液;
三氯乙酸溶液:10%(w/v);
三氯化铁溶液:0.1%(w/v);
铁氰化钾溶液:1%(w/v)。
(2)实验方法
取4 mL离心管,加入0.4 mL样品/阳性对照品,磷酸缓冲溶液1 mL,铁氰化钾溶液1 mL,混合均匀,50℃水浴20 min,然后加入1 mL三氯乙酸溶液,静置10 min,自然沉淀。
其中,样品(甜菜红素)浓度为:250 ug/mL、500 ug/mL、1 000 ug/mL、2 000 ug/mL和4 000 ug/mL;Vc浓度为:50 ug/mL、100 ug/mL、200 ug/mL、400 ug/mL和800 ug/mL;空白对照就是将样品或阳性对照换成同等体积的蒸馏水。样品和对照品溶液均用蒸馏水配制。
取上清液200 uL,加到96孔板中,再加入20 uL三氯乙酸,对照组加入20 uL蒸馏水。混匀,在700 nm处测吸光值,利用公式(5)计算还原力。
Rc=A/A0
(5)
其中:Rc:Reducing capacity(还原能力);A:样品和阳性对照的吸光值;A0:空白对照的吸光值。
1.2.6 脂质抗氧化能力的测定
(1)实验试剂的配制
磷酸盐缓冲液:A溶液即0.1 M Na2HPO4溶液;B溶液即0.1 M NaH2PO4溶液;取A溶液84 mL、B溶液16 mL,得到pH为7.45,浓度为0.1 M的PB溶液;
硫酸亚铁溶液:25 mM,保存在棕色试剂瓶中;
三氯乙酸溶液(TCA):20%;
硫代巴比妥酸(TBA):0.8%,用50 mM NaOH溶液配制,50℃水浴溶解;
卵磷脂悬液:10 mg/mL,PB缓冲溶液配制,超声溶解,保存在4℃冰箱中。
(2)实验方法
按照表5准确吸取S和C两组体系,S和C分别为样品和对照的反应体系。
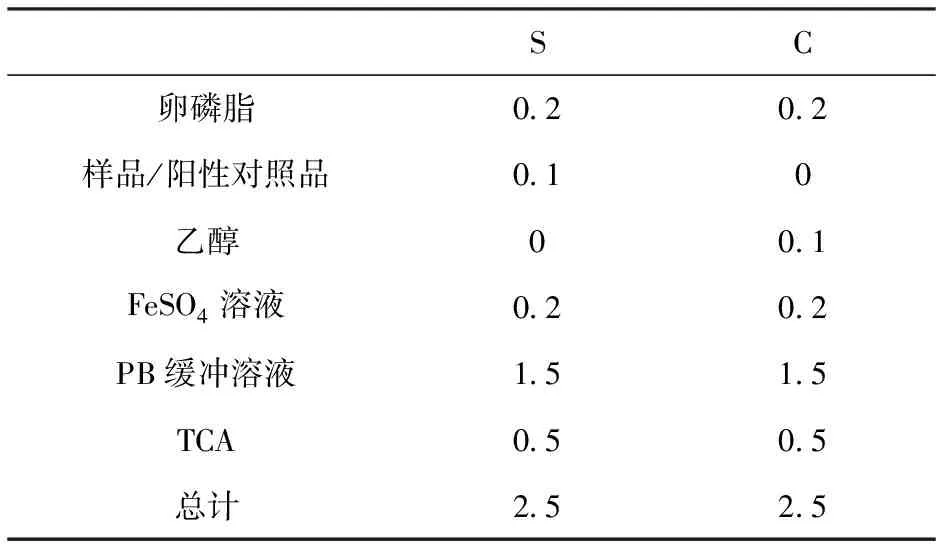
表5 抗脂质过氧化反应体系
注:甜菜红素溶液的浓度为200 ug/mL、400 ug/mL、600 ug/mL、800 ug/mL和1000 ug/mL;Vc溶液的浓度为200 ug/mL、400 ug/mL、600 ug/mL、800 ug/mL和1 000 ug/mL。
加入卵磷脂悬液、样品/阳性对照品、FeSO4溶液和PB缓冲溶液后,于37℃恒温水浴1 h,取出后立即加入三氯乙酸,终止反应。然后,5 500 r/min离心10 min,取1 mL上清,加入0.5 mL TBA溶液,盖好,100℃保温15 min,取出冷却。在532 nm下测定吸光值,根据公式(6)计算样品/阳性对照对脂质过氧化的抑制率。
(6)
其中:Ac:不加甜菜红素溶液和阳性对照组的吸光度值;As:加入甜菜红素溶液和阳性对照组的吸光度值。
1.2.7 甜菜红素的体外化学抗氧化研究
(1)细胞培养、传代与冻存
(a)实验试剂的配制
PBS缓冲液:称取KH2PO40.27 g,Na2HPO41.42 g,NaCl 8 g,KCl 0.2 g,加双蒸水约800 mL充分搅拌溶解,然后加入浓盐酸调pH至7.4,最后定容到1 L。
改良型RPMI-1640:RPMI-1640培养基补加10%的灭活胎牛血清(50℃灭活30 min)、100 U/mL青霉素、100 mg/L链霉素和1%谷氨酰胺。
(b)实验方法
HT-29结肠癌细胞传代后,接种在4×6 cm的培养瓶中,在37℃、5%的细胞孵育箱中培养。
细胞传代时,吸除培养瓶中的液体培养基。然后加入5 mL PBS溶液,目的是除去细胞间隙的蛋白,便于胰酶的消化,摇晃细胞培养瓶,吸除PBS溶液。加入1~2 mL 0.25%的胰蛋白酶,消化0.5~1 min,待消化完全后加入5 mL培养基终止消化。用吸管轻轻吹打数次,使细胞完全分散到培养基中。将此培养基转移到离心管中,以1 000 r/min离心5 min,去上清,目的是去除胰酶和死细胞,然后加入5 mL培养基,反复吹打,重悬细胞。
(2) 甜菜红素和Vc对HT-29细胞存活率的影响
(a)实验试剂的配制
甜菜红素/Vc溶液:称取0.020 g甜菜红素/Vc,用10 mL配置好的培养基溶解,混合均匀,配成母液。然后使用注射器和水系的、0.2 um的一次性滤器过滤掉培养基中的细菌,使用石蜡膜密封保存。稀释母液,得到不同浓度的样品/Vc溶液。槲皮素先溶解在DMSO中,配制成高浓度的母液,过滤,用培养基稀释,DMSO终浓度为1%。
(b)实验方法
取对数生长期、状态良好的细胞,将其消化、离心后重悬,分于96孔板,每孔100 uL,5000个细胞/孔。在37℃、5%的细胞孵育箱中培养24 h后,分别加入100 uL不同浓度的样液,继续培养24 h。去上清,加入90 uL新鲜培养液,再加入10 uL MTT溶液,继续培养4 h。使用注射器的尖锐针头去上清,每孔加入110 uL Formazan 溶解液,摇晃10 min,使结晶物充分溶解。在490 nm波长处测量各孔吸光值。
设置对照孔(接种细胞,加入培养液、MTT和Formazan溶解液),每孔设定3复孔。在使用96孔板时,为防止蒸发,在最外周的孔中加入PBS缓冲液,。细胞存活率的计算公式如(7)所示。
Cv=A/A0×100%
(7)
其中:A: 加甜菜红素溶液/阳性对照组的吸光度值;A0: 空白对照组的吸光度值。
1.2.8 甜菜红素的细胞抗氧化活性
(1)实验试剂的配制
DCFH-DA溶液:取DCFH-DA粉末,溶解在甲醇溶液中,配制成200 mM的 DCFH-DA储备液,分装,冻存在-20℃的条件中,用时稀释;
ABAP溶液:取ABAP粉末,溶解在蒸馏水中,配制成200 mM ABAP储备液,分装,冻存在-40℃的条件中,用时稀释;
(2)实验方法
参照Wei Song等人[14]的方法改进,首次采用结肠癌HT29细胞系进行CAA实验。
1.2.9 甜菜红素对细胞中抗氧化物质的影响
消化HT29细胞,离心,重悬,计数。以2×106每板接种于细胞培养板,置于37℃、5%的细胞孵育箱,培养12 h后,去上清,每板加入10 mL的不同浓度的样品和50 ug/mL的Vc,继续培养24 h。去上清,用PBS清洗,胰酶消化,收集到离心管中,再用PBS清洗两遍。在4℃的条件下,加入100 uL RIPA细胞裂解液,用PBS稀释20倍,分装,每管300 uL,冻存在-20℃的条件下,用于细胞内抗氧化物质的检测。
分别根据南京建成的过氧化物酶(CAT)检测试剂盒、总超氧化物歧化酶(SOD)检测试剂盒检测过氧化物酶、总超氧化物歧化酶的酶活,用丙二醛(MDA)试剂盒、谷胱甘肽(GSH)试剂盒检测细胞内丙二醛和谷胱甘肽的含量。
1.2.10 不同浓度H2O2溶液对HT-29细胞存活率的影响
(1)实验试剂的配制
H2O2溶液:取30% H2O2溶液,稀释到9 mM,使用注射器和0.2 um的水系一次性滤器过滤H2O2溶液中的细菌,用石腊膜密封保存。用培养基稀释母液,得到浓度为0.025 mM、0.05 mM、0.1 mM、0.2 mM、0.4 mM、0.8 mM、1 mM、2 mM和4 mM的H2O2溶液。
(2)实验方法
取对数生长期、状态良好的细胞,将其消化、离心后重悬,分于96孔板,每孔100 uL,5 000个细胞/孔。37℃、5%的细胞孵育箱培养24 h后,分别加入100 uL不同浓度的H2O2溶液,继续培养2 h,利用MTT法测定细胞活力。
设置对照孔(接种细胞,加入培养液、MTT、Formazan溶解液),每孔设定6复孔。弃去周围一圈孔,加入PBS。
1.2.11 对H2O2诱导的HT-29细胞损伤的修复作用
取对数生长期、状态良好的细胞,将其消化、离心后重悬,分于96孔板,每孔100 uL,5 000个细胞/孔。在37 ℃、5%的细胞孵育箱中培养24 h后,分别加入100 uL 0.1 mM的H2O2溶液,继续培养2 h。小心吸去上清,PBS清洗一次,加入100 uL新鲜培养液,再加入100 uL不同浓度甜菜红素溶液和Vc溶液,培养24 h,利用MTT法测定细胞活力。
设置空白对照孔(加入细胞培养液、培养液、培养液),阴性对照(培养液),每孔设定6复孔。弃去周围一圈孔,加入PBS。
1.2.12 对H2O2诱导的HT29细胞损伤的保护作用
取对数生长期、状态良好的细胞,将其消化、离心后重悬,分于96孔板,每孔100 uL,5 000个细胞/孔。在37 ℃、5%的细胞孵育箱中培养24 h后,分别加入100 uL不同浓度甜菜红素和Vc溶液,培养24 h。小心吸去上清,加入100 uL新鲜培养液,再加入100 uL 0.1 mM的H2O2溶液,继续培养2 h,PBS清洗一次,利用MTT法测定细胞活力。
设置空白对照孔(加入细胞培养液、培养液、培养液),阴性对照(培养液),每孔设定6复孔。弃去周围一圈孔,加入PBS。
1.2.13 数据分析
采用origin 8.0软件绘制图表,进行方差分析(ANOVA)和差异显著性分析,显著性水平P<0.05。实验数据以平均值(Mean)±标准差(SD)表示。
2 结果与分析
2.1 甜菜红素的体外化学抗氧化研究
2.1.1 DPPH·自由基清除能力的测定结果
根据图1所示,甜菜红素和Vc对DPPH·自由基都有较强的清除能力。两者的清除能力都随着浓度的增加而增强,其中Vc在较低浓度时就有较强的清除能力。在甜菜红素的浓度大于1 mg/mL时,甜菜红素对自由基清除能力较强,清除率能够较快达到50%以上。和Vc相比,甜菜红素对DPPH·自由基的清除率随着时间的增加而增加,作用30 min后,清除率增加,而Vc在0 min和30 min时对DPPH·自由基的清除率几乎没有改变。利用电子自旋共振(ERS)波谱检测甜菜红素与DPPH·自由基反应中电子自旋共振的衰退信号,结果表明甜菜红素具有供氢能力[15],这是清除DPPH·自由基的原因。
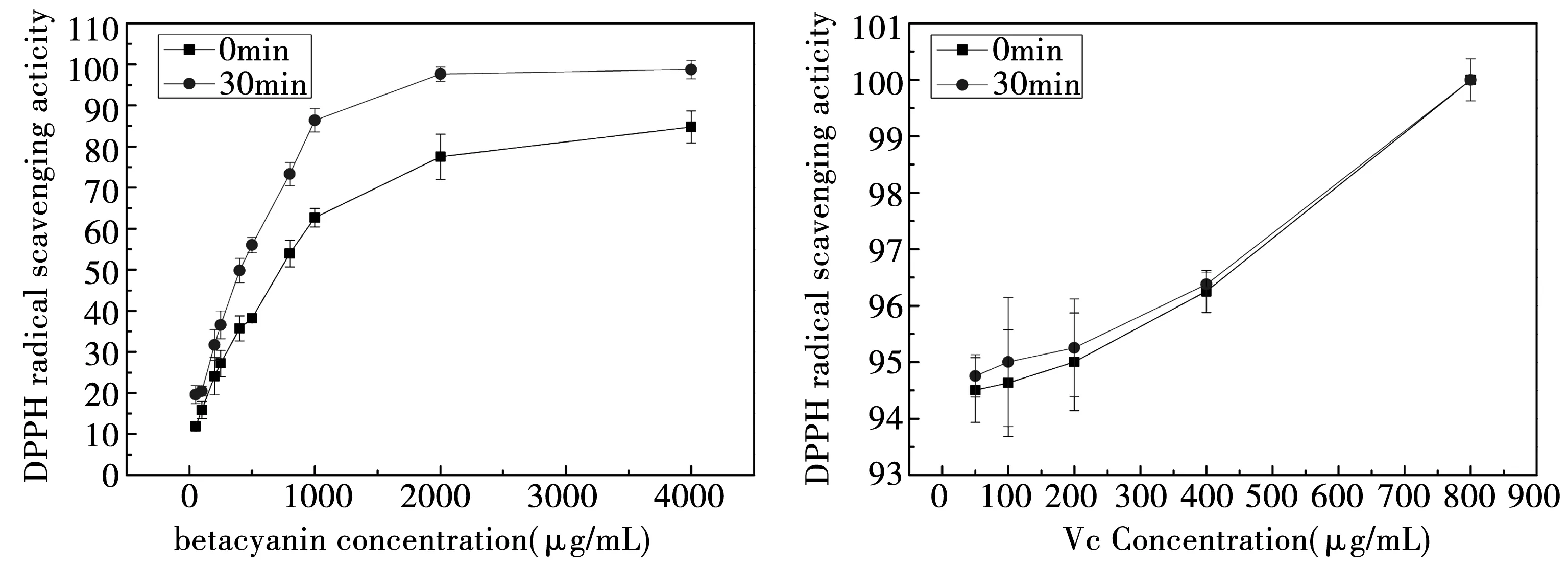
图1 甜菜红素和Vc清除DPPH自由基的能力
2.1.2 ABTS阳离子自由基清除能力的测定结果
根据图2可知,甜菜红素对ABTS 阳离子自由基具有清除能力,而且它的清除能力具有剂量依赖性。随着浓度的升高,ABTS阳离子自由基的清除力上升。但是,甜菜红素的ABTS自由基清除能力比较弱,浓度从50 ug/mL上升到800 ug/mL时,ABTS阳离子自由基的清除率从13%上升到36%,变化范围不大;Vc在5 ug/mL到50 ug/mL很小的变化范围之间,ABTS阳离子自由基的清除率就从6%上升到了100%。
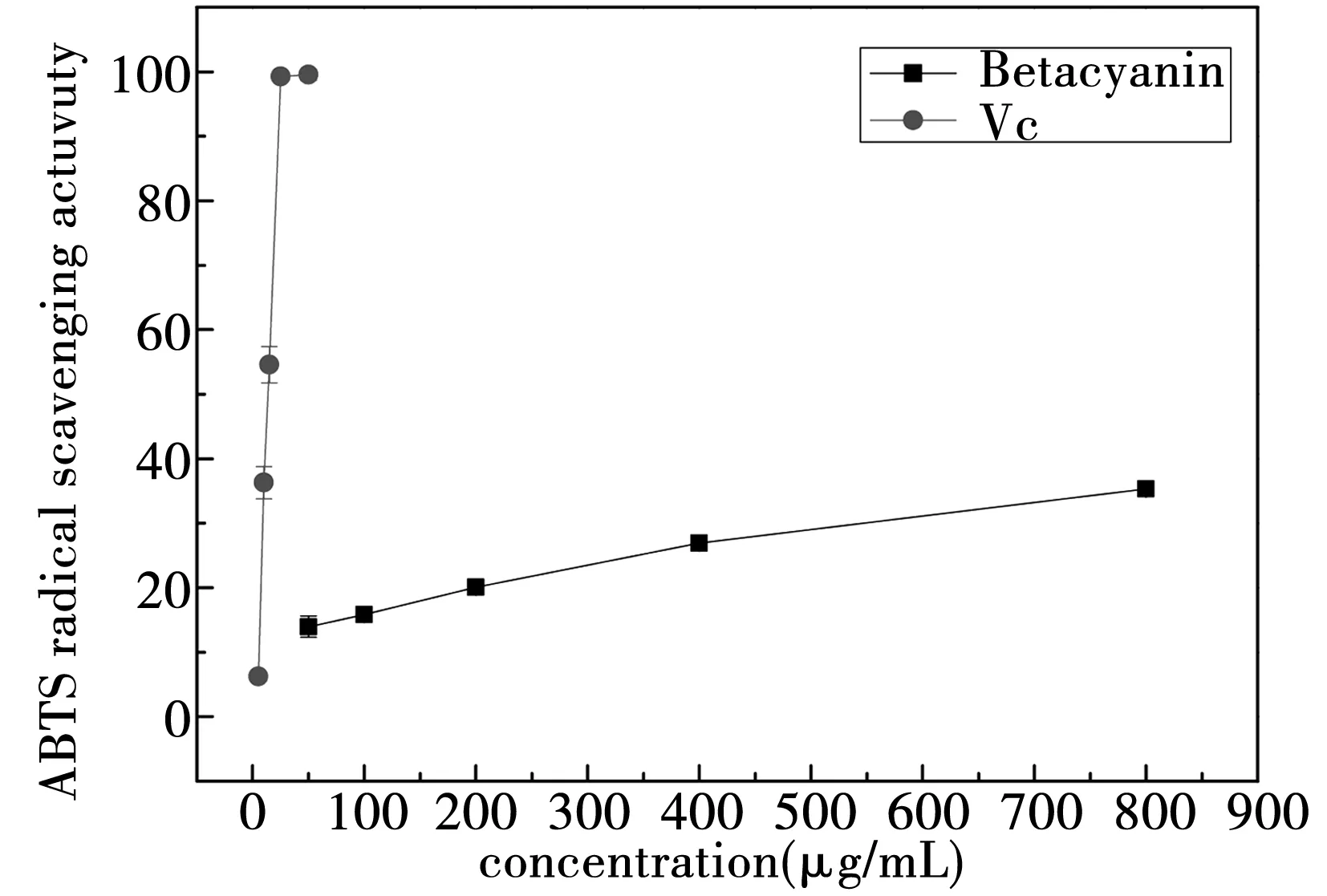
图2 甜菜红素和Vc的ABTS阳离子自由基清除能力
2.1.3 羟基自由基清除能力的测定结果
图3显示,甜菜红素和Vc都具有清除羟基自由基的能力,在50~400 ug/mL之间,甜菜红素和Vc的含量与羟基自由基清除能力之间具有良好的量效关系。随着浓度的上升,羟基自由基的清除能力增加,但是甜菜红素的羟基自由基清除能力弱于Vc。这样的结果和郝秀梅[8]、毕见州[16]和王玉平[17]的研究相符。
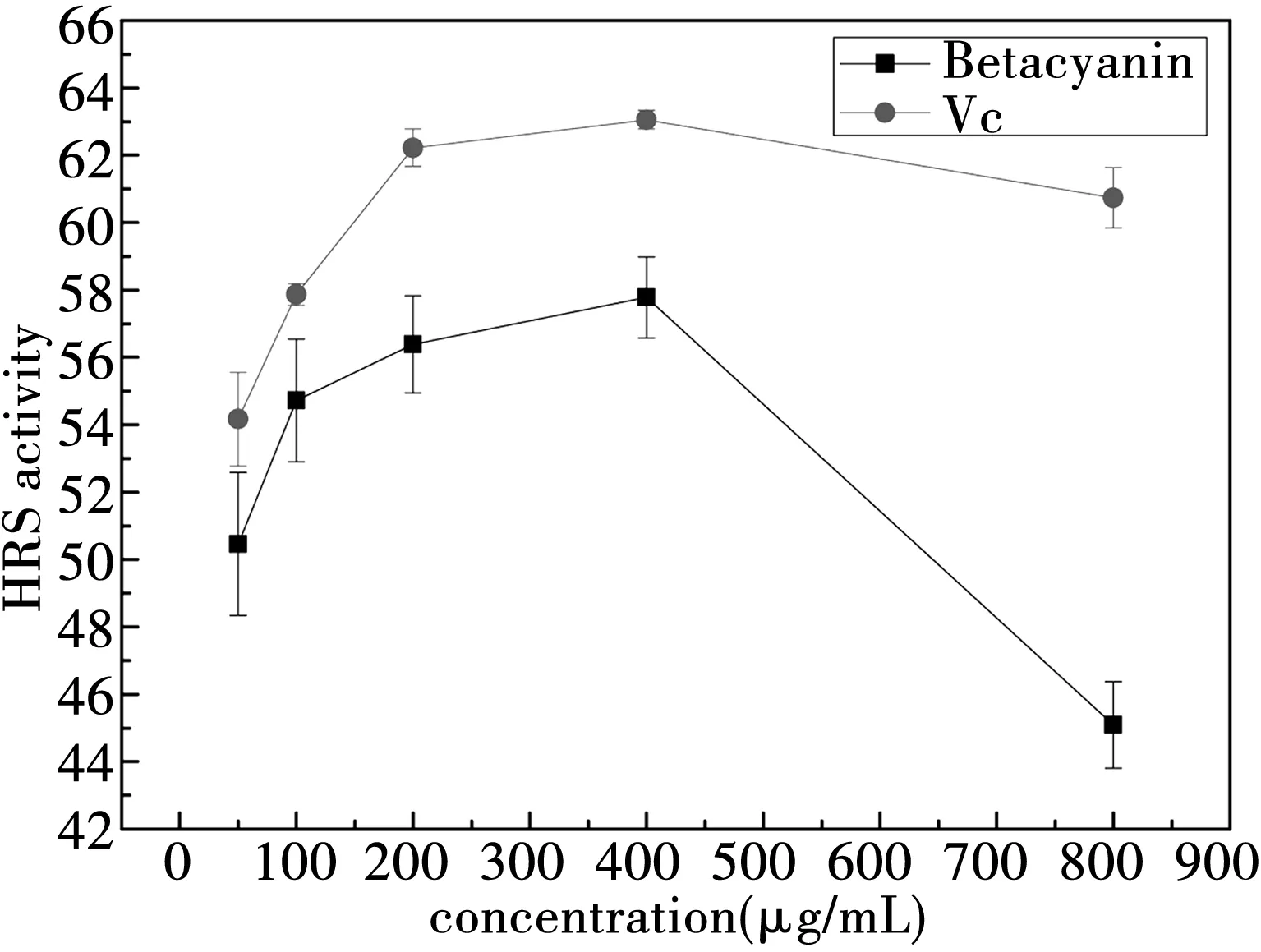
图3 甜菜红素和Vc清除羟基自由基的能力
但是,在浓度上升到800 ug/mL的过程中,甜菜红素的·OH自由基清除能力急剧下降,可能是由于H2O2对甜菜红素活力的影响[16],或者在甜菜红素浓度过大时,过量的甜菜红素与显色物质发生了反应。
2.1.4 超氧阴离子清除能力的测定结果
由图4可知,样品组体系的吸光度都低于空白组(自反应组),表明甜菜红素和Vc都具有清除超氧自由基的能力,其中Vc清除超氧自由基的能力明显强于甜菜红素。利用origin对每组反应体系进行线性拟合,拟合直线的斜率即为反应的速率,拟合的方程在附录2给出。
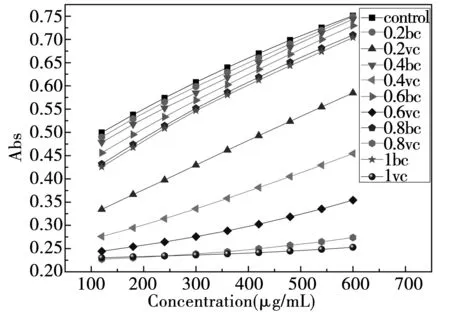
图4 甜菜红素和Vc清除超氧自由基的能力
随着浓度的上升,Vc阳性对照组的反应速率下降,表明高浓度的Vc能够有效的催化超氧自由基。随着浓度的上升,甜菜红素对超氧阴离子的抑制率也上升,但是反应速率上升。可能是因为反应体系是碱性环境,而甜菜红素在碱性条件下是不稳定的,会发生降解反应,并且伴随着颜色的消失。另外,甜菜红素与超氧阴离子反应生成过氧化氢,过氧化氢与甜菜红素相互作用,生成一些促进氧化的物质,比如甜菜苷配基醌。这些氧化物会影响甜菜苷配基的稳定性,甚至在加大离子强度的情况下,也会促进甜菜苷配基的降解[18]。因此,在具有较多离子和氧化物的条件下,甜菜红素的稳定性受到影响,清除超氧自由基的能力下降。
2.1.5 还原力的测定结果
由图5可知,甜菜红素和Vc都具有一定的还原能力,Vc的还原能力大大强于甜菜红素。甜菜红素的浓度上升到4 mg/mL,还原力才上升到11%,而Vc在50 mg/mL时,还原力即可达到11%。可能是因为还原力的测定体系中含有三价的铁离子,而Fe3+会极大地影响甜菜红素的稳定性[19, 21],导致甜菜红素的降解,而且金属离子对甜菜红素的稳定性影响很大,从而影响了甜菜红素的还原能力。
2.1.6 脂质抗氧化能力的测定结果
图6表明,甜菜红素和Vc都能抑制脂质过氧化,而且甜菜红素抑制脂质过氧化的能力强于Vc。表明甜菜红素具有较强的抗脂质过氧化的能力,这与Allegra M.和Tesoriere L.等人的研究一致,甜菜红素能够抑制脂质的过氧化,提高脂质的抗氧化能力。这点与它的结构相呼应,它具有增大水溶性的羟基结构,也有增大脂溶性的苯环结构,使它能够在脂溶性的体系中保持活性。维生素E是应用在油脂中的良好的抗氧化剂,甜菜红素具有与维生素E类似的酚羟基结构,可能是因为这样的类似结构,甜菜红素的抑制油脂过氧化的能力大大提升。而Vc结构中只含有羟基,不溶于有机溶剂,因此在脂质体系中的抗氧化性降低。
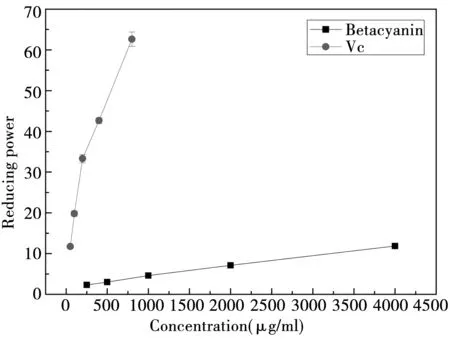
图5 甜菜红素和Vc的还原力
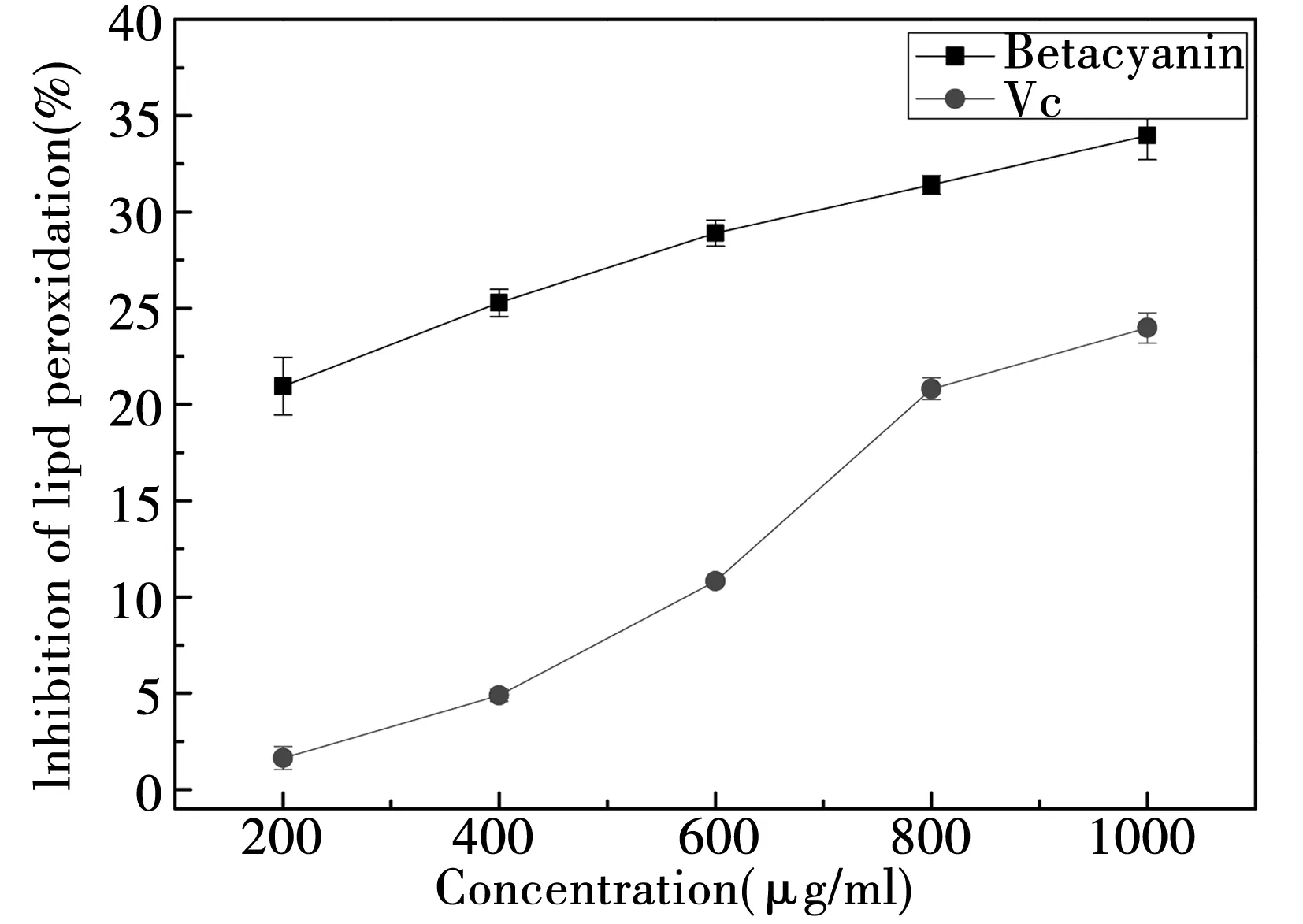
图6 甜菜红素和Vc的抑制脂质过氧化能力
2.1.7 甜菜红素、Vc和槲皮素对HT 29细胞存活率的影响
根据图7可知,甜菜红素的浓度在25~2 500 ug/mL之间,对HT-29细胞没有毒性作用,存活率在100%左右。但是,当甜菜红素的浓度上升到5 000 mg/mL时,细胞的存活率就下降到了62.83%,随着浓度的继续上升,细胞的存活率下降。Vc的浓度在25~100 ug/mL之间时,HT-29细胞存活率在90%以上,超过此浓度的Vc对细胞具有极大的毒性。槲皮素的浓度在25 ug/mL和50 ug/mL时,细胞的存活率在70~80%之间,它对于细胞具有较大的毒性作用。因此选取存活率较高的实验组对应的样品浓度进行下一步实验。
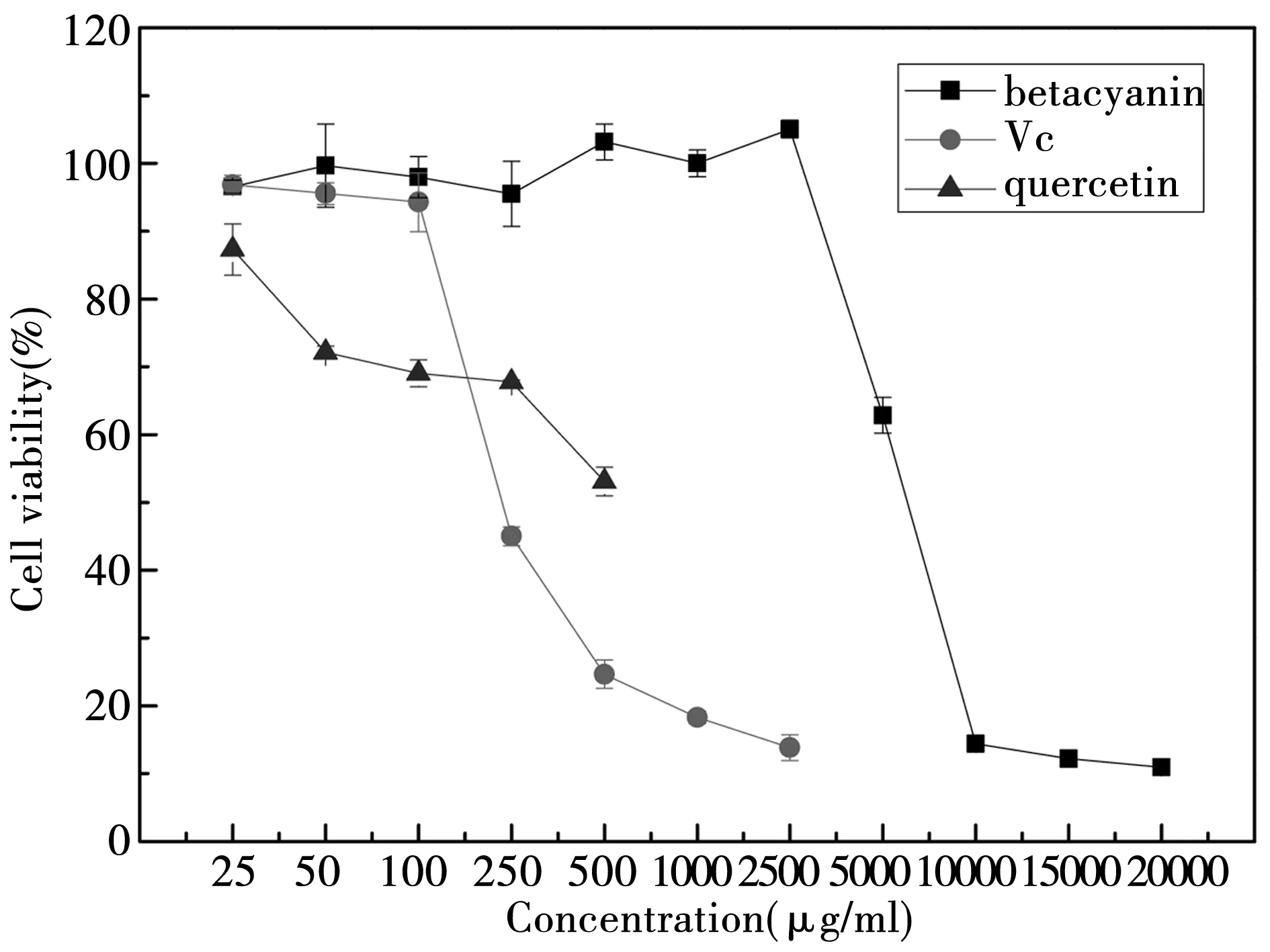
图7 甜菜红素、Vc和槲皮素作用下的的细胞存活率
2.1.8 CAA实验
在CAA实验中,因为槲皮素具有较高的CAA值、稳定、易得等原因,一般采取槲皮素作为标准物,纯物质的CAA值以mmol QE(槲皮素当量)/100 umol化合物表示[21],本实验结果表明,槲皮素对HT29结肠癌细胞的毒性比较大。另外槲皮素的溶解需要DMSO,它不但对细胞具有毒性,而且也会与实验组产生差异,造成干扰。所以采用Vc作为阳性对照物。
图8(a)表明,甜菜红素具有一定的细胞抗氧化活性,在50~1 000 ug/mL的范围内,甜菜红素的细胞抗氧化活性具有剂量相关性,随着甜菜红素浓度的上升,细胞抗氧化能力提高。图8 (b)显示的荧光值低于零,表明Vc具有极强的细胞抗氧化活性。
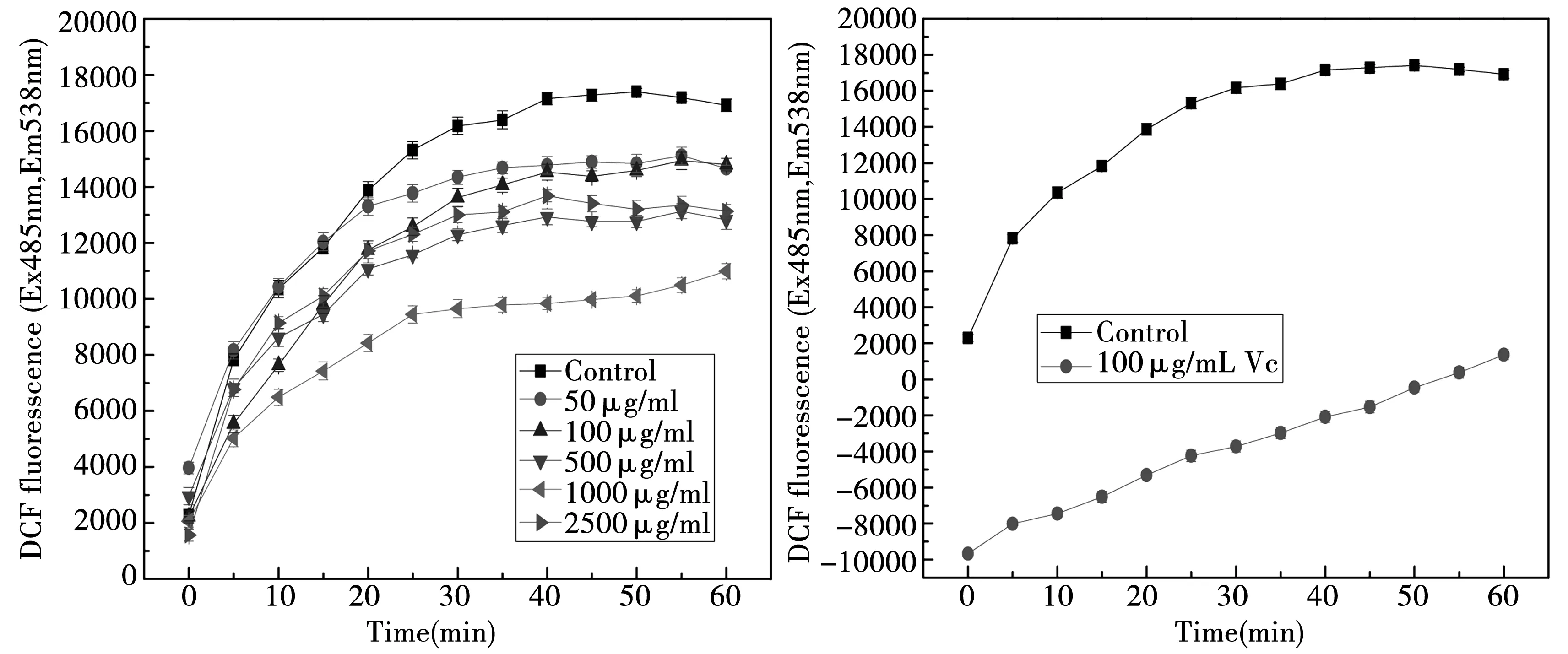
图8 甜菜红素和Vc的细胞抗氧化能力
通过CAA值曲线,可以直观地看出,甜菜红素在50~1 000 ug/mL的范围内,随着浓度的上升,细胞抗氧化性提高。在2 500 ug/mL时,CAA值出现下降,可能是因为甜菜红素浓度过高,充当了氧化剂的作用,导致荧光值上升。CAA实验结合结构分析表明,具有3-羟基、2,3双键结合的4-酮基和3’,4’-二羟基的类黄酮具有较高CAA值[21]。
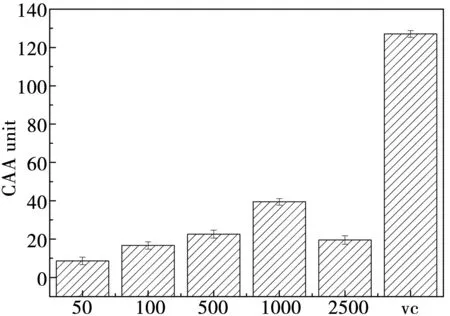
图9 甜菜红素和Vc的细胞抗氧化值
2.1.9 甜菜红素对细胞中抗氧化物质的影响
表6中,控制组的值为:CAT(0.803±0.254)、SOD(15.557±1.392)、MDA(5.882±0.961)和GSH(0.033±0.001)。
表6结果表明,甜菜红素在500~6 750 ug/mL的范围内,甜菜红素与Vc的表现一致,提高了细胞内过氧化物酶和超氧化物歧化酶的水平。在500~2 500 ug/mL的范围内,胞内酶的水平具有剂量依赖性,随着甜菜红素浓度的上升,酶的水平上升。6 750 ug/mL和10 000 ug/mL都是对细胞有毒性的甜菜红素水平,细胞的数量少于前三组,所以酶的水平低于前三组。在500~6 750 ug/mL的情况下,甜菜红素和Vc都提高了细胞中丙二醛的水平,降低了谷胱甘肽的水平,但是,方差分析的结果显示,实验组、阳性对照组和空白组的谷胱甘肽和丙二醛水平没有显著性差异。
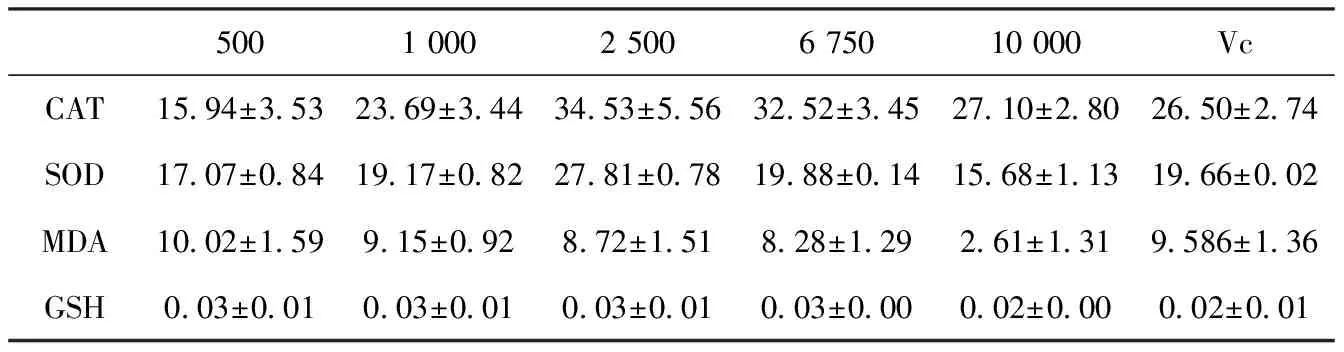
表6 细胞中抗氧化物质的水平
实验结果表明,甜菜红素类似与Vc,具有一定的生物活性,会影响细胞内与氧化相关物质的水平。该实验结果与Jelena J. Vuli′c等人[15]的研究结果相似,都提高了癌细胞中抗氧化相关酶的水平,稍微降低了谷胱甘肽的水平,稍微提高了丙二醛的水平。
谷胱甘肽水平的降低表明甜菜红素和Vc对HT-29细胞造成了轻微的氧化压力,CAT和SOD水平升高也是氧化压力的一个信号。癌细胞中谷胱甘肽的含量在抗氧化防御方面很重要,因为细胞内的谷胱甘肽水平与细胞增殖率、能够引起细胞程序性死亡的细胞生长抑制剂的敏感度直接相关[23]。
SOD是清除超氧阴离子自由基、保护机体抵抗自由基损伤的第一道防线,MDA是自由基攻击脂质发生过氧化反应的最终产物,可引起细胞毒性,破坏细胞膜结构。在较低剂量水平上,甜菜红素不能有效刺激SOD的活性,导致了MDA含量的升高;提高甜菜红素的含量,SOD水平上升,MDA含量下降。在500~2 500 ug/mL的范围内,随着浓度的上升,细胞内SOD的水平和MDA的水平呈现负相关,SOD随着甜菜红素浓度上升而上升,MDA随着浓度上升而有轻微的下降,表明了浓度在2 500 ug/mL时能够最大程度地提高细胞的自身抗氧化能力和降低细胞的氧化压力。
2.1.10 甜菜红素的对细胞氧化伤害的作用
1)不同浓度H2O2溶液对HT 29细胞存活率的影响
根据图10可知,随着过氧化氢浓度的增加,细胞的存活率下降,表明H2O2会影响细胞的生长。在过氧化氢浓度为0.012 5~0.05 mM时,细胞的存活率在80%以上,当过氧化氢浓度上升到0.1 mM时,细胞的存活率下降到50%左右。因此选择0.05 mM为氧化细胞的最佳过氧化氢浓度,能够对细胞造成程度较小的伤害又不会对细胞的生长有太大的影响。
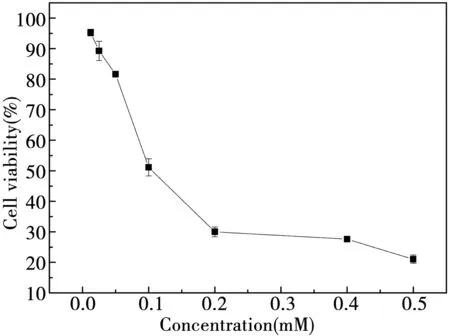
图10 H2O2对细胞存活率的影响
2)甜菜红素对H2O2诱导的氧化损伤的修复、防护作用
H2O2损伤修复组和H2O2损伤防护组中,只用0.05 mM过氧化氢处理的细胞存活率分别为84.75%±3.80%和82.80%±3.37%。从图11可知,甜菜红素浓度在25 ug/mL到2 500 ug/mL之间时,细胞的存活率几乎大于84.75%,只有修复组的最大浓度2 500 ug/mL时,细胞的存活率为81.17%±0.80%。这表明,甜菜红素对H2O2造成的细胞伤害具有防护和修复作用,而且对氧化伤害的防护作用的效果明显,细胞的存活率达到了175.93%±4.35%,表现出一定的促进细胞增长的作用。以细胞存活率在90%以上的Vc浓度进行H2O2诱导伤害的修复、防护实验,Vc组的细胞存活率在72.09%±1.60%~83.33%±3.15%之间,表明Vc对H2O2诱导的伤害没有修复和防护作用。
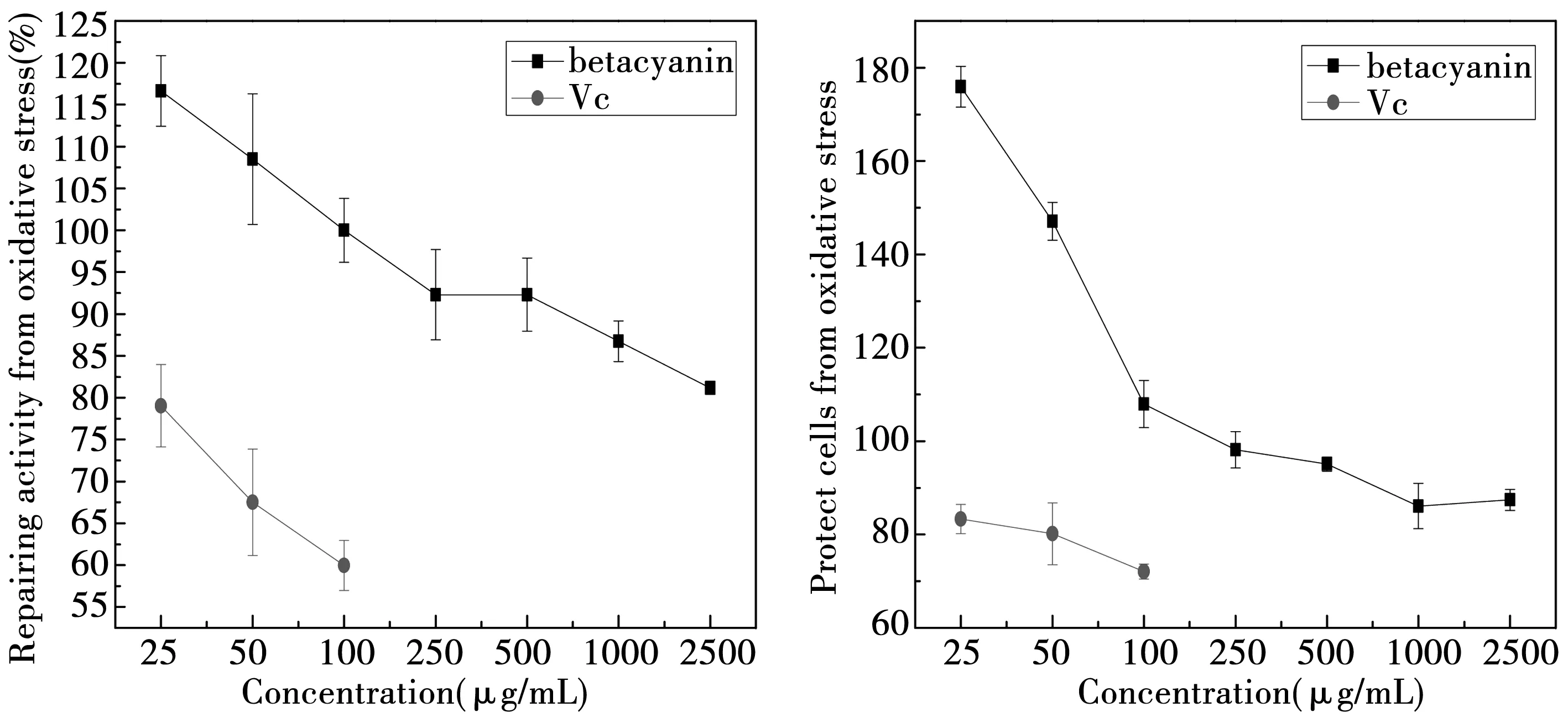
图11 对过氧化氢造成伤害的作用
3 结论
3.1 体外化学抗氧化的结果表明,甜菜红素的清除羟基自由基和抑制脂质过氧化的能力比较强,其中甜菜红素的抑制脂质过氧化的能力强于Vc;清除羟基自由基的能力稍微弱于Vc,在0~400 ug/mL的浓度范围内,甜菜红素和Vc的清除羟基自由基的能力都随着浓度的上升而上升,在800 ug/mL时,两者清除羟基自由基的能力下降,甜菜红素的下降幅度比较大。甜菜红素清除DPPH·自由基的能力比较强,且存在剂量-效应关系,浓度达到4 000 ug/mL时,DPPH·自由基的清除率在0 min就可以达到80%。甜菜红素具有一定的清除超氧自由基、ABTS阳离子自由基的能力和一定的还原能力,都具有剂量效应关系,但是甜菜红素的这三种抗氧化能力都大大弱于Vc,较低浓度的Vc即达到较高的抗氧化能力,同时Vc也具有剂量效应关系。
3.2 MTT实验表明甜菜红素的浓度在25~2 500 ug/mL之间时,对HT-29细胞没有毒性作用,细胞的存活率在100%左右。但是,当甜菜红素的浓度上升到5 000 ug/mL时,细胞的存活率就下降到了62.83%,且随着浓度的继续上升,细胞的存活率下降,阳性对照组Vc在较低浓度时就对细胞有毒性作用。
3.3 利用CAA实验探究甜菜红素的抗氧化活性,发现甜菜红素在50~6 750 ug/mL的浓度范围内,能够清除细胞内的过氧自由基和氧自由基,具有一定的抗氧化活性。检测药物作用后细胞中的过氧化氢酶、超氧化物歧化酶、谷胱甘肽和丙二醛的水平。发现甜菜红素能够提高过氧化氢酶、超氧化物歧化酶和丙二醛的水平,降低了谷胱甘肽的水平,但是谷胱甘肽和丙二醛的变化水平与对照组没有显著性差异。
3.4 利用H2O2对HT-29细胞建立氧化损伤模型,H2O2的浓度为0.05 mM。在25~100 ug/mL的甜菜红素浓度范围内,甜菜红素修复组和甜菜红素防护组的细胞存活率都超过100%。表明甜菜红素对HT-29细胞具有一定的氧化修复和较强的氧化防护作用,而Vc不具备这样的功能。
