艾滋病合并马尔尼菲青霉菌病与艾滋病合并非霍奇金淋巴瘤累及腹部淋巴结的鉴别诊断
2018-07-31章礽荫施裕新李宏军
章礽荫, 叶 雯, 施裕新*, 李宏军
1. 上海市公共卫生临床中心,上海 201508 2. 首都医科大学附属北京佑安医院,北京 100069
艾滋病(acquired immune deficiency syndrome,AIDS)患者存在免疫功能障碍,极易诱发各种机会性感染或并发各种恶性肿瘤。在中国香港和泰国,马尔尼菲青霉菌(penicillium marneffei,PM)是位列结核、隐球菌、肺孢子菌之后的第4位导致AIDS患者死亡的高危感染因素[1-2],可引起马尔尼菲青霉菌病(penicilliosis marneffei,PSM);而非霍奇金淋巴瘤(non-Hodgkin lymphoma,NHL)是最为好发的AIDS相关肿瘤[3]。两者均易引起淋巴结肿大,特别是腹腔淋巴结肿大,且两种疾病的治疗手段完全不同,早期诊断与治疗对于提高机会性感染患者的生存率非常重要。因此,本研究旨在探讨PSM与淋巴瘤累及腹部淋巴结的临床特点及影像学特征表现,以提高其影像学鉴别诊断水平。
1 资料与方法
1.1 一般资料 入选2010年1月至2018年2月上海市公共卫生临床中心确诊为AIDS合并PSM的28例患者及AIDS合并NHL的22例患者。所有患者均知情同意并签署知情同意书。本研究经医院伦理委员会审核批准。
1.2 诊断标准 AIDS诊断标准符合2015年中华医学会感染病学分会AIDS学组制订的AIDS诊疗指南(第3版),所有病例均经上海市或患者籍贯所在省的疾病预防控制中心(CDC)确证为HIV感染。淋巴瘤诊断依据临床手术切除或穿刺组织经病理结果。PSM诊断:血、骨髓、淋巴结穿刺液、痰、肺泡灌洗液等真菌培养出马尔尼菲青霉菌;呈双相真菌,25℃沙保罗培养基培养呈霉菌相,并产生红色素,37℃沙保罗培养基培养呈酵母相。
1.3 观察指标 回顾性分析50例患者的外周血T淋巴细胞计数及腹部影像学表现。影像学图像由2位高年资腹部影像诊断医师共同阅片,意见一致者纳入统计。腹部淋巴结观察内容主要为肿大淋巴结形态和肿大淋巴结解剖分布区域。淋巴结形态包括淋巴结大小、周围有无渗出、淋巴结是否融合。参照文献[4],将肿大淋巴结解剖分布区域分为腹腔内与腹膜后两大区域,前者细分为肝十二指肠韧带(含肝门区)、肝胃韧带(含小网膜囊)、大网膜(含胃结肠韧带)、胃脾韧带(含脾门)、肠系膜分支,后者细分为胰腺周围、肠系膜根部、腹主动脉周围上部及下部(以肠系膜下动脉起始部为界)9个区域。
1.4 统计学处理 采用SPSS 22.0进行统计。所有计量资料(含CD4+T细胞计数绝对值、CD4+T/CD8+T比值、淋巴结最大径)呈非正态分布,两独立样本进行Wilcoxon秩和检验。所有计数资料(含淋巴结周围是否渗出、是否相互融合、淋巴结分布区域)采用χ2检验中的Fisher确切概率法进行比较。检验水准(α)为0.05。
2 结 果
2.1 真菌培养及病理结果 28例AIDS合并PSM患者中共出现真菌培养阳性结果40次,标本来源分别为血液26次、痰培养6次、骨髓2次、胸腹水培养4次、2次淋巴结穿刺活检后培养。AIDS合并NHL患者中,Burkitt淋巴瘤10例,弥漫大B细胞淋巴瘤9例,滤泡型淋巴瘤1例,小B细胞型淋巴瘤1例,浆母细胞型淋巴瘤1例。
2.2 外周血T淋巴细胞计数 AIDS合并PSM患者CD4+T细胞计数绝对值1~140/μL(16.57)、CD4+T/CD8+T比值范围0~0.33(0.057)。AIDS合并NHL患者CD4+T细胞计数绝对值范围6~415 /μL(36.86)、CD4+T/CD8+T比值范围0.02~0.93(0.306)。两组患者差异有统计学意义(P<0.001)。
2.3 腹部淋巴结影像学表现及淋巴结解剖分布 结果(表1)表明:PSM组腹腔淋巴结最大径0.8~3.2 cm,平均2 cm;NHL组腹腔淋巴结最大径1.0~12.2 cm,平均3.5 cm。
NHL组肿大淋巴结融合趋势明显,同一解剖分区内或相邻解剖分区内淋巴结常融合成较大肿块,无法逐一分辨单个淋巴结,而PSM组虽然淋巴结周围容易出现炎性渗出,但融合趋势不明显,同一部位即使存在多发肿大淋巴结,周围渗出或粘连,但仍可分辨每个淋巴结边缘,呈类圆形或椭圆形,尤其于增强扫描时,可见每个肿大淋巴结的边缘(部分为环形强化)。

表1 腹部淋巴结影像学表现 n(%)
PSM组腹腔肿大淋巴结分布范围更广,腹腔内及腹膜后区均可见广泛累及,尤其以肠系膜分支血管周围分布,与NHL组差异有统计学意义;肠系膜根部肿大淋巴结也常见。两者发生率均为96.4%,明显高于NHL组(P<0.001)。肠系膜根部与肠系膜分支血管区域同时出现肿大淋巴结,包绕肠系膜血管,呈“三明治”征表现。而NHL组肿大淋巴结分布更倾向于位于腹膜后区。典型患者影像学表现见图1~图3。

图1 典型患者1影像学表现
患者男,39岁,AIDS合并PSM,腹腔内(A,B)、腹膜后区(A)均可见肿大淋巴结影,淋巴结未见明显融合趋势,肠系膜远端分支(回肠动脉)血管周围(C)亦可见肿大淋巴结
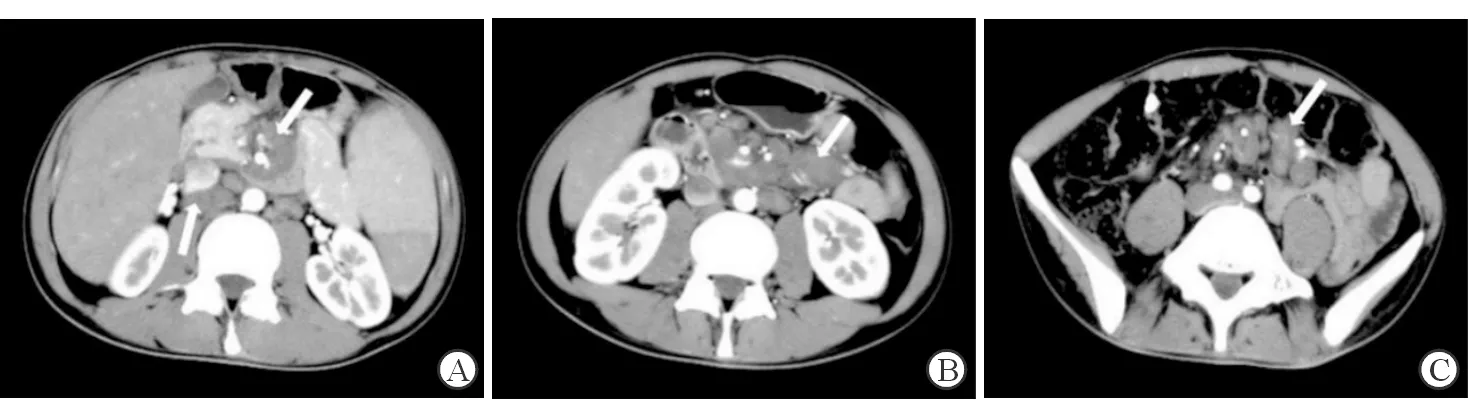
图2 典型患者2影像学表现
患者男,47岁,AIDS合并PSM,肠系膜远端分支血管周围亦可见肿大淋巴结.A:肠系膜上动脉周围;B:空肠动脉周围;C:回肠动脉周围

图3 典型患者3影像学表现
患者男,35岁,AIDS合并NHL,肿大并且融合的淋巴结,其内血管走行正常,未见明显受侵,呈“血管漂浮征” (A),增强扫描呈轻度均匀强化(B),DWI呈明显弥散受限(C)
3 讨 论
3.1 AIDS合并PSM与AIDS合并NHL的流行病学及临床表现异同 AIDS是由HIV病毒感染引起的一种传染性疾病,HIV病毒侵犯人体免疫系统,与CD4+T细胞选择性结合、侵入并在靶细胞内大量繁殖复制,造成CD4+T细胞大量凋亡,当机体的CD4+T细胞被大量消耗时,即出现免疫功能紊乱甚至缺陷,导致一系列机会性感染、恶性肿瘤或多器官损害。研究[5]显示,CD4+T细胞<50/μL的AIDS患者易感染PM;本研究结果与此相似。而AIDS合并NHL的CD4+T细胞水平相对较高,来自英国的研究[6]显示,出现系统性NHL的患者,其中位CD4+T细胞计数大于200/μL。
PSM分为局限性和播散性,AIDS患者由于免疫功能障碍,较常见播散性感染,本组28例AIDS合并PSM病例中,20例为胸腹部广泛播散感染。因此,当临床发现AIDS患者全身感染症状重,CD4+T细胞低下,并且常规抗感染治疗无效时,应考虑PSM的可能性。其他临床研究[7]表明,PSM容易出现特征性皮疹,多发生与头面部、躯干和四肢,典型皮疹为传统性软疣样、中央坏死的脐窝样损害。
NHL是最好发的AIDS相关恶性肿瘤,最常见的亚型为Burkitt淋巴瘤及弥漫大B细胞淋巴瘤[8]。本研究中,22例病例中分别出现10例、9例。NHL的临床表现通常以无痛性、进行性淋巴组织增生,尤以浅表淋巴结为显著,可能并发多样化的皮肤损害,包括肿块、皮下结节、浸润性斑块、溃疡、丘疹、斑疹等,常先见于头颈部,但不会出现类似于PSM的特征性皮肤损害,发热、消瘦等非特异性临床表现与PSM并无鉴别意义。
3.2 AIDS合并PSM与AIDS合并NHL的腹腔淋巴结影像学表现异同 AIDS合并PSM与AIDS合并NHL的腹腔淋巴结解剖分布有显著差异。本研究显示,PSM组腹腔肿大淋巴结分布范围更广,腹腔内及腹膜后区均可见广泛累及,尤其以肠系膜分支血管周围分布,肠系膜根部肿大淋巴结也较常见。而NHL组肿大淋巴结分布更倾向于位于腹膜后区。这可能与不同疾病引起腹部淋巴结肿大的主要因素不同有关。对于感染性疾病而言,受累淋巴结的分布主要取决于病原体的播散路径,而对于肿瘤性疾病而言,受累淋巴结的分布主要依靠淋巴道的解剖决定肿瘤细胞的定植部位。
人类感染PS后,部分病原菌直接经消化道吞咽,或肺部感染后分泌物经消化道二次吞咽,经胃肠道黏膜侵入人体组织。病原菌被吞入后,常在小肠黏膜吸收,相应的淋巴管引流,而引起肝胃韧带(小网膜囊)、肠系膜分支血管周围(空回肠及回盲部)淋巴结炎,并经过肠系膜、肠系膜根部,然后至腹腔动脉周围淋巴结,最终入乳糜池及腹主动脉周围上部淋巴结。因此,肠系膜分布区域的引流淋巴结较后腹膜区淋巴结更容易出现病原菌的定植[4]。
对于淋巴瘤而言,淋巴道的解剖结构是决定受累淋巴结及淋巴器官分布的因素。腹腔成对器官的淋巴管注入腰淋巴结,位于腹膜后壁,沿腹主动脉和下腔静脉分布走行;腹腔不成对器官的淋巴管注入沿腹腔干、肠系膜上动脉和肠系膜下动脉排列分布的淋巴结。胃、肝、胰、脾引流注入位于腹腔干周围的腹腔淋巴结,双肾淋巴液注入腹主动脉周围的腰淋巴结,肠管淋巴液注入肠系膜根部的肠系膜上、下淋巴结。这样的解剖结构决定了结内病变的分布特征,受乳糜注入的淋巴结更容易积累肿瘤细胞,造成肿瘤细胞的恶性定植繁殖。正如本组病例所示,腹主动脉周围、腹腔干周围、肠系膜、肠系膜根部为NHL淋巴结内病变好发部位,而肠系膜分支血管周围的淋巴结肿大并不常见。
除了肿大淋巴结解剖分布趋势外,还应注意受累淋巴结的密度、强化特点、相互融合的方式、与周围血管的关系等方面。AIDS合并NHL的肿大淋巴结更容易相互融合,每个独立肿大淋巴结的边界消失,形成巨大肿块,同时由于细胞密度较高,富含液体的细胞间质成分减少,肿大的淋巴结通常密度与强化比较均匀,MRI的DWI序列呈明显弥散受限表现。而且,淋巴瘤不易直接侵犯周围组织,原有解剖结构存留,所以肿大淋巴结即使融合形成巨大肿块,其内血管仍可完整保留,形成“血管漂浮征”。反之,对于AIDS合并PSM的肿大淋巴结而言,淋巴结周围容易出现炎性渗出或黏连,而融合趋势不明显,即使形成“三明治征”,肠系膜血管周围仍与肿大淋巴结保留间隙(可能为血管周围的炎性水肿组织)。
综上所述,AIDS患者出现腹腔多发肿大淋巴结,综合考虑患者临床表现、实验室检查及影像学表现,可以增加疾病的诊断准确率。CD4+T细胞小于50/μL的患者,并发头面部、躯干和四肢的特征性皮疹,腹腔肿大淋巴结以肠系膜分支血管及肠系膜根部分布为主,肿大淋巴结周围伴炎性渗出但无融合趋势,临床应更倾向于AIDS合并PSM的诊断。
