海湾扇贝精液超低温冷冻保存技术的初步研究*
2018-07-30马培振于瑞海王昭萍李鹏飞
马培振,张 哲,于瑞海,王昭萍**,李鹏飞
(1.海水养殖教育部重点实验室(中国海洋大学),山东 青岛 266003;2.莱州市长渔水产有限公司,山东 烟台 261415)
海湾扇贝(Argopectenirradiansirradians)原产于北美洲大西洋西岸,于1980年代初被引入我国[1],后发展成为主要扇贝养殖品种之一,引领第三次海水养殖浪潮[2]。受长期近交影响,海湾扇贝体现出明显的种质退化、抗病能力减弱、规格减小等不足[3-4],开展杂交育种、三倍体育种和种质提纯复壮[4-7]等遗传改良工作成为大势所趋。随着种间及远缘杂交的进行,如何保存海湾扇贝优良种质、避免种质混乱以及可能引起的种质衰退成为国内水产界和科研界亟需解决的难题。
精子超低温冷冻保存技术研究自20世纪中叶开始以来,在陆地动物、淡水及海水鱼类、海洋贝类等方面均取得较大进展[8-11]。主要冷冻流程包括精子获取、稀释液选取、抗冻保护剂选取、精液稀释或浓缩、降温、解冻、冻精质量评估等,其中,研究多集中于稀释液和抗冻保护剂的选择、降温和解冻方式,以及精子质量评估等[11,15,20]。在海洋贝类中,又以牡蛎的精子冷冻保存研究为多[9,12-14],扇贝相对较少,仅见于虾夷扇贝(Patinopectenyessoensis)[15-16]、栉孔扇贝(Chlamysfarreri)[15,17]、紫扇贝(A.purpuratus)[18]等经济品种,而未有海湾扇贝精子超低温冷冻保存及应用相关报导。精子超低温冷冻技术可以使不同自然繁殖时期和地域的生物,利用冻精的保存或运输进行近缘或远缘杂交,突破季节限制,避免亲本运输,同时避免引种过程中可能带入的其他微生物,可推动贝类的种质和遗传多样性保护,在遗传性状改良等方面具有极高的应用价值。本研究采用传统分步降温法,对海湾扇贝精子超低温冷冻保存技术进行探讨,以期掌握海湾扇贝精子超低温冷冻技术流程与要点,对于海湾扇贝种质资源保存、跨季跨域杂交等研究有指导价值。
1 材料与方法
1.1 材料
海湾扇贝为莱州市长渔水产有限公司蓄养至性腺成熟的一龄亲贝,分别采用自然排放法与人工解剖取精法获取精液。自然排放在盛有洁净升温(23℃)海水的1L烧杯中进行;解剖取精时,首先将扇贝两壳打开,将精巢外表擦拭干净,然后用消毒后的解剖剪剖开精巢表皮,剪取洁净的精块置于少量海水中,搅拌使精子活化并散开。
超低温冷冻保存装置选用YDS-30-125型液氮罐。
1.2 抗冻保护液配制
分别使用二甲基亚砜(DMSO)和甘油(GLY)作为抗冻保护剂。以过滤后升温(23℃)海水为基础稀释液,分别配制浓度为5%、10%、15%、20%和25%的DMSO和2%、4%、6%、8%、10%的GLY,以及5% DMSO和5% GLY的混合溶液作为抗冻保护液。
1.3 精液稀释与分装
分别以抗冻液与精液体积比为1∶1、2∶1、3∶1对精液进行稀释,总体积控制在0.5~1 mL,保存于1.8 mL冻存管中,混匀后,固定坠子,置于4℃平衡5 min。
1.4 降温及投氮保存
测定液氮面深度。体系经平衡后,分别按以下程序进行降温后,投入液氮保存。Ⅰ组:液氮罐罐口处和液氮面上方10 cm处分别停留10 min;Ⅱ组:液氮面上方10 cm处停留5 min;Ⅲ组:液氮面上方20 cm、3 cm处分别停留5 min。
1.5 冻精解冻及质量检测
精液冻存后,分别于20、25、30和35℃的水浴环境中解冻。解冻后,显微镜下采用区域观察法统计精子运动状态,以活化(晃动和游动)精子的百分比评价冻精质量和冷冻效果。分别冷冻1、15和30 d后,取最佳冷冻效果下的解冻精子与虾夷扇贝自然产卵子人工授精,观察胚胎发育状况,统计受精率、卵裂率和孵化率。
2 结果
2.1 精子收集方式对冷冻效果的影响
分别采用自然排精和解剖取精的方法收集精液,与20%DMSO以体积比1∶2混合,经Ⅱ组降温冷冻1d并30℃水浴解冻后,所得精液活力及冷冻后效果见图1。结果显示,2种方式获得的精子,在冷冻前活力均较高,差异不显著(P>0.05);解冻后,自然排放组精子活力为9.0%±3.6%,明显低于解剖取精组(49.3%±7.4%)(P<0.05)。
2.2 抗冻液
解剖取精,与不同的抗冻保护剂以体积比1∶2混合,经Ⅱ组降温冷冻1 d并30℃水浴解冻后,冷冻结果见图2。结果显示,不同的抗冻保护剂对精子冷冻效果的影响有差异。使用DMSO作为抗冻剂,对精子冷冻的保护效果最好,当DMSO浓度为20%时,精子活力最高,达到79.0%;使用GLY作为抗冻剂,精子冷冻效果较差,精子活力最高仅为29.3%,与DMSO的最佳保护效果差异显著(P<0.05)。当DMSO和GLY各5%混合使用作为抗冻保护液时,精子活力达到32.3%,显著优于仅使用GLY作为抗冻保护剂的冷冻效果(P<0.05)。
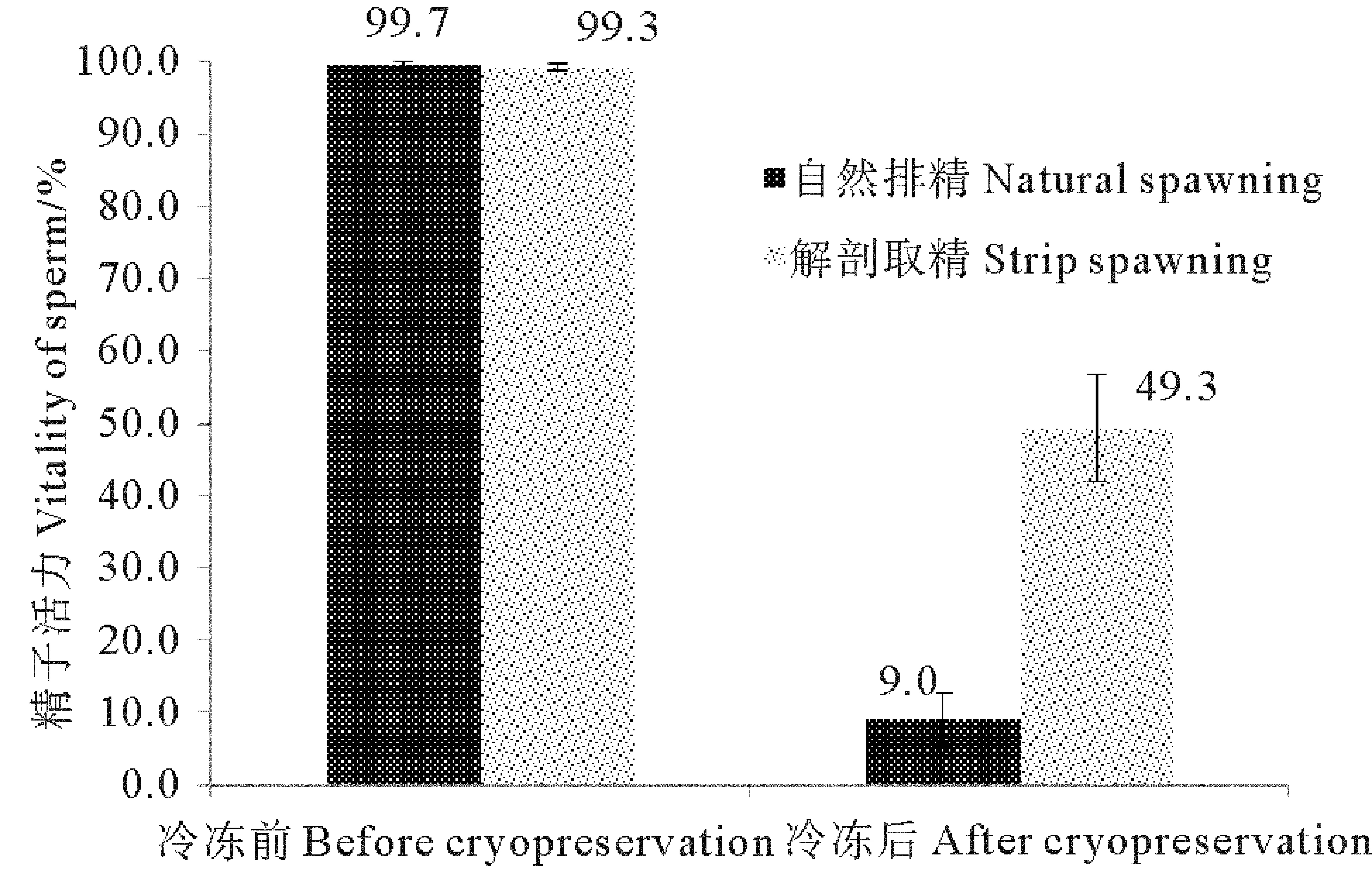
图1 收集方式对精子冷冻效果的影响Fig.1 Effect of collecting methods on sperm cryopreservation
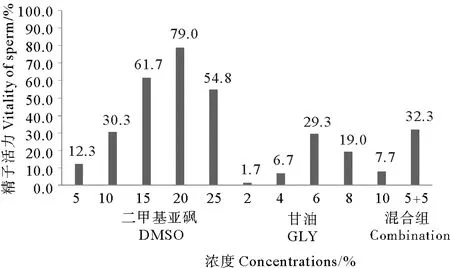
图2 抗冻保护剂对精子冷冻效果的影响Fig.2 Effect of cryoprotectant agent(CPA) on sperm cryopreservation
2.3 精液稀释
解剖取精,与20%DMSO以不同体积比稀释混合,经Ⅱ组降温冷冻1 d并30℃水浴解冻,精子冷冻效果见图3。当体积比为2∶1和3∶1时,冷冻效果均好,精子活力分别达到75.7%±6.0%和71.7%±7.6%,差异不显著(P>0.05);1∶1时,冷冻效果最差,为50.7%。
2.4 降温程序
解剖取精,与20%DMSO以体积比1∶2混合,使用3个不同降温程序,冷冻1d并30℃水浴解冻后,精子冷冻效果见表1,3组差异显著(P<0.05)。当精液在液氮面上10 cm处停留5 min后投入液氮,精子活力最高,达到69.4%±5.3%;精子在液氮罐罐口处(液氮面距罐口25 cm)和液氮面上方10 cm处分别停留10 min,再投入液氮,冻精活力最差,且标准偏差较大,结果不稳定,平均为31.5%;精子在液氮面20和3 cm处分别停留5 min后投入液氮,精子活力能够达到55.0%±6.6%。
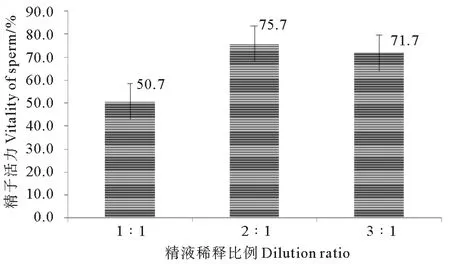
图3 精液稀释比例对精子冷冻效果的影响Fig.3 Effect of dilution ratio of sperm on cryopreservation

表1 降温程序对精子冷冻效果的影响Table 1 Effect of freezing steps on sperm cryopreservation
2.5 解冻水浴温度
解剖取精,与20%DMSO以体积比1∶2混合,经Ⅱ组降温冷冻1 d后,冻精在4种水浴温度下解冻,所得精子活力情况见图4。当水浴温度为30℃时,所得精子活力最高,达到80.7%±7.6%;水浴温度为25℃时,精子活力也较高,为77.0%±7.5%,与水浴温度为30℃时差别不显著(P>0.05);水浴温度为20℃时,精子活力最低,仅为30.3%±5.0%。
2.6 活力检测
以解剖的方式获取海湾扇贝精子,用浓度20%的DMSO作为抗冻保护剂,与精液以2∶1均匀混合,总体积不超过1 mL。4℃平衡5 min后,于液氮面以上10 cm稳定5 min,投入液氮冷冻保存。解冻时,于30℃水浴中摇动融化。此方案得到的冷冻后海湾扇贝精子活力最高,晃动和游动精子比例达到86.0%。将海湾扇贝精子与虾夷扇贝卵子进行人工授精,受精和孵化情况见表2。
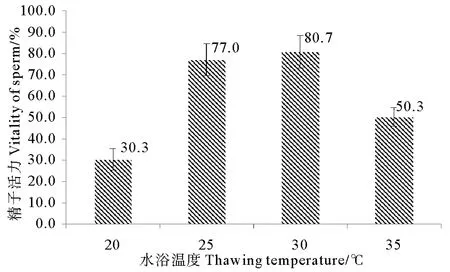
图4 水浴温度对冻精解冻效果的影响Fig.4 Effect of thawing temperature on sperm cryopreservation

表2 海湾扇贝冻精对虾夷扇贝卵子受精孵化的影响Table 2 Results of crossing fertilization by cryopreserved sperm of A.i.irradians
结果显示,无论是解剖精子还是解冻精子均可以使虾夷扇贝卵子受精并孵化。海湾扇贝冻精进行杂交的受精率、卵裂率、孵化率均明显低于对照组(P<0.05);冷冻保存1、15和30 d后的精子在活力、受精率、卵裂率和孵化率方面均差异显著(P<0.05),未呈现规律性。
3 讨论
海洋贝类精子超低温冷冻一般使用分步降温法或程序降温法进行,其中程序降温法借助于程序降温仪,基于电脑程序,按照预设的程序进行降温,对于降温操控较为精确;而分步降温法则具有操作简便、设备要求低[19]等优点,保存效果良好[9],因此应用更为广泛。本研究使用分步降温法,对海湾扇贝精子冷冻技术流程进行探究,完善扇贝精子超低温冷冻保存技术。
贝类精子质量取决于亲贝种质和性腺发育程度,同时受外界环境等因素的影响。获取高质量、高数量的精子是冷冻操作成功的前提。常规精子冷冻方案不适用于稀少精子冷冻[27],而质量较差、活力弱的精子在冷冻和复苏过程中更易导致精子核DNA损伤,影响冻存后生理功能[28]。解剖取精方式在牡蛎[12-14,20-21]、珍珠贝[22-23]等贝类的精子超低温冷冻中应用广泛,而扇贝中主要以自然排放的方式获取精液[15-17]。然而,自然排放的精液易受排泄物、组织粘液等污染,同时精子浓度较小、浓缩困难[24],对精子冷冻保存效果造成影响。本研究发现,对海湾扇贝性腺成熟个体解剖取精,精子浓度高、活力良好,且解冻后精子活力优于自然排放后的冻存精子,这可能是由于研究中自然排放的精子浓度较低、精子长时间激活而能量损耗严重等原因导致的[14,16,27]。
精子在超低温冷冻过程中,胞内产生的过量活性氧和大冰晶易对精子核DNA、膜结构以及顶体酶活性造成不可逆转的损伤[28-29]。抗冻保护剂能够控制水分渗透速度从而稳定细胞膜结构[30],并且能够保护精子DNA免受损伤[28]。因此,选择合适的抗冻保护剂和稀释液是精子冷冻保存成败的关键[29]。DMSO作为最常用的渗透性抗冻保护剂,在很多物种的精子冷冻操作中最适浓度相差不大[9,31]。研究发现,在以分步降温法进行扇贝精子超低温冷冻的实验中(见表3)[15-16],DMSO均为最佳的抗冻保护剂,终浓度范围均为10%~20%,体现出DMSO在不同扇贝中适用的普遍性。GLY对精子冻存有一定保护作用,且作用浓度较低,但单一使用时效果不佳,可用作抗冻添加剂,与DMSO共同使用以增强保护效果,这与丁兆坤[31]的结果一致。

表3 不同扇贝分步降温法精子超低温冷冻的比较Table 3 Comparison of sperm cryopreservation by freezing by steps among different scallops
注:降温程序*: 为于液氮面上方一定距离停留的时间。
Note: Distance above liquid nitrogen surface are shown here with time marked in brackets.
降温速度影响精子细胞内水分的渗出速率,选择合理的降温程序,可以控制胞内冰晶形成与渗透压升高的平衡,将精子的损伤降至最低水平[9,17]。分步降温法即通过控制样品在液氮面上方的高度和时间,从而控制降温速度,并最终转入液氮保存。该法虽不能获取确切的降温参数,但可大批量冻存精子,冷冻效果较好。本研究中,当海湾扇贝精液在液氮面上10 cm处停留5 min后投入液氮,精子活力最高。研究发现,冻存体系的解冻速率也会影响精子活力。不同扇贝精子解冻的最适水浴温度有差异(见表3),但尚未有解冻水浴温度与物种生物学相关性的研究[9]。
冻精质量检测的常用方法有活动精子比率、受精率、精子结构检测等[9],本研究中综合活动精子比率和受精率来判定冻精质量。海湾扇贝为雌雄同体,采用过滤或淡水消毒法等难以收集到未受精的纯净卵子,而解剖获得的卵子在生理上不成熟,不能直接受精或者受精率极低[26],因此本研究选择工厂化育苗过程中与海湾扇贝苗种生产季节有一定时间重合的虾夷扇贝自然排放的卵子与海湾扇贝冻精进行授精以评估冻精质量,该方法简单、可行,效果良好。然而,由于两者配子兼容性有限,虾夷扇贝卵子与海湾扇贝正常精子杂交的受精率、卵裂率、孵化率均较低[32],而使用海湾扇贝冻精时受精率、卵裂率、孵化率更低,体现出冷冻操作对精子结构或能量的损伤作用。
精子冷冻保存作为种质资源保护的重要手段,在陆生动物和海洋动物中均有十分重要的科研和实际应用价值[9, 12]。本研究发现,海湾扇贝冻精复苏后的生理功能和活力与保存时间没有显著关联,证实了液氮超低温保存的稳定性以及分步降温法进行精子冷冻以长期保存的可行性,对于生物精子库的建立和完善具有较大的推动作用。
4 结语
本文采用分步降温法对海湾扇贝解剖精子进行超低温冷冻保存,开发冷冻方法和流程。以升温的自然海水(23 ℃)为基础稀释液,以终浓度13.3%的二甲基亚砜为抗冻保护剂,体系经4℃平衡和液氮面以上10 cm稳定5 min后,投入液氮冷冻,可长期保存。解冻时,于30 ℃水浴中摇动融化。此方案对海湾扇贝精子超低温冷冻保存效果最好,可得到具有良好活力和生理功能的精子。使用虾夷扇贝卵子检验海湾扇贝精子超低温冷冻保存效果,方法简单、可行。本研究为海湾扇贝种质资源保存、跨季杂交育种等实践活动提供了参考。但是,扇贝精子超低温冷冻领域研究较少,品种偏少、技术流程尚不完善,如何优化冷冻流程以获得更高活力和生理功能的冻精,从而发挥海洋贝类精子库的作用、解决实践应用等问题仍是当前种质资源保护的主要难题。
