一个响应土壤缺铁拟南芥突变体的分离及鉴定①
2018-07-27王立赛闫明科沈仁芳
王立赛,闫明科,王 晗,沈仁芳,兰 平*
一个响应土壤缺铁拟南芥突变体的分离及鉴定①
王立赛1,2,闫明科1,2,王 晗1,沈仁芳1,兰 平1*
(1土壤与农业可持续发展国家重点实验室(中国科学院南京土壤研究所),南京 210008;2中国科学院大学,北京 100049)
铁是植物生长发育必需的一种微量元素,但土壤中植物可直接吸收利用的铁非常有限。缺铁使作物生长受限,进而影响人类膳食健康。植物体能通过调节一系列基因表达的变化来响应缺铁,但目前对该调控系统的研究仍不完善。()是拟南芥中一个强烈响应缺铁的基因,本研究将该基因启动子连接荧光素酶报告基因并转化拟南芥,进一步通过T-DNA的随机插入得到一个响应缺铁信号的突变体库。通过筛选该突变体库,我们得到一个强烈响应缺铁信号的突变体L22-8。和野生型相比,正常情况下L22-8地上部和地下部内源的表达量均显著增高,缺铁处理时其地上部表达量仍高于野生型,而地下部则不明显。定量结果显示,和等植物铁代谢关键调控因子的表达发生了显著变化,但植株总铁、磷、锌的含量较野生型并没有显著区别,表明该T-DNA的插入虽影响了植株对缺铁胁迫的响应,但并不直接作用于植株对铁的吸收、转运上。反向PCR分析发现L22-8的T-DNA插入位点位于和之间,且这两个基因的转录表达在正常生长条件下均略低于Col-0。基因互补实验发现仅有能部分互补L22-8的荧光信号,表明基因的表达影响了对缺铁胁迫的响应。本研究进一步扩展了植物吸收利用铁的分子调控网络,为分子育种工作提供了指导。
土壤;缺铁胁迫;突变体鉴定;分子调控
铁是动植物生长必需的、需求量最大的微量营养元素[1],在高等植物的光合作用和呼吸作用等多种生命活动中起非常重要的作用[2],同时也是许多功能蛋白的重要辅助因子[3]。植物缺铁会导致作物产量和品质的降低,危害人体的营养健康,如人体贫血的一个常见原因就是铁元素的缺乏。虽然铁在地壳中的含量丰富,但因为铁元素大多以Fe3+的形式存在,在中性和碱性土壤中的溶解度极低,从而限制了土壤中铁的有效性,使得植物生长易受缺铁的限制[4-5],随着土壤盐碱化程度加剧,植物缺铁现象愈发普遍。因此,阐明植物体内铁平衡机制、通过育种工作提高植物体内铁含量有益于促进农业发展和人体健康[6-7]。植物在长期的进化过程中,演化出一套完整的铁吸收、转运的分子调节系统。根据植物对铁吸收机制的不同,分为两大类:非禾本科植物所采用的机理Ⅰ,及禾本科植物所采用的机理Ⅱ[8]。其中机理Ⅰ又可分为3个组成部分,即H+-ATPase泵系统、Fe3+还原系统和Fe2+转运系统。一些H+-ATPase(HA)基因,如拟南芥中的基因的表达,能通过H+-ATPase作用将H+分泌到质外体[9]。功能缺失突变体的分析发现是引起缺铁诱导根际酸化的主要成员[10]。H+的分泌可以降低土壤pH,提高土壤中铁等营养元素的溶解性[11],通过根细胞质膜上的铁离子螯合还原酶(ferric-chelate reductase oxidase,FRO)和与之偶联的NADPH脱氢酶,如拟南芥中的Fe3+螯合还原酶将Fe3+还原为Fe2+[12],再通过一系列铁转运蛋白(iron-regulated transporter,IRT),如拟南芥中的IRT1将还原的Fe2+转运到细胞内[13],之后通过其他的一些转运载体运送到植物各个细胞器或器官中供机体利用。采用机理Ⅱ的禾本科植物可在根部合成高铁载体(Phytosiderophores,PS)如麦根酸类物质(mugineic acid, MA)并分泌到土壤中,这类物质对Fe3+具有很高的亲和性,可以促进低铁环境下根际铁的活化。Fe3+-PS螯合物经YS1(YELLOW STRIPE 1)和YSL(YELLOW STRIPE1-like)转运载体吸收至胞内,再释放出Fe3+供代谢利用[14]。
近年来的转录组和分子遗传学分析鉴定得到了一系列与植物铁吸收利用相关的基因和蛋白,如非禾本科植物铁吸收的重要调控基因和。首次在番茄中被鉴定出来,其编码一个bHLH转录调控因子[15];当环境中铁浓度过低时表达增强,过高时则在转录后水平上受到抑制[16]。拟南芥中的(FER-like iron deficiency-induced transcription factor)是番茄基因的同源基因,主要在根部受缺铁胁迫诱导表达,且只在缺铁胁迫下,才能激发上下游基因的相互作用[7]。FIT可以与bHLH蛋白家族(AtbHLH38、AtbHLH39、AtbHLH100、AtbHLH101)形成异源二聚体,有效诱导和基因的表达,从而提高植物对缺铁胁迫的耐受性[17-18]。有研究证实,bHLH转录调控因子ROREYE(PYE)在缺铁条件下对根的生长起重要作用,PYE负调控植物体内铁平衡相关基因的表达[19]。bHLH34、bHLH104与bHLH105能够形成同源二聚体或异源二聚体,激活和的转录表达,进而激活下游铁吸收及转运相关基因的表达,bHLH104与bHLH105可与铁吸收负调控因子E3泛素连接酶BTS相互作用,以此防止植物对铁的过量吸收[6,20-21]。虽然前期研究已经得到了FIT等众多铁代谢相关的调控基因和蛋白,但仍有很多响应土壤铁含量变化的基因功能未被阐明,特别是一些用来维持植物体内铁稳态的负调控因子,仍需进一步探索[3,7,14]。
编码细胞色素P450 (CYTOCHROMEP450)蛋白,能够强烈响应缺铁胁迫。细胞色素P450基因家族成员、()、()均属缺铁胁迫上调基因,且拟南芥基因在缺铁胁迫下响应最为强烈,有研究表明基因通过其启动子部位的IDE1-like序列(iron deficiency-responsive element)响应铁缺乏的早期反应[22]。为寻找到更多早期响应缺铁胁迫的调控因子,本文以模式植物拟南芥为研究材料,首先分离出基因的启动子,再连接报告基因,构建成pCAMBIA2300-::基因表达载体,通过转化拟南芥得到T-DNA随机插入突变体库,然后通过确定突变体的T-DNA插入位点,找到影响基因转录表达的上游基因。探索可能存在的调控基因表达的新的调控因子,并探讨新调控因子的基因功能。旨在完善植物缺铁响应的分子调控网络,并为促进植物高效利用土壤中铁元素打下理论基础。
1 材料与方法
1.1 植物材料与突变体库的建立
供试材料为拟南芥(L.) Columia -0生态型(Col-0)。以拟南芥Col-0基因组DNA为模板,扩增目的基因启动子(1149bp),所用引物:F:5’- AAGGTTTTCTCTGATTGGAAATTG-3’, R:5’-ACGCGATTGAAGAGTAGTGTCTGTC-3’,两条引物5’ 端分别带有Ⅰ与Ⅰ酶切位点。如图1,PCR产物经酶切后连接pCAMBIA2300-载体,构成目的基因表达载体pCAMBIA2300-::。实验中所用酶均为Thermo Scientific产品。

图1 载体构建
通过农杆菌转化法得转基因株系,抗性(卡那霉素,Kanamycin)筛选得到单拷贝纯合株系,通过荧光观察从中选取一到两株符合缺铁表达特性的稳定表达株系作为母本,再次进行T-DNA插入突变,筛选过程中寻找特殊荧光变化的株系,构建突变体库。
1.2 材料处理与方法
1.2.1 种子处理及培养条件 拟南芥种子表面消毒:首先使用75% 酒精洗涤2 ~ 3 min;再经 Tween (0.5%,/),NaClO (0.5%,/)的混合水溶液震荡洗涤10 min,最后使用灭菌超纯水洗5 ~ 6遍。播种前4 ℃春化1 ~ 2 d,根据不同实验项目播种到正常或缺铁培养基上,生长于恒温培养箱中(22 ℃,60 µmol/(m2·s),16 h光照,8 h黑暗)。正常及缺铁处理培养基:ES培养基(5 mmol/L KNO3, 2 mmol/L Ca(NO3)2, 2 mmol/L MgSO4, 2.5 mmol/L KH2PO4, 70 µmol/L H3BO3, 14 µmol/L MnCl2, 0.2 µmol/L Na2MoO4, 1 µmol/L ZnSO4, 0.5 µmol/L CuSO4, 10 µmol/L NaCl, 40 µmol/L Fe-EDTA,10 g/L蔗糖,0.918 g/L MES,8 g/L琼脂,用1 mmol/L NaOH 调节pH 至5.5;缺铁处理(即ES培养基中除不添加Fe-EDTA,添加100 µmol/L Ferrozine螯合培养基中的多余铁元素,其他均一致),121 °C高温灭菌20 min。种子抗性筛选培养基用1/2MS(Duchefa Biochemie公司)+ Kanamycin (50 mg/L)。
1.2.2 荧光检测及筛选 将在正常培养基上生长10 d的拟南芥幼苗分别转移至正常和缺铁培养基表面继续培养3 d,均匀喷洒荧光底物D-Luciferin(1 mmol/L D-Luciferin+0.01% TritonX-100)处理3 min后,通过化学发光仪(Tanon-5200,中国)拍摄荧光信号。
1.2.3 转录水平基因表达量检测 将在正常培养基上生长10 d的拟南芥幼苗移至正常和缺铁培养基上继续生长3 d,地上部与地下部分开取材。用Trizol法提取样品RNA,并使用Nanodrop2000及电泳检测RNA浓度及质量。采用PrimeScript RT reagent Kit (TaKaRa) 将RNA反转为cDNA,用于基因转录表达的半定量及定量检测。用TaqMix酶(康维)进行半定量的PCR扩增检测,用实时定量PCR仪(Thermo PIKOREAL96)对基因表达进行定量检测,内参基因选用(),基因相对表达量用2-△△Ct公式计算。半定量、定量检测所需引物:-RT-S: 5’-CCAGCTAACGACATCTACAACG-3’,-RT-A: 5’-GTAGTCGGTCTTGCTATCCATG-3’;-F: 5’- GTGCTGAAGGTGGAGACGAT-3’,-R: 5’- AACACGAAGACCGAACGAAT-3’。同时将,,,作为缺铁处理的标记基因。
1.2.4 甲基化分析 通过在线甲基化分析及引物设计软件(MethPrimer)分析插入T-DNA片段最可能发生甲基化的片段并设计引物。取正常培养基上生长10 d的Col-0及L22-8拟南芥幼苗用CTAB法提取DNA,经甲基化变性试剂盒EZDNA Methylation-Gold kit对Col-0和L22-8基因组DNA进行亚硫酸氢盐变性,并用软件设计的引物扩增。扩增条带经凝胶回收(Axygen AxyPrep DNA Gel Extraction Kit)后连接pEASY-Blunt Zero克隆载体,分别取Col-0和L22-8的6个克隆进行测序分析。引物序列:-Fb:5’-TTTAATTTTAAAAGTTTAATATTGGTGA-3’,-Rb: 5’-CAAAATCCATACATAAACTACTTTTT-3’。
1.2.5 插入位点的鉴定 根据pCAMBIA2300载体选取EcoRⅠ与EcoRⅤ同时酶切Col-0与L22-8株系DNA,通过T4连接酶将酶切片段连接成环,在pCAMBIA2300载体上设计引物扩增环状DNA片段得L22-8特异条带,扩增引物:p2300-LB-S:5’- TGCCTCGTCCTGGAGTTCAT-3’,p2300-LB-A:5’- AGCGTTGGCTACCCGTGATA-3’。胶回收(Axygen AxyPrep DNA Gel Extraction Kit)目标片段连接到pEASY-Blunt Zero克隆载体,测序后比对确定T-DNA插入位点。
1.2.6 植物总磷、总铁、总锌含量测定 将在正常培养基上生长21 d的拟南芥幼苗转移至正常及缺铁培养基继续生长5 d,取地上部,105 ℃杀青30 min,70 ℃烘干至恒重,用HNO3-H2O2消煮[23]至澄清的消解液,用电感耦合等离子发射光谱仪(ICP)对P、Fe、Zn元素含量进行检测。总共进行3个生物学重复。
1.2.7 数据处理 应用Excel 2007进行数据的处理并统计分析,TTEST检测以<0.01为极显著差异,用“**”表示,以<0.05为显著差异,用“*”表示。图表用Origin 8.0生成。
2 结果与分析
2.1 L22-8的发现及检测
在转基因筛选单拷贝纯合株系过程中发现突变体L22-8。如图2A显示,L22-8表现为在正常生长条件下荧光信号强烈高于其他纯合株系(如L10-9等)。进一步分析发现,L22-8在缺铁处理下虽然仍会被强烈诱导,但无论在正常生长条件下还是缺铁处理下L22-8荧光信号均强烈高于L10-9(图2B)。半定量检测结果表明,外源基因转录表达在正常和缺铁处理下的地上部与正常生长条件下的地下部均明显高于L10-9(图2C)。
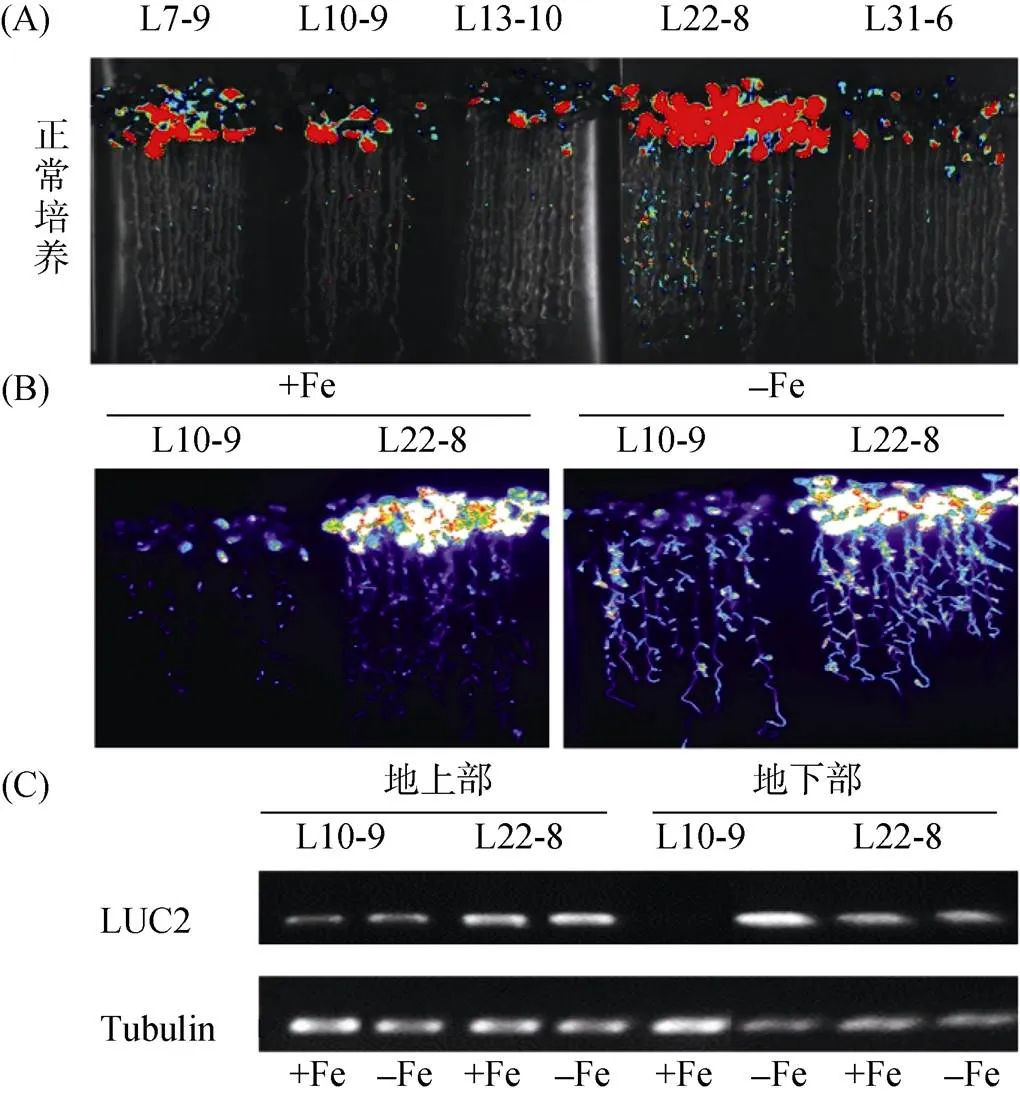
图2 突变体的获得及进一步验证
2.2 突变体内源基因CYP82C4的表达差异
为确定突变体L22-8内源基因是否发生变化,我们使用实时定量PCR对转录表达进行了检测。图3显示,地下部基因的表达量表现为,正常生长条件下,L22-8高于Col-0,但缺铁处理下,L22-8与Col-0没有表现出显著差异。地上部基因的表达量表现为,无论正常生长条件下还是缺铁处理下,L22-8均显著高于Col-0。
2.3 几种响应缺铁胁迫标记基因的定量检测
为确定缺铁响应标记基因的表达在L22-8中是否发生改变,通过实时定量PCR方法对植株地下部几种响应铁缺乏主要的标记基因的转录表达进行了检测。结果如图4显示,突变体L22-8缺铁处理下的表达量明显高于Col-0,而在缺铁处理条件下受调控的铁吸收相关Marker基因与在L22-8中的表达量没有发生显著差异。在正常生长条件下,L22-8中与的表达量均没有表现出与Col-0的显著不同,仅的表达量略高于Col-0。但无论在正常生长条件还是缺铁处理下,L22-8株系中与互作的转录因子和的表达量,均明显高于Col-0。
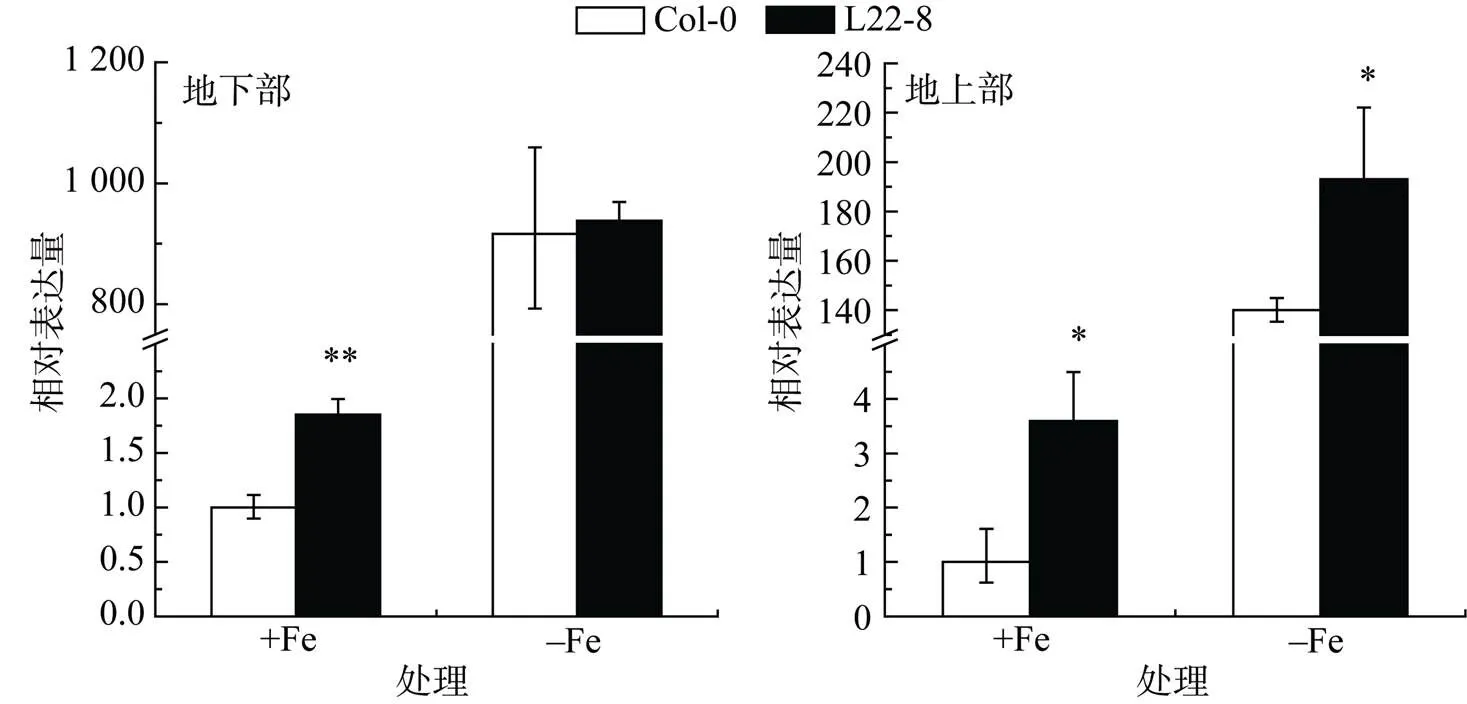
(*,** 代表t-test检验的显著性差异,*:P<0.05,**:P<0.01,下同)

图4 Fe Marker基因的检测
2.4 突变体P、Fe、Zn元素的测定
L22-8株系基因及响应缺铁胁迫标记基因表达量的改变可能影响植株对铁元素的吸收及积累。因为P、Zn元素对Fe元素起拮抗作用,我们同时对L22-8及Col-0地上部总Fe、总P、总Zn含量进行了测定。如图5结果表明,无论在正常生长条件下还是缺铁处理下,突变体L22-8株系的总Fe、P、Zn含量与野生型相比均没有表现出显著性差异,说明突变体虽影响了某些响应缺铁胁迫基因的表达,但并不影响植株对环境中铁元素的积累。
2.5 甲基化对荧光信号的影响分析
从前面的研究结果得知,L22-8虽影响到内源基因及几种铁响应Marker基因的转录表达,但在元素测定上并未表现出差异,而DNA甲基化对基因的表达起到一定调控作用[24]。为确定L22-8荧光信号的变化是否与T-DNA中基因启动子的甲基化改变有关,我们对该启动子序列进行了甲基化分析。图6测序比对结果表明,在软件分析的可能发生甲基化的5个CpG位点中,L22-8基本与Col-0测序结果一致,均未发现有甲基化发生。表明,L22-8荧光信号的增强不是由甲基化变化导致。
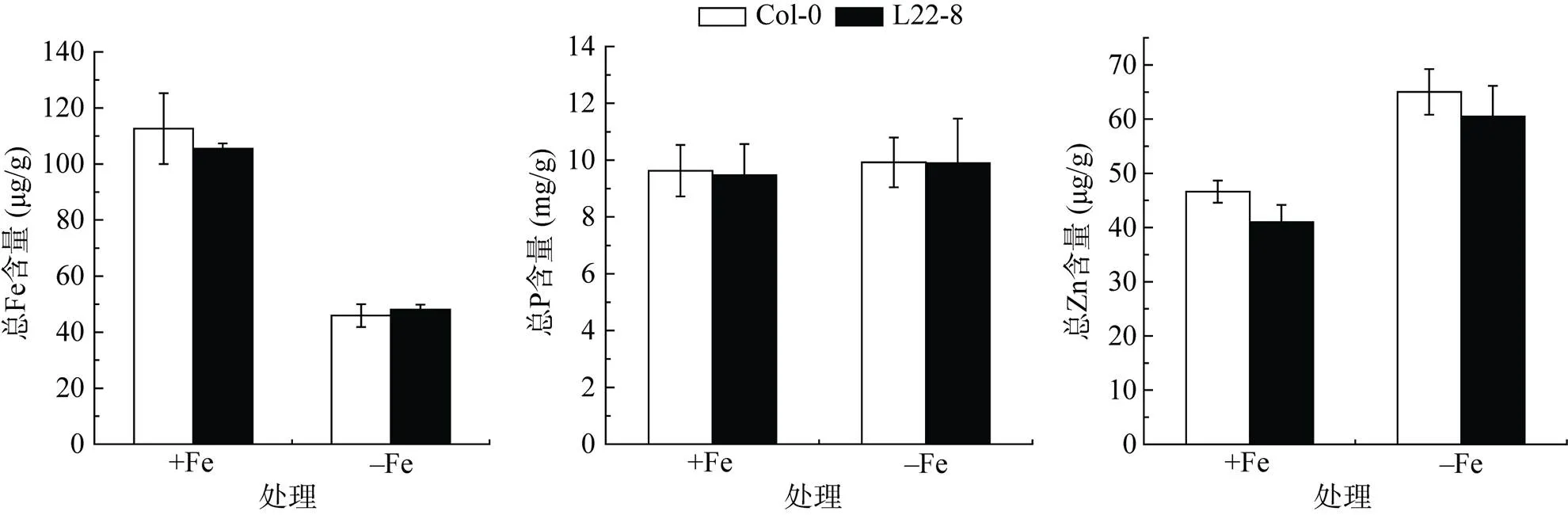
图5 总Fe、P、Zn元素含量检测

图6 甲基化分析
2.6 突变体L22-8株系T-DNA插入位点的鉴定及相关基因表达检测
运用反向PCR方法,鉴定了突变体L22-8株系的T-DNA插入位点。图7A显示,T-DNA插入于和之间。为了确定T-DNA插入是否影响到侧翼基因的转录表达,对侧翼基因的表达进行了实时定量PCR检测。图7B显示,正常生长情况下L22-8的和两个基因的表达量显著降低,而缺铁处理下未发生显著性改变,且发现两个基因均不响应缺铁胁迫。
2.7 互补实验纯合株系的获得与荧光检测
为确定导致L22-8荧光信号变化的基因,分别转化L22-8获得两个基因的单拷贝纯合互补株系,记为L5-1~6、L6-1~6,并进行荧光检测。结果如图8所示,基因的多数互补株系荧光信号强烈,表明该基因未产生互补作用;基因互补株系的荧光信号明显弱于L22-8株系,起到部分互补作用。表明L22-8株系可能通过影响侧翼基因的作用进而影响到目标基因的表达。

图8 正常生长条件下侧翼基因互补株系的荧光检测
3 讨论
为促进植物对土壤中铁元素的吸收、利用,近年已实践应用了多种措施,如新的铁螯合剂的使用,不同耕作措施的实施及基因改造等[22]。植物铁调控机制的研究表明,除了众多缺铁响应基因参与植物铁平衡调控外,许多调控植物生长的信号分子也参与调控缺铁过程,如:乙烯、NO、生长素、茉莉酸等[25-28],植物体内拥有一个十分复杂的铁平衡调控网络。尽管我们已经在植物铁吸收、运输等分子机制方面取得重要的进展,但植物体内应该存在有新的调控因子并需要我们的探索,特别是负调控因子的探索。例如虽然我们已知FIT是正调控缺铁胁迫的核心调控因子,但受FIT调控响应缺铁胁迫的基因仅占众多铁响应基因的一部分[7,29],仍有很多铁响应基因的调控因子尚不清晰。
本文通过分离基因的启动子,再连接报告基因构成基因的表达载体pCAMBIA2300-::以转化拟南芥,进而通过T-DNA随机插入得到了一个响应缺铁信号的拟南芥突变体库;通过筛选突变体库我们得到了一个强烈响应缺铁信号的株系L22-8;根据对突变体T-DNA插入位点的确定,进一步探讨影响基因表达可能存在的新的调控因子。通过筛选突变体找到突变基因并进行基因功能研究的正向遗传学方法是将表型与其潜在的基因联系起来的最成功的策略之一[30],是发现基因、研究基因功能非常有效的手段。而T-DNA插入突变筛选突变体库的方法,因其T-DNA序列已知,具有插入突变体易定位的优点,且带有报告基因的T-DNA则更易筛选检测[31]。2016年Shinde等[32]研究中就运用正向遗传学方法筛选突变体,用作为报告基因,取得良好的研究结果,亦适用于本研究。本研究通过筛选T-DNA插入突变体库,发现了突变体L22-8,并证明由于T-DNA的插入影响了目标基因的表达,使得L22-8在正常生长条件下就表现出缺铁反应,且在缺铁处理条件下发现L22-8地下部基因的表达量未发生变化,但地上部的表达量却显著高于Col-0。我们推测这可能是因为缺铁处理下在地下部的本底表达量就已经很高,使得地下部未表现出差异,而在表达量变化较低的地上部则能表现出显著性差异,或可能由于T-DNA的插入影响了L22-8的地下部对缺铁胁迫的部分响应,降低了变化幅度。此外,通过实验证明由于T-DNA的插入影响了几种关键缺铁响应标记基因的转录表达,如和等。而FIT可与AtbHLH38、AtbHLH39等形成异源二聚体,有效地诱导和基因的表达[17-18],由本研究结果推测基因可能在bHLH38、bHLH39与FIT形成异源二聚体的过程中发挥作用,参与调控因子之间的信号传导。研究结果分析得知L22-8株系中受FIT调控的下游铁吸收相关基因与的表达量并没有表现出明显的不同,仅正常生长条件下L22-8的表达量表现为略高于Col-0。地上部总铁含量与野生型没有显著差异,暗示基因组中可能存在的互作基因,共同参与对缺铁胁迫的调控。结合已有的研究结果[20]进一步证明,基因并不是响应缺铁胁迫的关键基因,这也是本研究中并未发现L22-8出现显著异常表型的原因之一。转基因互补实验证明侧翼基因对L22-8株系的荧光信号起到一定的互补作用,影响到基因的表达。基因又名,属BZIP家族,在盐胁迫环境中会被诱导表达。BZIP家族中BZIP19、BZIP23与BZIP24同属BZIP家族中的F组,启动子具有相同的结构域[33]。有研究表明、基因在响应缺锌胁迫时会显著被诱导,但未发现对缺锌胁迫的明显响应[34]。缺铁时植物通过提高的表达间接性增强植株对Zn的积累,过量的Zn会导致植株的生理性Fe缺乏[35-36]。本研究结果表明,基因组中可能存在的互作基因影响了其对缺锌胁迫的响应,而锌信号的变化导致基因表达发生变化,从而间接对响应缺铁胁迫造成影响,即其并不直接对基因响应缺铁胁迫起上游调控作用。这可能导致了研究结果中L22-8插入位点虽影响了侧翼基因的表达,但侧翼基因在实验中的培养时间内对缺铁胁迫并没有明显响应的现象。
综上所述,我们筛选到了一个强烈响应缺铁信号的突变体L22-8,并进一步分析发现,可能是T-DNA的插入导致锌信号响应基因的表达发生变化,而进一步引起L22-8对缺铁信号的响应,但具体的作用方式和机制还需后续实验进一步探索。
[1] 周晓今, 陈茹梅, 范云六. 植物对铁元素吸收、运输和储存的分子机制[J]. 作物研究, 2012, 26: 605-610
[2] Saleeba J A, Guerinot M L. Induction of ferric reductase activity in response to iron deficiency in[J].Biometals, 1995, 8: 297-300
[3] Kobayashi T, Nishizawa N K. Iron uptake, translocation,and regulation in higher plants[J]. Annual Review of Plant Biology, 2012, 63: 131-152
[4] 吴慧兰, 王宁, 凌宏清. 植物铁吸收、转运和调控的分子机制研究进展[J]. 植物学通报, 2007, 24(6): 779-788
[5] 颜路明, 郭祥泉. 盐碱胁迫对香樟幼苗离子吸收与分配的影响[J]. 土壤, 2015, 47(6): 1176-1180
[6] Li X L, Zhang H M, Ai Q, et al. Two bHLH transcription factors, bHLH34 and bHLH104, regulate iron homeostasis in[J].Plant Physiology, 2016, 4: 2478-2493
[7] Colangelo E P, Guerinot M L. The essential basic helix-loop-helix protein FIT1 Is required for the iron deficiency response[J]. Plant Cell, 2004, 16: 3400-3412
[8] 李俊成, 于慧, 杨素欣, 等. 植物对铁元素吸收的分子调控机制研究进展[J]. 植物生理学报, 2016, 52(6): 835-842
[9] Santi S, Cesco S, Varanini Z, et al. Two plasma membrane H+- ATPase genes are differentially expressed in iron- deficient cucumber plants[J].Plant Physiology And Biochemistry, 2005, 43(3): 287-292
[10] Santi S, Schmidt W. Dissecting iron deficiency - induced proton extrusion inroots[J].New Phytologist, 2009, 183(4): 1072-1084
[11] 王媛华, 段增强, 汤英, 等. 不同施肥处理对碱性设施土壤酸化的影响[J]. 土壤, 2016, 48(2): 349-354
[12] Robinson N J, Procter C M, Connolly E L, et al. A ferric-chelate reductase for iron uptake from soils[J]. Nature, 1999, 397(6721): 694-697
[13] Eide D, Broderius M, Fett J, et al. A novel iron-regulated metal transporter from plants identified by functional expression in yeast[J]. Proceedings of the National Academy of Sciences, 1996, 93: 5624-5628
[14] Nozoye T, Nagasaka S, Kobayashi T, et al. Phytosiderophore efflux transporters are crucial for iron acquisition in graminaceous plants[J]. Journal of Biological Chemistry, 2011, 286: 5446-5454
[15] Ling H Q, Bauer P, Bereczky Z, et al. The tomato fer gene encoding a bHLH protein controls iron-uptake responses in roots[J]. Proceedings of the National Academy of Sciences, 2002 , 99(21): 13938-13943
[16] Brumbarova T, Bauer P. Iron-mediated control of the basic helix-loop-helix protein FER, a regulator of iron uptake in tomato[J]. Plant Physiol., 2005, 137: 1018-1026
[17] Yuan Y X, Wu H L, Wang N, et al. FIT interacts with AtbHLH38 and AtbHLH39 in regulating iron uptake gene expression for iron homeostasis in[J]. Cell Research, 2008, 18: 383-397
[18] Wang N, Cui Y, Liu Y, et al. Requirement and functional redundancy of Ib subgroup bHLH proteins for iron deficiency responses and uptake in[J]. Molecular Plant, 2013, 6: 503-513
[19] Long T A, Tsukagoshi H, Busch W, et al. The bHLH transcription factor POPEYE regulates response to iron deficiency inroots[J]. Plant Cell, 2010, 22: 2219-2236
[20] Selote D, Samira R, Matthiadis A, et al. Iron-binding E3 ligase mediates iron response in plants by targeting basic helix-loop-helix transcription factors[J]. Plant Physiology, 2015, 167: 273-286
[21] Zhang J, Liu B, Li M S, et al. The bHLH transcription factor bHLH104 interacts with IAA-LEUCINE RESISTANT3 and modulates iron homeostasis in[J]. Plant Cell, 2015, 27: 787-805
[22] Murgia I, Tarantino D, Soave C, et al. Arabidopsis CYP82C4 expression is dependent on Fe availability and circadian rhythm, and correlates with genes involved in the early Fe deficiency response[J]. Journal Plant Physiology, 2011, 168: 894-902
[23] 鲁如坤. 土壤农业化学分析方法[M]. 北京: 中国农业科技出版社, 1999: 331-336
[24] Xu W, Yang T Q, Dong X, et al. Genomic DNA methylation analyses reveal the distinct profiles in castor bean seeds with persistent endosperms[J]. Plant Physiology, 2016, 171(2): 1242-1258
[25] Wu J J, Wang C A, Zheng L Q, et al. Ethylene is involved in the regulation of iron homeostasis by regulating the expression of iron-acquisition-related genes in oryza sativa[J]. Journal of Experimental Botany, 2011, 62(2): 667-674
[26] Chen W W, Yang J L, Qin C, et al. Nitric oxide acts downstream of auxin to trigger root ferric-chelate reductase activity in response to iron deficiency in[J]. Plant Physiology, 2010, 154(2): 810-819
[27] Blum A, Brumbarova T, et al. Hormone influence on the spatial regulation of IRT1 expression in iron-defiecent[J]. Plant Signal Behavior, 2014, 9(4): e28787
[28] Maurer F, Mueller S, Bauer P. Suppression of Fe deficiency gene expression by jasmonate[J]. Plant Physiology and Biochemistry, 2011, 49(5): 530-536
[29] Mai H J, Pateyron S, Bauer P. Iron homeostasis in Arabidopsis thaliana: Transcriptomic analyses reveal novel FIT-regulated genes, iron deficiency marker genes and functional gene networks[J]. BMC Plant Biology, 2016, 16: 211
[30] 陆才瑞, 邹长松, 宋国立. 高通量测序技术结合正向遗传学手段在基因定位研究中的应用[J]. 遗传, 2015, 37(8): 765-776
[31] 司晓娇. 盐芥突变体库的构建及突变体的筛选[D]. 济南: 山东师范大学, 2014: 14-16
[32] Shinde S, Villamor J G, Lin W D, et al. Proline coordination with fatty acid synthesis and redox metabolism of chloroplast and mitochondria[J]. Plant Physiology Preview, 2016, 172(2): 1074-1088
[33] Jakoby M, Weisshaar B, Droge-Laser W, et al. bZIP transcription factors in[J]. Trends in Plant Science, 2002, 7: 106-111
[34] Assuncao A G L, Herrero E, Lin Y F, et al.transcription factors bZIP19 and bZIP23 regulate the adaptation to zinc deficiency[J]. Proceedings of the National Academy of Sciences, 2010, 107: 10296-10301
[35] Sinclair S A, Kramer U. The zinc homeostasis network of land plants[J]. Biochimica et Biophysica Acta-gene regulatory mechanisms, 2012, 1823: 1553-1567
[36] Haydon M J, Kawachi M, Wirtz M, et al. Vacuolar nicotianamine has critical and distinct roles under iron deficiency and for zinc sequestration in[J]. Plant Cell, 2012, 24: 724-737
Screening and Characterization of anMutant in Response to Iron Deficiency
WANG Lisai1,2, YAN Mingke1,2, WANG Han1, SHEN Renfang1, LAN Ping1*
(1 State Key Laboratory of Soil and Sustainable Agriculture, Institute of Soil Science, Chinese Academy of Sciences, Nanjing 210008, China; 2 University of Chinese Academy of Sciences, Beijing 100049, China)
Iron is an essential nutrient for plant growth, but also a limiting factor for crop production due to its low solubility and availability in soil. The expression of a variety of genes would be induced under iron deficiency, while to many of these genes, the mechanisms remains unclear.() is one of the iron starvation induced gene and regulated byin. In this study, the promotor ofwas linked to Luciferase to screen the T-DNA insertion mutant library for genes in response to iron deficiency in. After screening, a line L22-8 was identified to remarkably intensify the fluorescence ofin both iron sufficient and deficient conditions. Real time qPCR analysis showed that the expression levels of endogenouswas increasedin root and shoot under normal growth condition, and in shoot underiron deficiency condition, but not the shoot in shortage of iron. The expression of several Fe-marker genes, such as,and, et al., were also significantly changed. These results indicated that the T-DNA insertion of L22-8 affected the molecular response ofto iron deficiency stress andmay play an important role in the formation of heterodimer ofwithand. The T-DNA insertion site of the L22-8 strain was detected to be located betweenandby reverse PCR, and the transcriptional expression of these two genes was slightly lower in mutant than Col-0 under normal conditions. Complementary analysis confirmed thatcould partially recover the L22-8 fluorescence signal, suggesting its role in regulating the response ofto iron deficiency stress. In addition, the contents of total Fe, P and Zn in shoot of L22-8 had no differences compared with Col-0, indicating that there maybe exsit someotherinteractive genes ofinOur results further extend the molecular regulation network of iron uptake and utilization in plant, and provide guidance for molecular breeding.
Soil;Iron-deficiency stress; Mutant characterization; Molecular regulation
国家重点研发计划项目(2016YFD0200308)和国家重点基础研究发展计划(973计划)项目(2015CB150501)资助。
(plan@issas.ac.cn)
王立赛(1990—),女,山东德州人,硕士研究生,主要从事植物营养分子生物学研究。E-mail:1527951097@qq.com
10.13758/j.cnki.tr.2018.03.006
Q945.1
A
