大新月体比例对IgA肾病患者预后判断的价值
2018-07-24郑寿浩黄朝兴
郑寿浩,黄朝兴
(1.温州医科大学附属黄岩医院 肾内科,浙江 台州 318020;2.温州医科大学附属第一医院 肾内科,浙江 温州 325015)
IgA肾病(IgA nephropathy,IgAN)具有慢性进展性质,然而在临床病理表现和预后等方面均存在高度异质性。因此,寻找影响IgAN预后的指标一直是研究热点。新月体病变在IgAN中较为常见,占18.8%~66.4%[1-3]。一般认为,广泛的大新月体(指新月体体积占包曼氏囊周长>50%)形成是影响IgAN患者肾功能的危险因素。但是关于出现新月体病变及其呈非广泛性累及肾小球(即受累肾小球数目<50%)在IgAN预后判断的价值一直存在争议。2017年一项关于IgAN牛津病理分型的多中心验证研究[4]提示,一定比例的新月体(即包括非广泛性新月体形成)也是IgAN患者发生高风险复合事件的独立预测因子。但该研究所指的新月体及其比例是把小新月体(指新月体体积占包曼氏囊周长>10%)也包括在内。新月体是一个活动性病变,其对预后的影响作用实际上有一个从疾病的急性进展到慢性进展的过程,而大新月体及其比例在IgAN急性进展病例起到更为重要的作用。观察大新月体比例较合计大小新月体的比例可能更实用。因此,本研究拟通过对132例含大新月体的IgAN患者临床病理和预后进行回顾性分析,探究大新月体比例在IgAN患者预后判断上的价值。
1 资料和方法
1.1 一般资料 选择2008年1月至2017年2月在温州医科大学附属第一医院住院并经肾活检且符合以下入选标准的患者132例。按大新月体比例分为2组,对照组:大新月体比例<15%,共100例;观察组:大新月体比例≥15%,共32例。入选标准:①确诊为原发性IgAN;②包含至少1个大新月体(细胞性或细胞纤维性);③实际可观察的肾小球(不含废弃肾小球)数≥8个;④年龄≥18岁;⑤随访时间≥3个月。IgAN的诊断依据为免疫荧光检出弥漫性系膜区以IgA为主的免疫沉积物。大新月体定义为新月体体积占包曼氏囊周长>50%。排除标准:①可导致继发性系膜IgA沉积的其他系统性疾病,如过敏性紫癜、肝硬化、系统性红斑狼疮和乙型肝炎病毒感染等;②合并有恶性肿瘤、活动性结核、甲亢等消耗性疾病,或脏器移植术后接受免疫抑制治疗,或存在较严重的其他系统性疾病;③肾活检组织实际可观察的肾小球数<8个;④随访资料不全。本研究经温州医科大学附属第一医院伦理委员会批准。
1.2 资料收集 收集患者的年龄、性别、身高、体质量、血压、24 h尿蛋白定量、血清肌酐(serum creatinine,Scr)和估算的肾小球滤过率(estimated glomerular filtration rate,eGFR)等参数的基线数据,收集随访中糖皮质激素、细胞毒类免疫抑制剂(包括环磷酰胺、霉酚酸酯、他克莫司、来氟米特和雷公藤多苷等,以下合称细胞毒类药物)及肾素-血管紧张素系统(renin angiotensin system,RAS)抑制剂(包括血管紧张素转换酶抑制剂和血管紧张素 II受体1拮抗剂)的使用情况。采用eGFR估算公式(MDRD中国人修正):eGFR[mL/(min·1.73 m2)]=186.3×[Scr(μmol/L)×0.0113]-1.154×年龄-0.203×0.742(女性)。高血压的判断标准:入院查体或入院前的病程中2次收缩压≥140 mmHg(1 mmHg=0.133 kPa)和/或舒张压≥90 mmHg。平均动脉压(mean arterial pressure,MAP)的计算公式:MAP=舒张压+1/3脉压差。基线数据指肾活检时或肾活检前1周内清晨空腹血样本或尿样本检查的结果。以肾活检日期为起点,随访至2017年6月30日,末次临床资料的收集为末次随访或出现复合终点事件时的检查结果。
1.3 肾脏病理 所有患者行经皮肾穿刺活检术取得肾组织。石蜡包埋组织2~3 mm连续切片,常规HE、PAS、PASM和Masson染色;常规在冰冻切片上行直接免疫荧光法检测IgG、IgA、IgM、C3、C1q和纤维蛋白原,间接免疫荧光检查HBsAg和HBcAg。部分病例行电镜检查。由同一名肾脏病理医师在未知患者临床结局的前提下按IgAN牛津病理分型[5]对肾脏病理改变进行评估。
1.4 判断标准 参照IgAN牛津病理分型,系膜细胞增殖评分(M):M0指无弥漫性系膜细胞增生,M1指有弥漫性系膜细胞增殖;毛细血管内细胞增殖(E):E0指无肾小球毛细血管腔内细胞增殖,E1指有肾小球毛细血管腔内细胞增殖并导致管腔狭窄;节段性肾小球硬化(S):S0指无节段性肾小球硬化或球囊粘连,S1指有节段性肾小球硬化或球囊粘连;肾小管间质病变评分(T):无或轻度肾小管间质病变(T0)指肾小管萎缩及间质纤维化占肾皮质面积0~25%,中度肾小管间质病变(T1)指肾小管萎缩及间质纤维化占肾皮质面积26%~50%,重度肾小管间质病变(T2)指肾小管萎缩及间质纤维化占肾皮质面积51%以上。
按新月体体积大小分为大新月体(新月体体积>50%包曼氏囊周长)和小新月体(10%包曼氏囊周长<新月体体积<50%包曼氏囊周长);根据新月体的组成成分,分为细胞性新月体、细胞纤维性新月体和纤维性新月体。
新月体比例的定义和计算:新月体比例定义为含大小新月体(纤维性小新月体除外)的肾小球数占肾小球总数的百分比。计算公式:新月体比例=[含大新月体(包括细胞性、细胞纤维性和纤维性)的肾小球数+含小新月体(细胞性和细胞纤维性)的肾小球数]/实际可观察的肾小球(去除废弃肾小球)总数。
大新月体比例的定义和计算:大新月体比例定义为含大新月体的肾小球数占肾小球总数的百分比。计算公式:大新月体比例=含大新月体(包括细胞性、细胞纤维性和纤维性)的肾小球数/实际可观察的肾小球(去除废弃肾小球)总数。
1.5 随访终点事件 复合终点事件包括:①Scr较基线值翻倍持续3个月以上;②eGFR下降达终末期肾脏病(end stage renal disease,ESRD)[即eGFR<15 mL/(min·1.73 m2)持续3个月以上]或需要持续性肾脏替代治疗或死亡。
1.6 统计学处理方法 采用SPSS24.0统计软件进行统计分析。计量资料数据符合正态分布采用±s表示,2组间比较采用独立样本t检验,非正态分布计量资料采用M(P25,P75)表示,2组间比较采用秩和检验;计数资料采用频率(%)表示,2组间比较采用χ2检验;采用Cox比例风险模型分析患者发生复合终点事件的相关危险因素。P<0.05为差异有统计学意义。
2 结果
2.1 一般资料 共132例IgAN患者纳入本研究,其中男53例,女79例,确诊时的年龄为18~83岁,平均(38.8±13.8)岁。24 h尿蛋白定量为1.9(1.0,3.2)g/d,Scr为86.3(67.7,120.0)μmol/L;新月体比例为14.95%(8.39%,23.41%),其中大新月体比例为8.33%(5.00%,14.09%)。中位随访时间为22(12,38)个月。随访中,105例(占80%)接受糖皮质激素及(或)细胞毒类药物治疗,104例(占79%)接受RAS抑制剂治疗。10例(占7.6%)出现了复合终点事件,其中9例(占6.8%)达到ESRD,无死亡病例。在入组的132例中,基线eGFR<30 mL/(min·1.73 m2)共有13例(占9.8%),其中6例(占46%)出现复合终点事件;而在119例(占90%)基线eGFR≥30 mL/(min·1.73 m2)的患者中,仅有4例(占3%)出现复合终点事件。在10例出现复合终点事件的患者中,基线eGFR为27(10,41)mL/(min·1.73 m2),中位Scr翻倍时间为23(12,35)个月;在达到ESRD的9例中,中位达ESRD时间为22.0(6.5,43.0)个月。
2.2 2组临床表现比较 与对照组比,观察组的年龄较大,MAP的水平较高,细胞毒类药物的使用率较高,RAS抑制剂的使用率较低,差异均有统计学意义(P均<0.05);与对照组比,观察组的尿蛋白和Scr的水平均较高,新月体比例、大新月体比例及中重度肾小管间质病变的比例均较高,差异均有统计学意义(P均<0.01)。见表1。
2.3 转归及预后影响因素的分析 随访结果显示,对照组100例中3例(占3%)出现复合终点事件,观察组32例中7例(占22%)出现复合终点事件;Kaplan Meier生存分析结果显示,与对照组比,观察组的肾脏存活率明显较低,差异有统计学意义(log rank χ2=21.474,P<0.001),见图1。
纳入年龄(按连续变量)、尿蛋白(按连续变量)、Scr(按连续变量)、M(0=M0,1=M1)、E(0=E0,1=E1)、S(0=S0,1=S1)、T(0=T0,1=T1或T2)、新月体比例(0=新月体比例<25%,1=新月体比例≥25%)、大新月体比例(0=大新月体比例<15%,1=大新月体比例≥15%)、是否使用糖皮质激素(0=未使用,1=使用)、细胞毒类药物(0=未使用,1=使用)和RAS抑制剂(0=未使用,1=使用)等变量,进行与发生复合终点事件联系的单因素Cox回归分析,结果显示年龄、E、T、大新月体比例及RAS抑制剂可能是影响肾脏终点事件发生的因素,见表2。
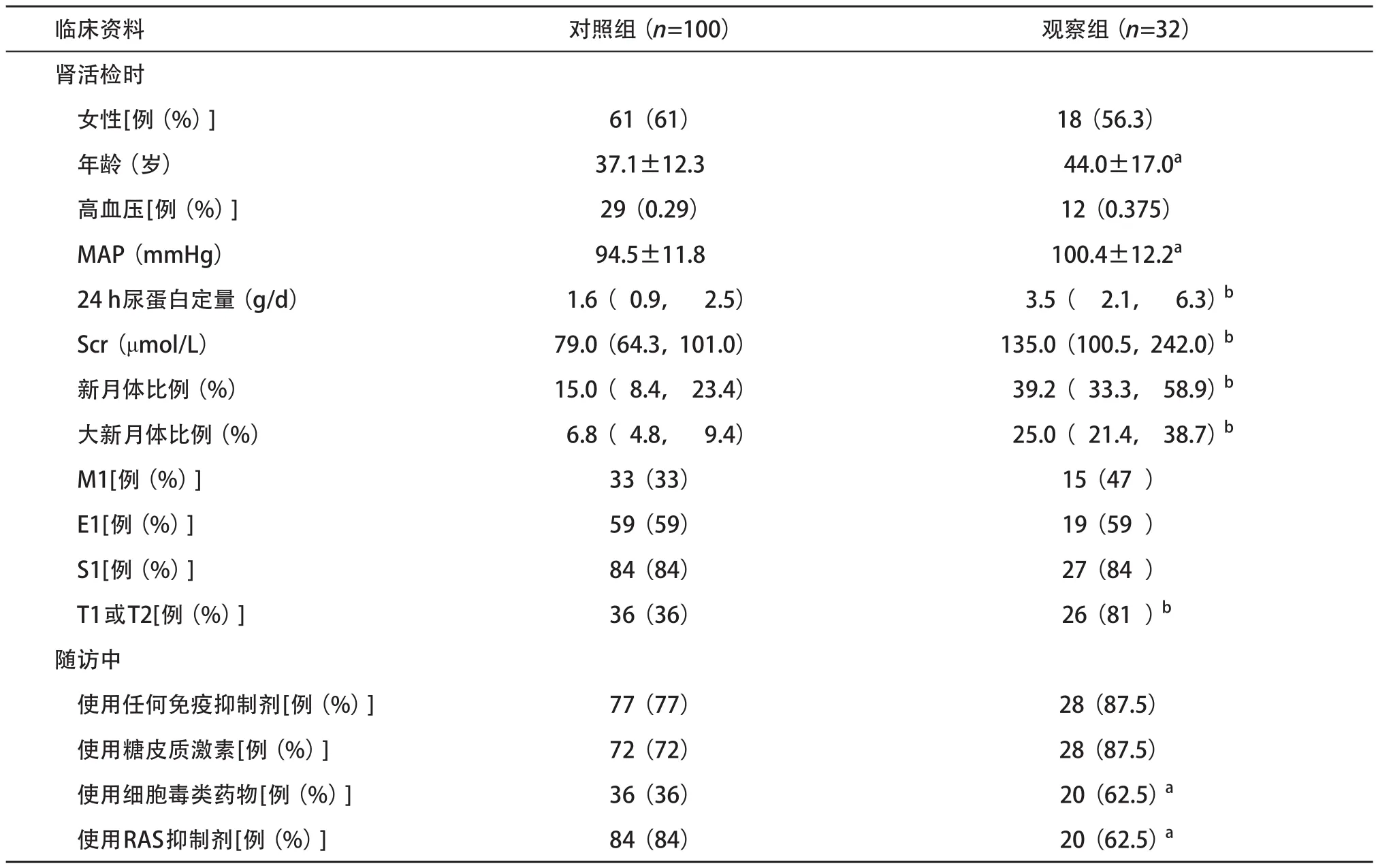
表1 2组患者临床资料比较
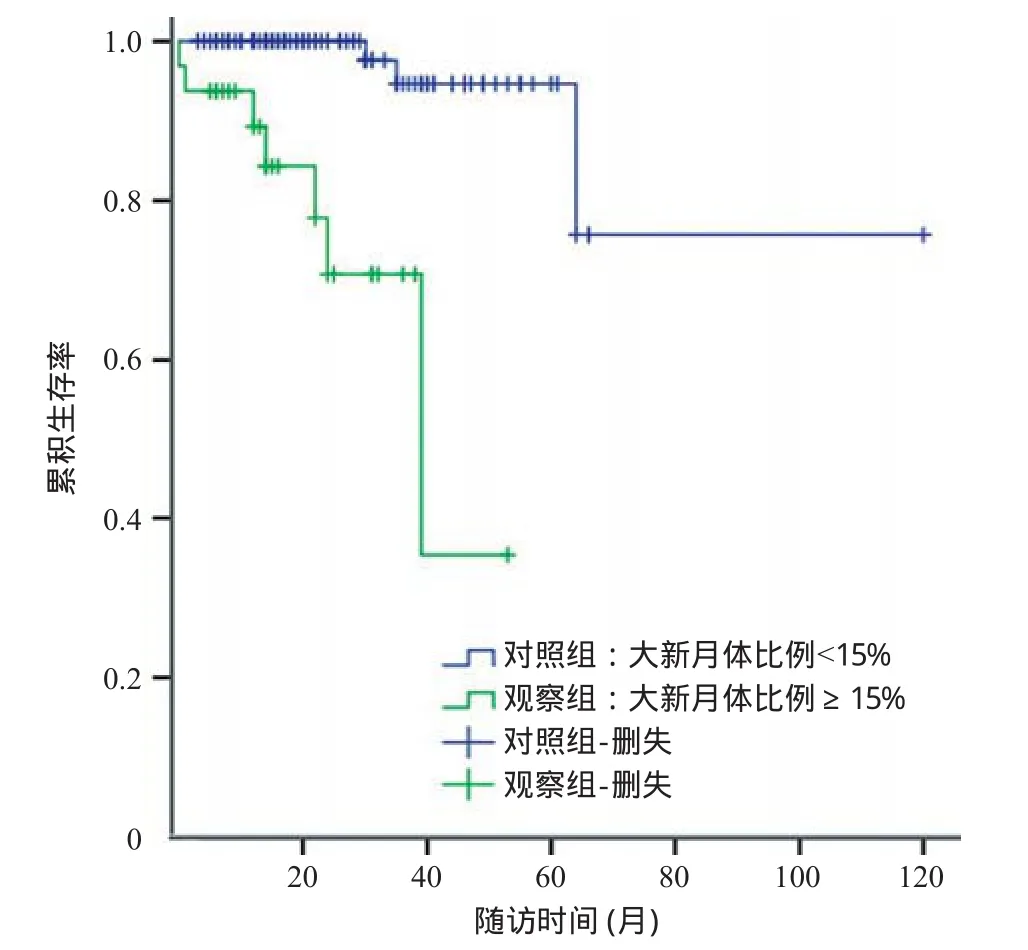
图1 2组患者Kaplan-Meier生存分析结果
将以上5个因素纳入模型进行多因素逐步Cox回归分析,结果显示T、大新月体比例及RAS抑制剂可能是影响终点事件发生的因素。其中,观察组发生终点事件的风险是对照组的8.133倍(95%CI=1.220~54.219,P<0.05),见表3。
3 讨论
在最初的IgAN牛津病理分型研究及严格按牛津研究准入标准[排除了初始eGFR<30 mL/(min·1.73 m2)和/或快速进展至ESRD的病例而可能将部分伴大量新月体的急性病变排除在外]进行的验证研究中,入选病例中含新月体比例(占45%)高但新月体累及肾小球的总体比例(占9%)偏低,无法评估或不支持新月体的独立预测价值[3,5-6]。而在其他一些入组限制较少的研究[7-10]中发现新月体与复合终点事件(ESRD、Scr翻倍或eGFR减少50%,甚至死亡)显著相关。但值得注意是,其中KATAFUCHI等[7]的研究表明,如果严格按牛津研究准入标准,即在所有研究对象中把eGFR<30 mL/(min·1.73 m2)的病例排除在外,则又会失去新月体的预测价值,提示新月体对IgAN预后影响可能仅在eGFR<30 mL/min情况下才有意义。
近期,HAAS等[4]纳入了3 096例IgAN患者的多中心回顾性研究显示,在未接受免疫抑制治疗的患者中,新月体能预测较高的复合终点事件的风险,并且当患者含新月体的肾小球的比例达到1/4以上时,无论是否接受免疫抑制治疗,其与出现联合终点事件亦独立相关,该研究最后认为新月体是高风险复合事件的独立预测因子,建议将新月体及含新月体的肾小球比例作为IgAN牛津病理分型预测疾病预后指标的补充,即MEST-C,并按含新月体的肾小球比例分为C0(无新月体)/C1(新月体比例<25%)/C2(新月体比例≥25%)。
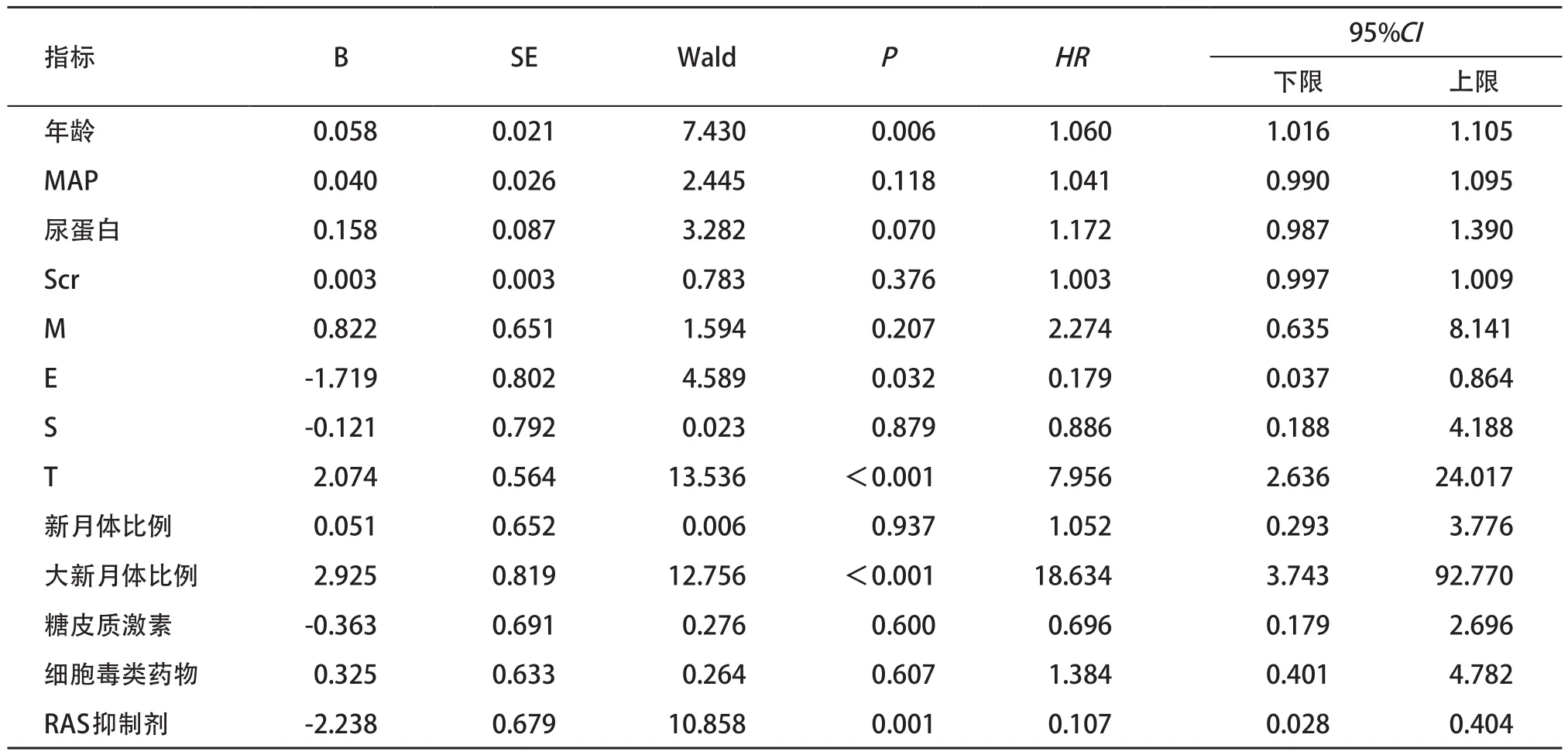
表2 IgAN肾病预后影响因素的单因素Cox回归分析
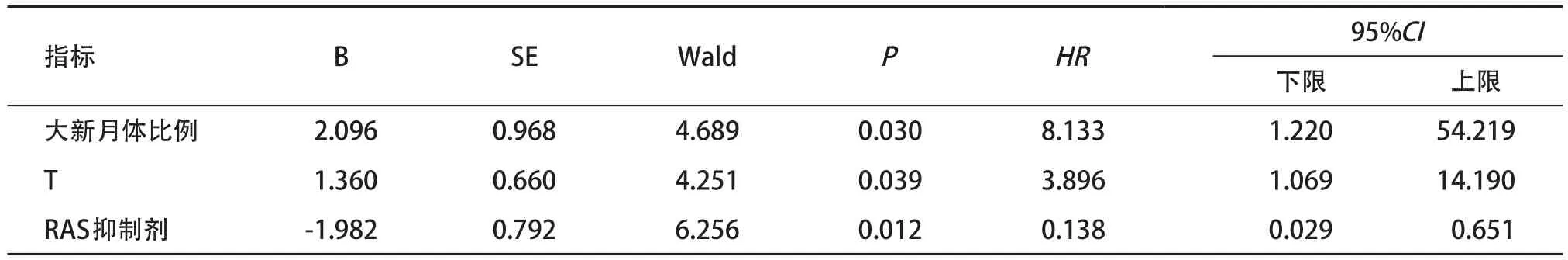
表3 IgAN肾病预后影响因素的多因素逐步Cox回归分析
IgAN牛津病理分型在其最初的研究中定义新月体为毛细血管外增生性病变累及>10%的包曼氏囊周长[3]。对于新加入的新月体病变指标没有再做出关于新月体体积大小的特别规定,即实际上是评估大小新月体的有无及其合计累及肾小球的比例,以上关于IgAN牛津病理分型的验证研究也都是如此,而这与我们做病理诊断新月体肾炎时所采用的标准(只算大新月体比例)不同。在病理生理上,大新月体比小新月体更容易影响肾小球滤过率;临床上,小的节段性新月体常见于IgAN轻症病例,而大新月体及其比例则常与IgAN急性进展病例相关。有研究[11]显示,随着新月体比例的升高,大新月体比例也相应升高,在发生终点事件最多的IgAN病例组中的大新月体比例亦最高,提示大新月体比例也许是导致预后不良的因素之一。
本研究显示,观察组(大新月体比例≥15%)的肾脏存活率明显较低于对照组(大新月体比例<15%)(log rank χ2=21.474,P<0.001)。单因素Cox回归分析提示大新月体比例(≥15%)具有一定的预测价值(HR=18.634,95%CI=3.743~92.770,P<0.001),多因素逐步Cox回归模型分析提示大新月体比例较高(≥15%)患者发生肾衰竭的风险是大新月体比例较低(<15%)患者的8.133倍。以上结果表明含大新月体的肾小球比例≥15%是影响IgAN患者肾脏预后的独立危险因素。需要指出,本研究对象并没有严格按牛津研究准入标准入组,这与本研究得出大新月体比例的预测价值可能不无关系。
本研究对象入选条件之一是至少包括1个细胞性或细胞纤维性大新月体。在此基础上,如果按大小新月体合计比例的计算方法,含新月体的肾小球比例的中位数在观察组明显高于对照组(39.2% vs.15.0%);而如果按大新月体比例计算,含大新月体的肾小球比例的中位数在观察组和对照组则分别为25.0%和6.8%,这些数据都明显低于按前一种方法得出的相应值。由此可以推测,以大新月体比例作为预测指标可能敏感性较强,这也得到本研究单因素回归分析结果的支持。
此外,通过多因素回归分析,本研究证实肾小管萎缩/间质纤维化是影响IgAN预后的独立危险因素,并且提示使用RAS抑制剂也可能是影响IgAN预后的因素之一。本研究中,观察组比对照组使用RAS抑制剂较少,使用细胞毒类药物较多,这可能与观察组基线的临床病理表现较重有关。
总之,本研究初步显示大新月体比例可能与IgAN患者不良的肾脏预后相关。本研究尚存在一定的局限性(单中心,入组病例及进展至复合终点事件的例次绝对值偏少,缺少不含大新月体的病例对照组),未来需要大样本多地域多中心队列的临床研究行进一步探讨。
