短瓣金莲花种子无菌萌发与幼苗快繁技术初探
2018-07-24徐剑秋安娟艳蒋洪毛王珍熹张天星李开隆
周 芳 徐剑秋 安娟艳 蒋洪毛 王珍熹 张天星 李开隆
(东北林业大学林木遗传育种国家重点实验室,哈尔滨 150040)
短瓣金莲花(TrolliusledebouriReichb.)为毛茛科(Ranunculaceae)金莲花属(Trollius)多年生草本植物,生于海拔110~900 m的草甸、林间草地或者河边,主要分布在黑龙江、内蒙古、长白山余脉等地及俄罗斯西伯利亚东部[1]。短瓣金莲花主要含有黄酮、苯乙素、有机酸及酯类等成分,具有清热解毒、消肿明目等功效,用于治疗呼吸道感染、咽炎、扁桃体炎和支气管炎等[2]。近年来,野生短瓣金莲花资源因大量采摘而受到严重破坏,因此加强对野生短瓣金莲花资源的收集、保存和繁殖利用,具有重要意义。但是,由于短瓣金莲花种子小且有胚后熟休眠的特性,出苗困难。目前国内有关金莲花属植物的研究多集中在金莲花的种子萌发[3~4]、播种育苗[5]及离体培养[6~7]方面,而关于短瓣金莲花组织培养的研究尚未见报道。本研究以野生短瓣金莲花种子为初始材料,利用赤霉素打破休眠促进萌发,获得短瓣金莲花无菌苗,然后剪取其根茎及以上部分形成的不定芽为外植体,采用正交设计方法研究不同培养基类型、6-BA和NAA浓度对短瓣金莲花增殖的影响,不同培养基类型、IBA和NAA浓度对生根的影响,建立了短瓣金莲花组织培养体系,为短瓣金莲花优良品种保存和快速扩繁提供技术支持。
1 材料与方法
1.1 植物材料
供试材料为大兴安岭加格达奇地区的野生短瓣金莲花种子,由加格达奇市林业局提供。
1.2 方法
1.2.1 种子无菌萌发与初始培养
取低温储藏的短瓣金莲花种子分别置于300、400、500、600、700 mg·L-1的GA3溶液中浸泡,浸泡时间为24、48和72 h。每种处理0.1 g。将经浸泡的种子分组用0.1%的HgCl2灭菌,涡旋混匀器处理10、20和30 min。灭菌后用无菌水冲洗种子5遍,在超净台上将种子接种至MS培养基,每种处理接种3盘(重复3次)。每天观察感染菌和发芽情况,20 d后进行发芽率的统计计算。
1.2.2 增殖培养
选择长势良好、均一的无菌幼苗,剪去根系,将根茎及以上部位的幼苗(2 cm左右的高度)作为外植体,采用L16(43)正交设计,探讨培养基类型、6-BA、NAA 3因素4水平组合对金莲花增殖的影响,40 d记录幼苗株高和抽茎数。
1.2.3 生根培养
以短瓣金莲花组培增殖苗为材料,将之接种到含不同基本培养基类型、不同IBA、NAA浓度的生根培养基上进行生根培养。每天观察其生根状况。20天以后,测定其不定根的长度和数量。
上述培养基内均含有蔗糖25 g·L-1,琼脂6.0 g·L-1,pH值5.8,121℃高温灭菌20 min。培养室温度控制在22~25℃,湿度60%~70%,光照强度2 000 Lx,光照时间16 h·d-1。
1.3 炼苗与移栽
当组培苗生根且长到2~3 cm高时,在室外炼苗,移栽至穴盘。炼苗方法:将生长健壮、根系发达的短瓣金莲花组培苗开盖放置2天(使其逐步适应无菌到有菌、由恒温到变温等变化),注入少量无菌水。2天后,用镊子将组培苗从培养瓶中取出,用稀释1 000倍的多菌灵溶液清洗后用清水冲洗,洗去根部培养基,尽量避免伤及根系。栽培在高温灭菌V草炭土∶V珍珠岩∶V蛭石=3∶1∶1的土壤基质为最佳。移栽后,用干净的培养瓶罩在移栽苗上放置1周,浇水保持土壤含水量25%左右,1周后将培养瓶取下即可,对其成活率进行统计。
2 结果与分析
2.1 GA3浓度和灭菌时间对短瓣金莲花种子萌发的影响
由表1可以看出,GA3浓度对短瓣金莲花种子发芽率的影响达极显著水平,GA3浸泡时间和0.1% HgCl2灭菌时间对短瓣金莲花种子发芽率的影响也都达到了显著水平;另一方面,GA3浓度、浸泡时间和0.1% HgCl2灭菌时间对短瓣金莲花种子染菌率的影响都达到了显著或极显著水平,说明GA3处理不仅促进了短瓣金莲花种子的萌发,增强了萌发活力,而且降低了染菌率。
对6种浓度GA3溶液进行多重比较发现(表1),500和600 mg·L-1GA3处理的种子发芽率与300 mg·L-1处理的种子发芽率差异显著,与0 mg·L-1差异极显著,与400和700 mg·L-1GA3处理的种子发芽率差异不显著。但在病菌感染方面,500 mg·L-1处理的种子染菌率最高,与0 mg·L-1GA3溶液处理的种子染菌率差异不显著,与600 mg·L-1处理的种子染菌率差异显著,与400 mg·L-1处理的种子染菌率差异极显著,而600 mg·L-1GA3处理与其他浓度差异不显著,因此600 mg·L-1为最适宜的GA3处理浓度。
由GA3溶液的3种浸泡时间的多重比较分析可知(表1),浸泡48 h的种子发芽率最高,与浸泡24和72 h的种子发芽率差异显著;而浸泡48 h的种子染菌率与72 h的种子染菌率差异显著,与24 h的种子染菌率差异不显著,因此,GA3最适宜浸泡时间为48 h。
由HgCl2不同灭菌时间的多重比较分析可以看出(表1),灭菌20 min的种子发芽率最高,与10 min的种子发芽率差异不显著,但灭菌20 min的种子染菌率低于10 min的种子染菌率,且差异显著;虽然30 min灭菌效果最好,但发芽率最低,因此灭菌20 min为HgCl2最适宜灭菌时间。
2.2 培养基及激素对短瓣金莲花不定芽增殖和生长的影响
由表2可知,16种不同的培养基类型和不同激素浓度组合对短瓣金莲花的抽茎数和高增长影响差异显著,组合3效果最好(图1),抽茎数最多,均值达到19.0,茎高增长为2.567 cm,且与其他组合差异显著。
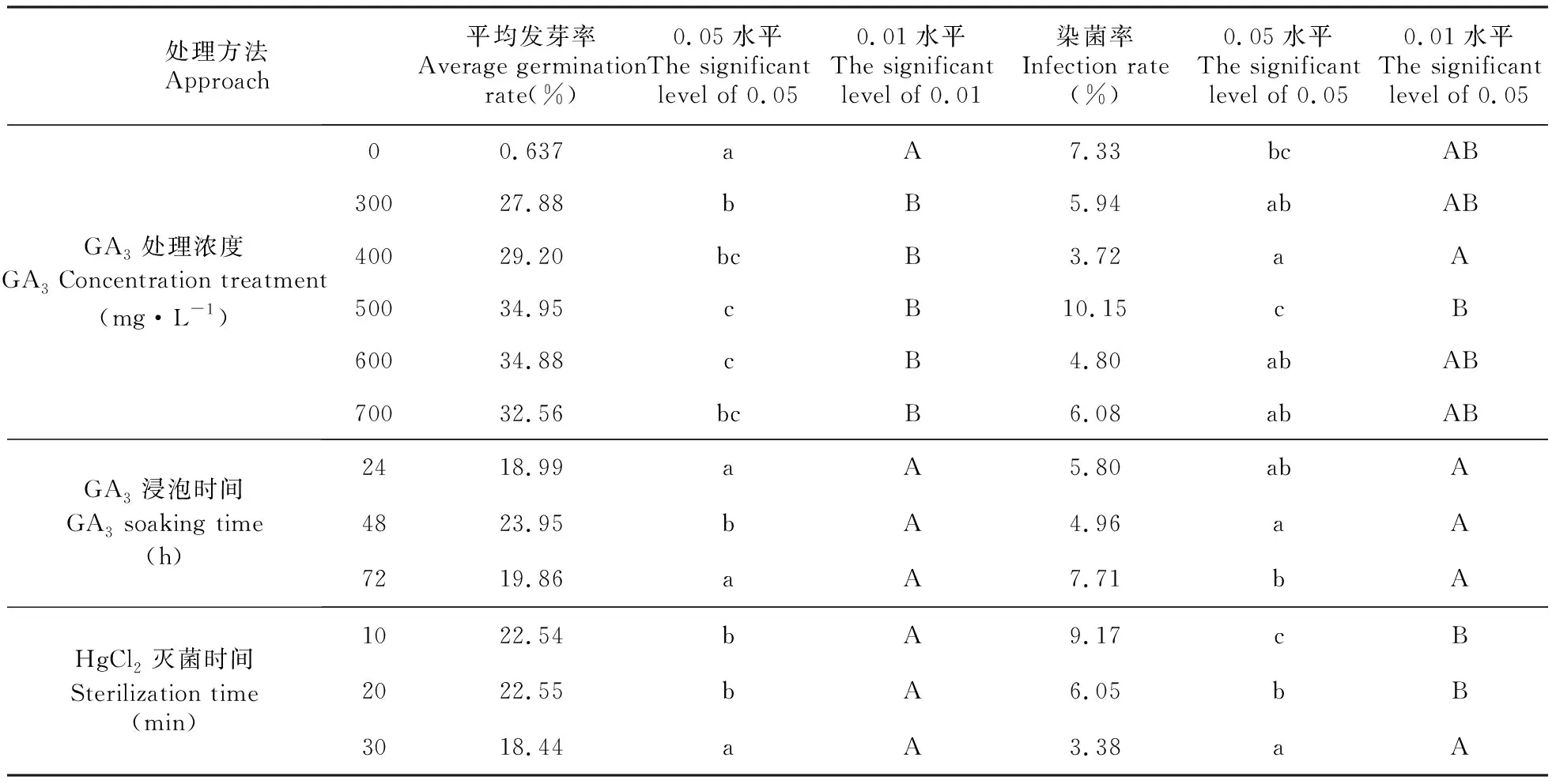
表1 GA3浓度、浸泡时间和HgCl2灭菌时间对短瓣金莲花种子发芽率和染菌率的多重比较Table 1 Comparison on the seed germination and contamination rates of T.ledebouri among different GA3 soaking times, concentrations and sterilization times of HgCl2

图1 金莲花的增殖情况比较 (3)(4)(12)(8)为表2中培养基编号Fig.1 Comparison of the proliferation of T.ledebouri (3)(4)(12)(8)is No. of culture medium in Table.2
由3因素4水平正交设计对短瓣金莲花增殖影响的方差分析和多重比较(图2)可以看出,培养基类型和NAA浓度对短瓣金莲花的抽茎数和茎高生长影响差异显著, 6-BA浓度对短瓣金莲花的抽茎数影响差异显著,而对其茎高生长影响差异不显著。4种培养基类型中,MS培养基对短瓣金莲花抽茎数和茎高生长效果最好,且与其他3种培养基类型差异显著,故MS为最适培养基类型。虽然6-BA对短瓣金莲花的茎高生长的影响差异不显著,但对短瓣金莲花的抽茎数的影响差异显著。6-BA 0.5和1.0 mg·L-1,都与0和1.5 mg·L-1差异显著,而0.5与1.0 mg·L-1差异不显著以用量少者为宜,故0.5 mg·L-1为6-BA的适宜浓度。NAA对短瓣金莲花的抽茎数的影响, 0.05,0.10和0.15 mg·L-1差异不显著,与0 mg·L-1差异显著。而NAA对短瓣金莲花的茎高生长的影响, 0.10,0和0.05 mg·L-1差异显著,与0.15 mg·L-1差异不显著;0.15与0.0 mg·L-1差异显著,故0.10 mg·L-1为NAA的适宜浓度。因此短瓣金莲花增殖的适宜培养基配方为MS+6-BA 0.5 mg·L-1+NAA 0.1 mg·L-1。
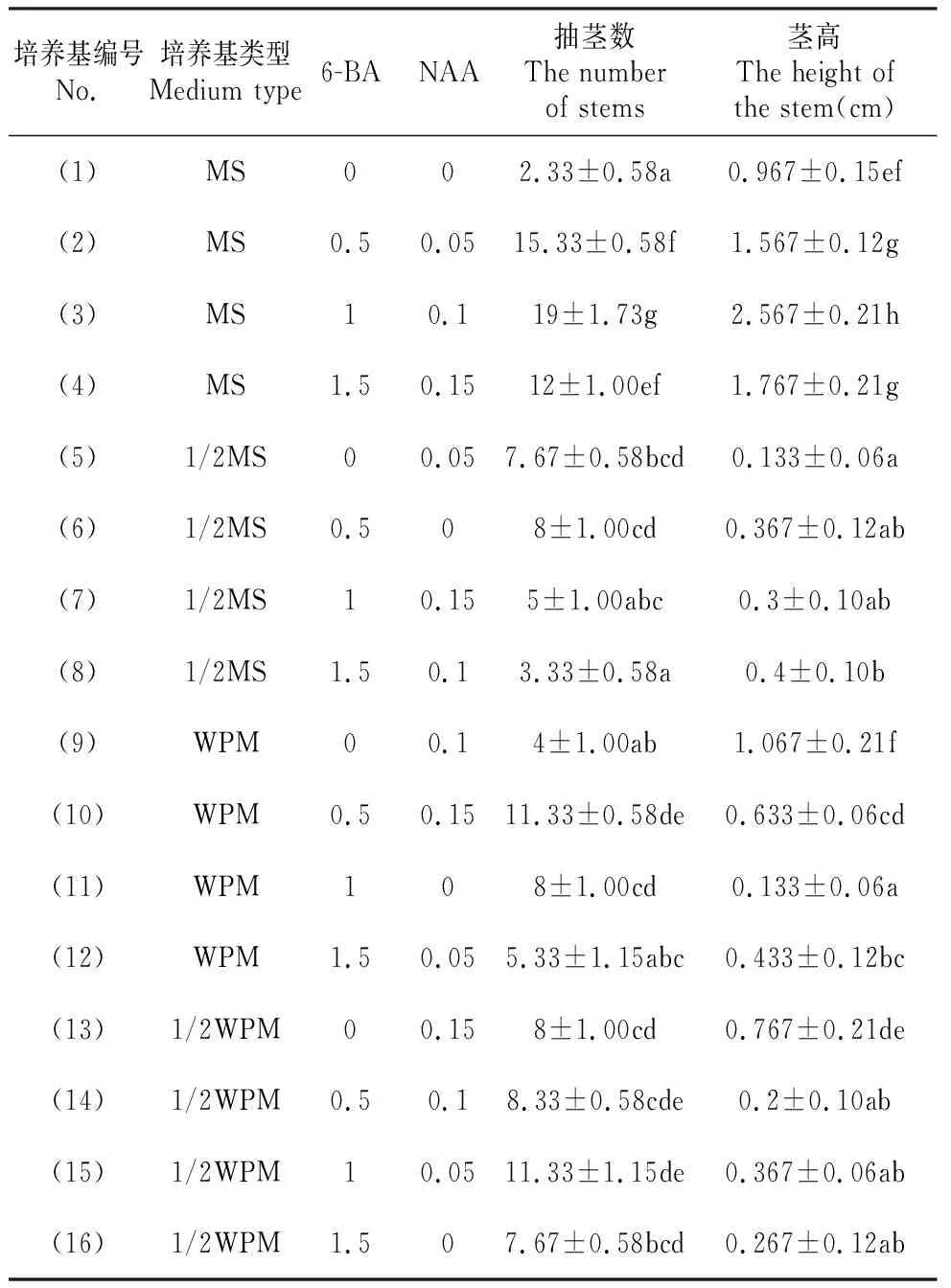
表2 不同培养基类型、不同浓度6-BA和NAA对短瓣金莲花抽茎和生长的影响Table 2 Effects of Different culture medium, 6-BA and NAA on T.ledebouri seed stem growth
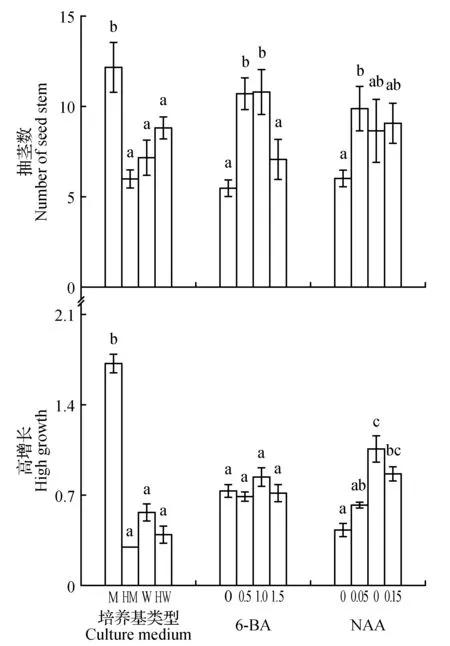
图2 不同培养基类型、6-BA 和NAA对短瓣金莲花抽茎和生长的影响Fig.2 Effects of different culture medium,6-BA and NAA on T.ledebouri seed stem growth
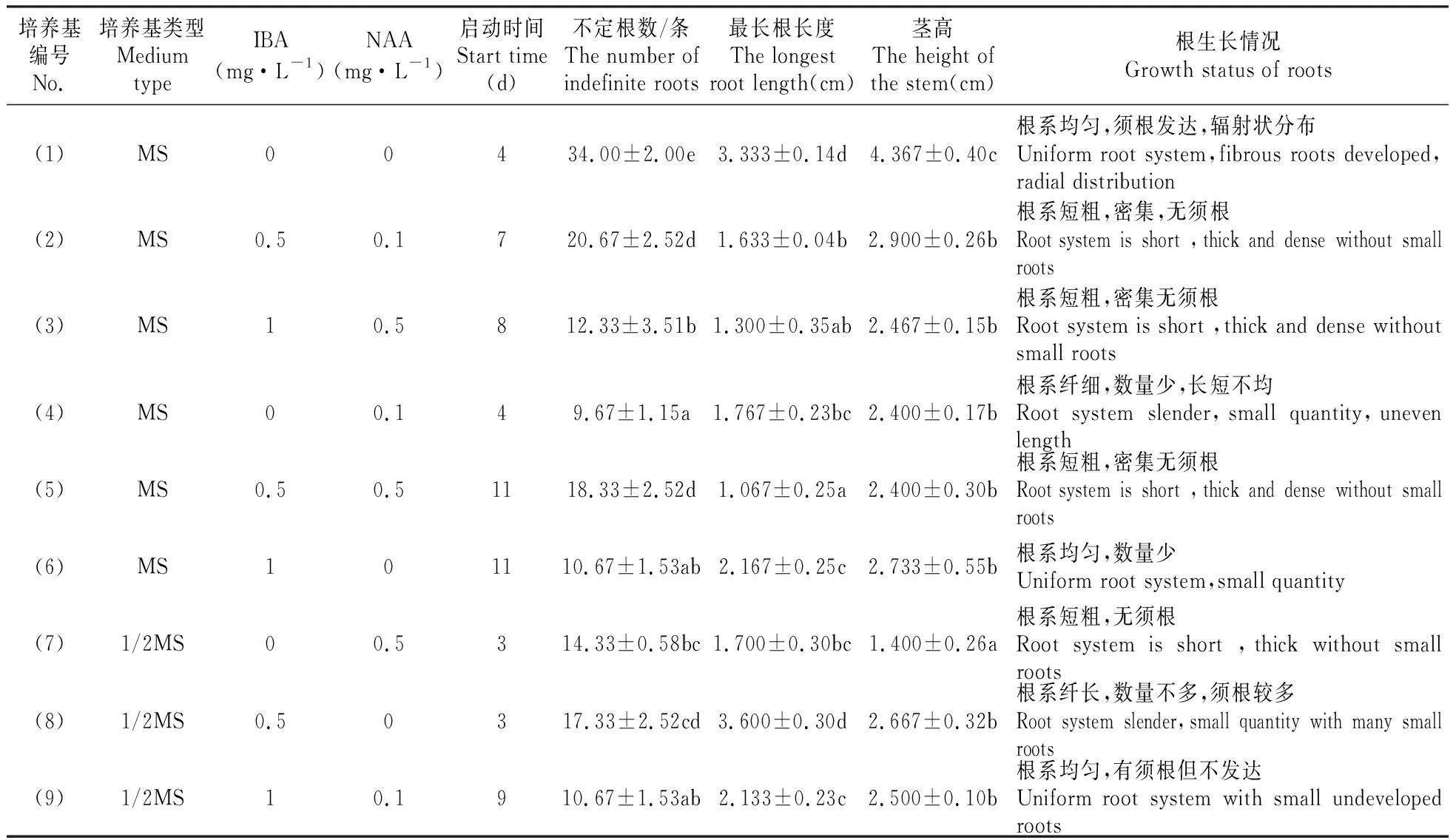
表3 不同培养基配比对金莲花生根的影响Table 3 Effect of different medium proportion on T.ledebouri rooting
2.3 不同培养基及激素对短瓣金莲花生根的影响
不同培养基类型及激素配比组合对短瓣金莲花生根的影响差异显著,1号组合无论是不定根数,还是最长根长度,还是茎高,与其他组合相比都差异显著(表3)。从短瓣金莲花根系发育来看,1号生根较好,长势均匀且须根较多, 5号和6号组合不定根数量较多,但是根系短而粗,8号组合不定根数量较多但根系纤细,9号组合须根不够发达,因此1号组合为最佳(图3)。即MS不添加激素,培养效果最好。
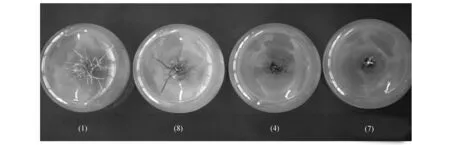
图3 金莲花生根情况比较 (1)(8)(4)(7)为表3中培养基编号Fig.3 Comparison of rooting of T.ledebouri (1)(8)(4)(7)is No. of culture medium in Table.3
2.4 组培苗的炼苗与移栽
通过数量统计,其成活率高达90%以上(图4),符合植物组织组培快繁的要求。移出的组培苗要尽量保证阳光充足与通风凉爽的环境,保持一定的湿度,之后逐渐降低湿度和增强光照,定期疏松培养土,保证其正常生长。

图4 金莲花移栽成活情况Fig.4 Survive of plantlets of T.ledebouri
3 讨论
3.1 短瓣金莲花种子的萌发特性
短瓣金莲花与金莲花属其他种[3]一样,其种子存在生理休眠现象,新采种子需经低温沙藏或赤霉素处理,才可萌发。本试验证实了赤霉素打破休眠的作用,且GA3浓度增加能显著促进短瓣金莲花种子的萌发,确定GA3的最适处理浓度为600 mg·L-1,且GA3浸泡时间为48 h萌发率最高。王玄[4]以金莲花种子为材料,采用浓度范围为50~350 mg·L-1的GA3,浸泡1~4 d,发现随着GA3浓度增加,金莲花种子达到最大萌发率相应的处理时间有减少趋势。胡海英[5]在金莲花种子无菌播种实验中用 100 mg·L-1GA3冷浸4天效果最佳。这说明对于金莲花属中不同种的种子催芽处理,采用GA3处理的浓度和处理时间不一样。
3.2 种子消毒
短瓣金莲花种子的除菌消毒较困难,延长灭菌时间,染菌率低,灭菌效果好,但同时对种子毒害也大。本实验采用了0.1%的HgCl2灭菌,处理时间10~30 min,最后发现20 min灭菌效果最佳。这与杨玉芳[6]所提出的金莲花种子灭菌方法一致,而郑志新[7]研究提出的灭菌时间要短一些为10 min。
3.3 增殖培养
本实验采用短瓣金莲花无菌苗,以其根茎及以上部分的幼苗为外植体进行增殖培养,在培养基类型比较中,MS培养基与WPM相比,对短瓣金莲花的高生长和抽茎数存在着极显著性差异,而作为参照的WPM培养基并不适合短瓣金莲花的生长。短瓣金莲花的增殖培养基配方为MS+6-BA 0.5 mg·L-1+NAA 0.1 mg·L-1。杨玉芳[6]提出金莲花增殖培养的培养基是1/2MS+1.0 mg·L-16-BA+0.1 mg·L-1NAA,仍然为MS培养基,培养基成分减半,而添加激素的种类及浓度基本一致。郑志新[7]又提出了金莲花壮苗培养的培养基(MS+6-BA 4.0 mg·L-1+NAA 0.2 mg·L-1)和增殖培养基(MS+6-BA 4.0 mg·L-1+2,4-D 0.2 mg·L-1),激素浓度更大,这可能所用材料不同造成的。
3.4 生根培养
本次生根试验的培养基配方采用正交设计的9种方案最终均能诱导短瓣金莲花的外植体长出不定根,但各组不定的根的启动时间和生长状况存在着较大差异。其中1号试验组的不定根启动时间较早,生长状况较好,根系均匀,数量及须根均较多,其配方为MS培养基,且不添加任何激素。杨玉芳[6]提出金莲花生根培养基是1/2MS或1/2MS+0.05 mg·L-1NAA。对于较容易生根的材料,不需要添加激素,生根效果就很好,如马蔺[8]的诱导生根培养中也不需要加入激素,就能获得长势良好的生根苗,这也从另一个侧面证实了本研究结果的合理性。
