珠子参中法尼基焦磷酸合酶(FPS)对皂苷生物合成的影响研究
2018-07-24刘美佳于怡琳刘迪秋
刘美佳 于怡琳 姜 森 张 翔 刘迪秋 葛 锋
(昆明理工大学生命科学与技术学院,昆明 650500)
珠子参(Panaxjaponicus)为五加科(Araliaceae)人参属(Panax)植物,因根茎节间纤细,节膨大成球形念珠状而得名,其根茎入药。珠子参作为药材,始载于《滇南本草》,为历版《中国药典》收载品种。药用珠子参主产于云南,属名贵常用中药材,是彝族、纳西族、白族、藏族、僳族等少数民族的传统用药。珠子参性味苦、甘、微寒,归肝、肺、胃经,具有补肺养阴、祛瘀止痛,止血之功效,临床上应用于气阴两虚,烦热口渴,虚痨咳嗽,跌打损伤,关节疼痛,咳血,吐血,外伤出血等症状[1~2]。
珠子参皂苷(Panaxjaponicussaponins)为珠子参的主要活性成分,主要由达玛烷型三萜皂苷和齐墩果烷型三萜皂苷构成。目前,已从珠子参根茎叶中分离出了40多种皂苷成分,主要包括竹节参皂苷Ⅳa、竹节参皂苷Ⅳ、竹节参皂苷Ⅴ、人参皂苷R0、人参皂苷Re、人参皂苷Rd、人参皂苷Rb1等[3~5]。与珠子参同为人参属的“人参”(Panaxginseng)主要含达玛烷型皂苷,齐墩果烷型皂苷仅发现含量极微的人参皂苷R0;而“三七”(Panaxnotoginseng)只含达玛烷型皂苷,不含齐墩果烷型皂苷[6~7]。珠子参所含皂苷组分与同属“人参”、“三七”相比,在成分种类以及各组分含量上均存在明显差异,因其含有大量齐墩果烷型皂苷,导致临床上用途与人参、三七差别较大[8]。现代药理学研究表明,珠子参皂苷具有抗炎镇痛、改善心肌缺血、增加脑血流量、抗肿瘤、免疫调节以及治疗白细胞减少症等功效[9~10]。
珠子参皂苷主要由甲羟戊酸(MVA)途径合成[11~12]。近年来,与珠子参亲缘关系较近的人参、三七中的皂苷合成途径上游、中游路径已基本清楚,下游的皂苷骨架后修饰过程也在逐步获得解析[13]。通过MVA途径合成珠子参皂苷的过程如下:首先,乙酰辅酶A在乙酰辅酶A酰基转移酶(AACT),3-羟基-3-甲基戊二酰辅酶A还原酶(HMGR)的催化作用下合成了甲羟戊酸(MVA)[14]。随后,异戊烯基焦磷酸(IPP)及二甲丙烯基焦磷酸(DMPP)在法呢基焦磷酸(FPS)的催化下形成法呢基焦磷酸(FPP),同时FPP在鲨烯合成酶(SS)及鲨烯环氧酶(SE)的催化下生成2,3-氧化鲨烯,它是三萜皂苷及植物甾醇等物质的共同前体物质。2,3-氧化鲨烯由达玛烯二醇合酶(DS)催化进入达玛烷型皂苷合成支路,同时,经由β-香树脂合成酶(β-AS)催化,进入齐墩果烷型皂苷合成支路(图1)。
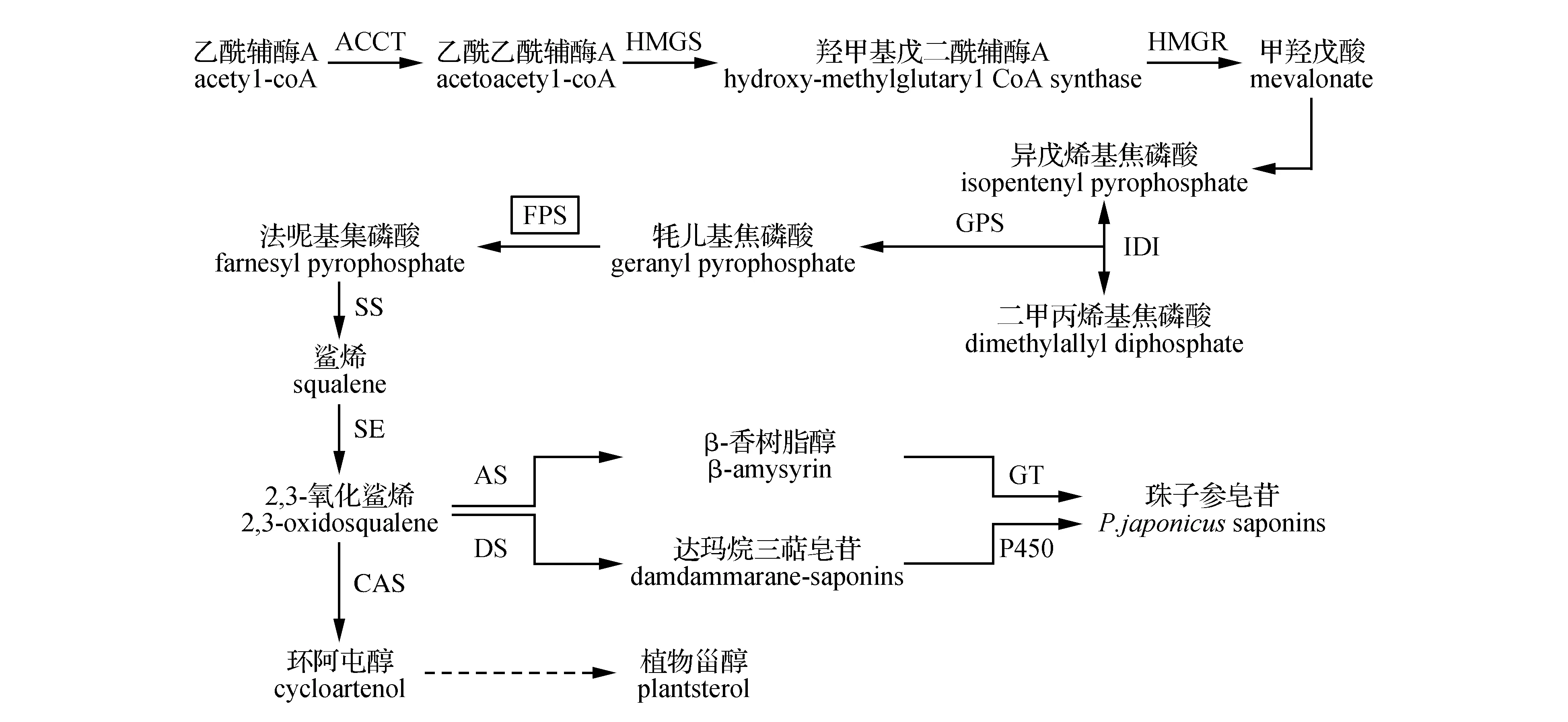
图1 珠子参皂苷及植物甾醇生物合成途径 HMGR. 3-羟基-3-甲基戊二酰辅酶A还原酶;FPS.法呢基焦磷酸合成酶;SS.鲨烯合成酶;SE.鲨烯环氧酶;DS.达玛烯二醇合成酶;AS.香树脂合成酶;CAS.环阿屯醇合成酶;GT.葡萄糖基转移酶;P450.细胞色素P450Fig.1 The synthesis pathway of P.japonicus saponins and plant sterols HMGR. 3-hydroxy-3-methylglutaryl CoA reductase; FPS. Farnesyl-pyrophosphate synthase; AS. Amysyrin synthase; SS. Squalene synthase; SE. Squalene epoxidase; DS. Dammarenediol-Ⅱ synthase; CAS. Cycloartenol synthase; GT. Glucosyl transferase; P450. Cytochromes P450
在植物三萜皂苷合成途径中,FPS可能是关键酶之一,FPS不仅在植物基本的生命活动中起着重要作用,而且对泛醌、甾醇、植保素、甾醇、三萜类、黄酮类等代谢产物的积累量也起着重要作用。在拟南芥中如果同时敲除法呢基焦磷酸合酶基因FPS1和FPS2,将会引起植株死亡[15]。Yang等人的研究表明通过调控FPS基因的表达,可以影响人参属植物三七皂苷的生物合成[16];此外,也有研究证明过表达人参皂苷合成途径中关键酶基因会导致人参皂苷积累量的变化[17]。由于珠子参与人参、三七同属,因此对珠子参皂苷生物合成中关键酶基因进行调控也可能会影响珠子参皂苷的合成。本研究选取珠子参皂苷生物合成途径中酶基因PjFPS为研究对象,在珠子参细胞中过表达该基因从而明确PjFPS的功能及其在皂苷合成过程中的地位,为获得高效、稳定的珠子参皂苷合成调控技术提供理论参考和依据。
1 材料与方法
1.1 实验材料
实验材料珠子参来源于云南省玉龙县,经云南大学虞泓教授鉴定为珠子参(Panaxjaponicus),本研究所用的珠子参材料是本实验室从珠子参药用部位诱导并培养的珠子参愈伤组织。研究中所用的农杆菌感受态细胞EHA105,大肠杆菌感受态细胞Trans1-T1及植物过表达载体pCAMBIA2300s均由本实验室保存;实验中用到的克隆载体pGEM-T和M-MVL逆转录试剂盒均购买于Promega公司;SanPrep柱式DNA胶回收试剂盒和质粒提取试剂盒均购于上海生工生物工程有限公司。
1.2 方法
1.2.1 珠子参RNA的提取和cDNA第一链的合成
采用两步法提取珠子参总RNA。首先通过改良的异硫氰酸胍法进行初提,随后通过酚和氯仿抽提以及DNA酶消化处理后,获得纯度较好的珠子参总RNA[18]。cDNA第一链的合成利用M-MVL逆转录试剂盒完成,将获得的cDNA置于-20℃条件下保存备用。
1.2.2 PjFPS基因的克隆
为获得珠子参皂苷合成途径中关键酶PjFPS基因序列,本研究根据NCBI上公布的人参(AGV26444.1)、三七(AHZ59734.1)FPS基因的保守结构区域作为模板设计PjFPS基因的特异性引物为PjFPS-BamHⅠ-F:5′-CGCGGATCCGGTACCAGAATGAGCGATCTGAAGACGAG-3′,PjFPS-PstⅠ-R:5′-TGCACTGCAGTCTAGAACAGACAACAACTTCCCCTCCAT-3′。克隆体系为:cDNA模板5.0 μL,10×Buffer:5.0 μL,Extaq酶:0.5 μL,dNTPs:4.0 μL,10 μmol·L-1的上下游引物:0.5 μL,Nuclease-free water:34.5 μL,总体系为50.0 μL。反应程序如下:95℃预变性5 min,然后进入32个循环(95℃,30 s;56℃,30 s;72℃,1 min 10 s),循环结束后72℃延伸7 min。利用SanPrep柱式DNA胶回收试剂盒对所得目的基因片段进行提取与纯化,并将其与克隆载体pGEM-T进行连接,筛选阳性菌株并测序,最终获得珠子参生物合成途径中关键酶基因PjFPS的cDNA序列。菌液测序和引物合成均由上海生物工程技术服务有限公司完成。
1.2.3PjFPS基因过表达载体的构建及阳性细胞系的抗性初筛
通过BamHⅠ和PstⅠ两种限制性内切酶进行过表达重组载体pCAMBIA2300s-PjFPS的构建。运用热激转化法将重组载体转化到大肠杆菌DH5α感受态细胞中,并筛选阳性菌株。运用液氮冻融法将上述阳性菌种的质粒转移到EHA105农杆菌感受态细胞中,同时将上述农杆菌侵染普通的珠子参细胞从而获得PjFPS转基因珠子参阳性株系。
提取生长状态良好的9株PjFPS转基因珠子参阳性系的基因组DNA,并以卡那霉素抗性基因nptⅡ为目的条带进行扩增,其中nptⅡ的特异性引物如下:nptⅡ-F:5′-CTCTGATGCCGCCGTGTT-3′,nptⅡ-R:5′-CCCTGATGCTCTTCGTCCA-3′。PCR检测反应条件和反应体系如下:基因组DNA模板:1.5 μL,10×EasyTaq Buffer:2.0 μL,dNTPs:1.5 μL,DNA Polymerase:5.0 μL,10 μmol·L-1的上下游引物:0.2 μL,Nuclease-free water:14.5 μL,总体积为20.0 μL。PCR条件如下:95℃预变性5 min,然后进入32个循环(95℃ 30 s,54℃ 30 s,72℃ 2 min),循环结束后72℃延伸7 min。PCR反应的产物则通过1.0%的琼脂糖凝胶电泳进行检测。
1.2.4转基因珠子参细胞系的荧光定量分析及FPS酶活测定
PjFPS基因的表达水平通过荧光定量PCR检测。转基因珠子参阳性株系RNA的提取和纯化与上述方法相同。本实验涉及特异性引物如下:18srRNA-F:5′-AACCATAAACGATGCCGACCAG-3′,18srRNA-R:5′-TTCAGCCTTGCGACCATACTCC-3′;qFPS-F:5′-ACAGACAACAACTTCCCCTCCAT-3′,qFPS-R:5′-AGAATGAGCGATCTGAAGACGAG-3′。整个反应通过GoTaq®2-Step RT-qPCR System(Promega,USA)完成,具体程序设置为:94℃预变性30 s,45个循环(94℃变性5 s,60℃退火反应30 s,72℃延伸30 s)。
通过改良的紫外分光光度计测定法测定转基因珠子参阳性株系的酶活。通过由0.1 mol·L-1蔗糖,0.05 mol·L-1氯化钠,0.04 mol·L-1磷酸二氢钾,0.03 mol·L-1EDTA钠盐构成的Buffer A以及加入0.02 mol·L-1二硫苏糖醇(DTT)的Buffer A的Buffer B提取珠子参可溶性PjFPS的微粒体蛋白。考马斯亮蓝法测定提取的PjFPS微粒体蛋白的浓度,用紫外分光光度计在350 nm处测定了空白对照及上述转基因样品的吸光度,具体操作如下:向比色皿中加入100.0 μL NADPH,10.0 μL蛋白提取液,用适量反应缓冲液溶液补齐至1 000.0 μL,同时在测量样本吸光度时还需要加入50.0 μL牦儿基焦磷酸(GPP)启动反应。并根据下列公式[酶活(μmol·mg-1)·min-1]=[(△350/min样品-△350/min空白)/(12.44×V×M)-1]进行PjFPS酶活的测定。
1.2.5转基因珠子参细胞的皂苷含量及植物甾醇含量测定
准确称取珠子参皂苷标准品粉末10.0 mg,用适量甲醇进行溶解。以吸光值为横坐标,以珠子参总皂苷含量为纵坐标,绘制珠子参皂苷标准曲线。称取转基因珠子参细胞系的粉末用适量甲醇溶液溶解,超声提取法获得珠子参+总皂苷的粗提物,利用HPD100大孔树脂获得纯度较好的珠子参皂苷。以香草醛—高氯酸—冰乙酸显色反应为基础,利用标准曲线测定上述转基因珠子参细胞系的总皂苷含量。
称取干燥至恒重的转基因珠子参细胞系粉末1.0 g,以石油醚作为溶剂,以氢氧化钾—乙醇溶液的皂化反应、正己烷萃取为基础,通过索式提取方式获取转基因珠子参阳性细胞系的植物甾醇提取物。根据乙酸酐—浓硫酸的显色反应测定了植物甾醇的含量,并以吸光值为横坐标,植物甾醇浓度为纵坐标绘制标准曲线。利用标准曲线进行植物甾醇的含量的计算。
1.2.6 统计分析
本实验所有数据均来源于三组独立重复实验。根据这三组重复试验计算标准差平均值。根据T检验,转基因株系和对照组之间显着性差异的测量参数用星号(*P<0.05;**P<0.01)表示。
2 实验结果
2.1 PjFPS转基因珠子参细胞系的获得
本实验采用同源克隆法,成功克隆得到珠子参FPS基因,命名为PjFPS,提交到NCBI中GenBank数据库,获得的登录号为KP684141。该基因的cDNA序列包含一个1 200 bp的开放阅读框,编码342个氨基酸。PjFPS基因编码蛋白的分子质量39.7 kD,同时具有聚戊烯基合酶家族(Accession:IPR000092)和类异戊二烯合酶(Accession:IPR008949)功能结构域的特异性识别序列。PjFPS的获得,为后续研究奠定了基础。通过农杆菌遗传转化操作,本研究获得了9株具有抗性的转PjFPS细胞系,提取阳性细胞系的基因组DNA,以nptⅡ-F和nptⅡ-R为特异性引物进行PCR扩增,琼脂糖凝胶电泳结果显示,所有细胞系在大约450 bp处均有与预期大小一致的特异性条带(图2)。由于1号的生长状态较差并且6号转基因细胞系的特异扩增条带并不明显,存在假阳性细胞系的可能性,因此在荧光定量,酶活测定等后续实验中只针对剩下的7株转基因珠子参细胞系开展研究,依次编号为F-1、F-2、F-3、F-4、F-5、F-6、F-7。
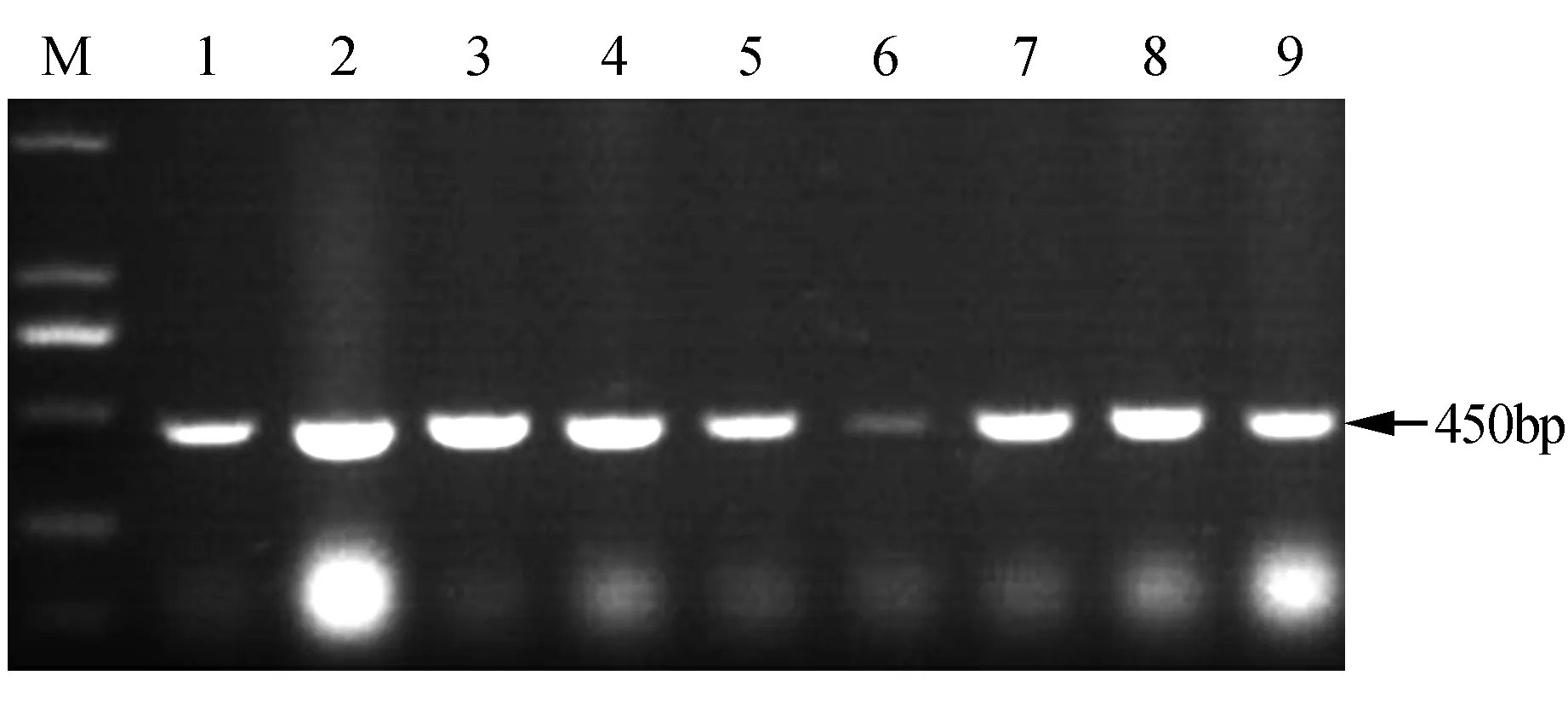
图2 PjFPS转基因珠子参细胞系的nptⅡ基因的PCR检测 M. DL2000 Marker;1~9.转基因珠子参细胞系Fig.2 The PCR detection of nptⅡ gene in PjFPS-transgenic P.japonicus cell lines M. DL2000 Marker; 1-9. The transgenic P.japonicus cell lines
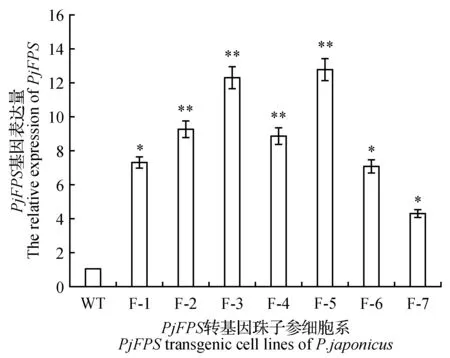
图3 PjFPS基因相对表达量 WT.野生型珠子参细胞系;F-1~F-7. PjFPS转基因珠子参细胞系 下同。Fig.3 The relative expression of PjFPS WT. The wild-type P.japonicus cell lines; F-1-F-7. The transgenic P.japonicus cells of PjFPS The same as below.
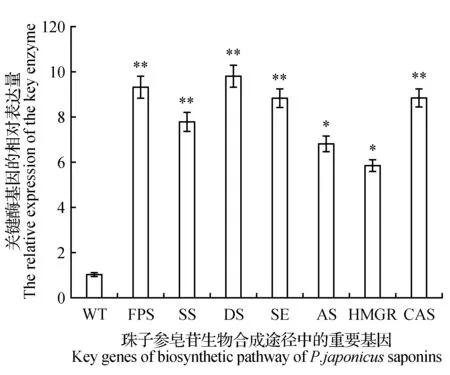
图4 珠子参皂苷生物合成中关键酶基因的表达情况 WT.野生型珠子参细胞系;FPS.法呢基焦磷酸合成酶基因的相对表达量;SS.鲨烯合成酶基因的相对表达量;DS.达玛烯二醇合成酶基因的相对表达量;SE.鲨烯环氧酶基因的相对表达量;AS.香树脂合成酶基因的相对表达量;HMGR. 3-羟基-3-甲基戊二酰辅酶A还原酶基因的相对表达量;CAS.环阿屯醇合成酶基因的相对表达量Fig.4 The relative expressions of key enzyme genes of P.japonicus saponins biosynthesis WT. The wild-type P.japonicus cell line; FPS. The relative expressions of farnesyl-pyrophosphate synthase gene; SS. The relative expressions of squalene synthase gene; DS. The relative expressions of dammarenediol-Ⅱ synthase gene; SE. The relative expressions of squalene epoxidase gene; AS. The relative expressions of amysyrin synthase gene; HMGR. The relative expressions of 3-hydroxy-3-methylglutaryl CoA reductase gene; CAS. The relative expressions of cycloartenol synthase gene
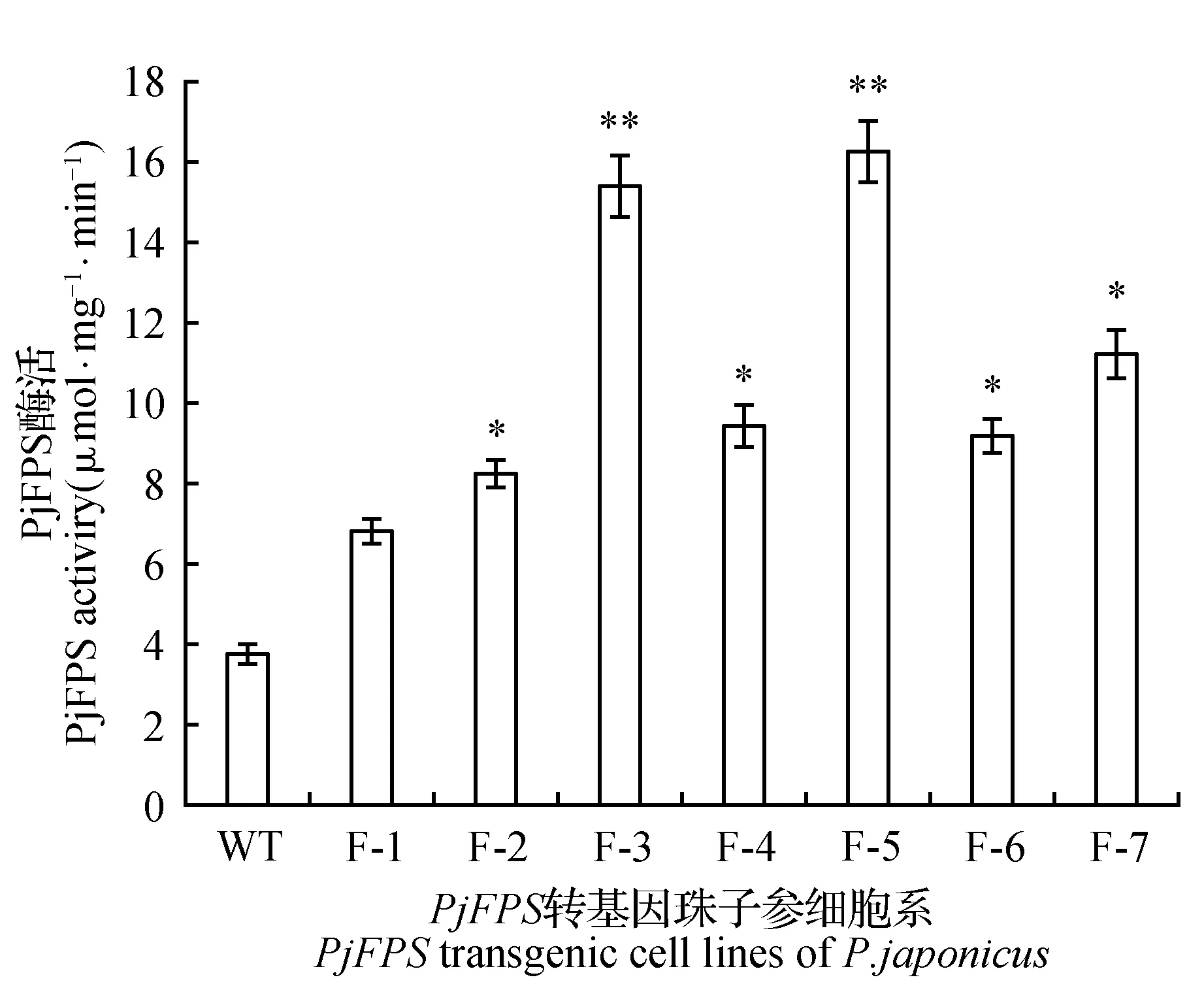
图5 PjFPS酶活Fig.5 The enzyme activities of PjFPS
2.2 与珠子参皂苷合成相关的关键酶基因表达量及FPS酶活分析
以上述F-1~F-7株系的cDNA为模板进行PjFPS基因相对表达量的分析。结果显示这7株阳性细胞系中,PjFPS基因的相对表达量与野生型相比均有不同程度提高。F-3株系和F-5株系PjFPS基因相对表达量的增加最多,约为野生型对照组的12倍,而F-7株系为对照组的4倍(图3)。PjFPS转基因细胞系中(F-2株系),PjFPS基因过表达引起了皂苷合成主代谢流以及下游分支代谢流相关其它重要基因的表达量出现不同程度提高(图4)。酶活分析表明,F-1~F-7转基因珠子参阳性细胞系FPS的活性与野生型相比均有提高。其中F-5株系的PjFPS酶活最高,约为野生型株系的4倍(图5)。各阳性细胞系PjFPS基因表达量的变化趋势基本与酶活变化有较好的对应关系。
2.3 皂苷含量及植物甾醇含量的测定与分析
F-1~F-7中珠子参总皂苷含量与未转基因的珠子参细胞系相比有明显的提高。在整个实验组中,F-5株系总皂苷含量约为野生型对照组的3倍,也明显高于其它阳性细胞系(图6)。7株转基因珠子参阳性细胞系中植物甾醇含量与野生型相比均有不同程度的增加(图7)。因此过表达PjFPS不仅可以有效提高珠子参中主要活性成分皂苷的含量也可以提高植物甾醇的含量。
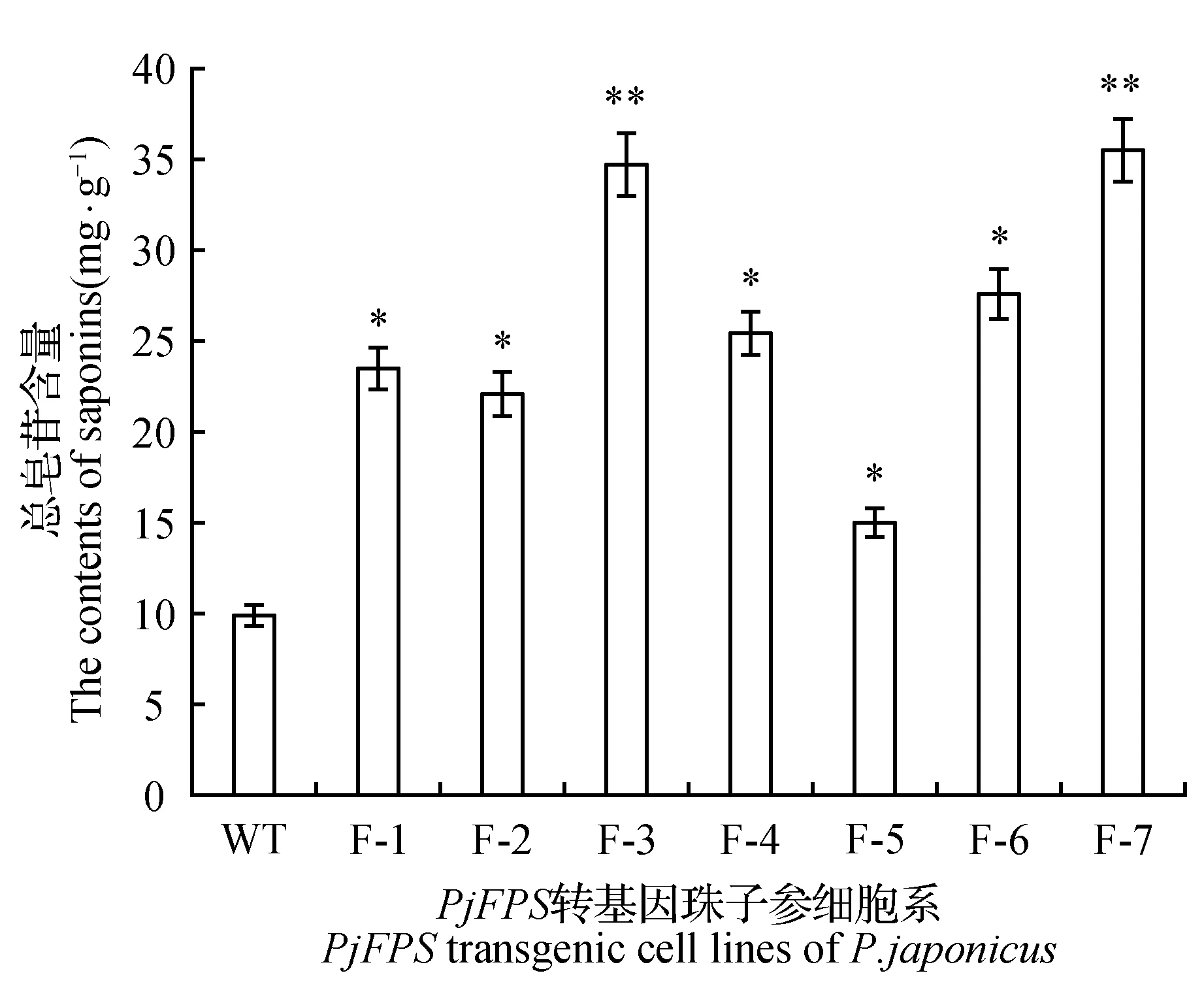
图6 总皂苷含量Fig.6 The contents of the total saponins

图7 总甾醇含量Fig.7 The contents of phytosterol
3 讨论
人参属药材中,人参、三七备受关注,研究较多,珠子参虽为中国传统名贵中药,却长期缺乏系统认识和研究。近年来,越来越多的研究证明珠子参具有广泛而重要的药理学活性,因此,相关基础研究有必要受到重视和加强。其中,研究珠子参主要活动成分三萜皂苷的生物合成途径,了解影响珠子参皂苷合成的关键酶,显得尤为重要。我们课题组曾经开展过三七皂苷生物合成的研究,积累了一些经验,认为从分子水平上影响人参属三萜皂苷合成的关键因素主要包括:(1)合成途径中重要酶催化步骤功能基因的表达;(2)控制多个关键酶基因表达的转录因子活性。
目前,珠子参皂苷生物合成途径中关键酶基因的克隆研究已取得了一些进展。Huang等首次从珠子参中克隆获得珠子参皂苷生物合成途径中关键酶基因PjAS,该基因是控制皂苷合成流向齐墩果烷型皂苷的第一个关键酶基因[19]。此外,珠子参皂苷生物合成途径中关键酶基因PjDS和PjSS也相继被克隆[20]。FPS是植物三萜皂苷合成途径中偏上游的关键酶,关于珠子参FPS的研究鲜有报道,已有的相关研究主要集中五加科的其他物种,包括从人参(Panaxginseng)中克隆了编码343个氨基酸且长度为1 134 bp的FPS基因[21];从常春藤(Hederahelix)中克隆了编码342个氨基酸且长度为1 050 bp的常春藤FPS基因[22];从三七(Panaxnotoginseng)中克隆了编码343个氨基酸且长度为1 031 bp的FPS基因(DQ059550)[23]。本研究成功克隆了编码342个氨基酸且长度约为1 200 bp的珠子参皂苷生物合成途径中关键酶基因PjFPS的cDNA序列,通过比对发现珠子参FPS基因(KP684141)与上述几种植物的FPS基因均具有98%以上的相似性。
调控珠子参皂苷合成的策略可从两个层面展开。一是细胞水平上的调控,即对珠子参植株进行物理、化学或环境胁迫,诱导皂苷合成量的增加,该方法难以实现对皂苷合成的稳定调控,操作层面粗放,效果一般,是根据次生代谢物合成的特点引起“量”的变化,而不能改变遗传上的本质因素[24];二是从分子水平影响皂苷合成,通过直接控制皂苷合成的关键酶基因或者相关转录因子基因的表达,形成定向、高效、可靠的皂苷合成调控手段,分子操作是控制皂苷合成的根本途径。本研究通过过表达珠子参FPS基因的的方法,成功促进了珠子参皂苷的生物合成,提高了皂苷含量,明确了珠子参中FPS的功能。通常认为,FPS可能是植物三萜合成的重要调控点[25],国内外对于FPS基因的功能研究已经取得了一些进展。Kim等通过构建人参PgFPS基因过表达载体,并将其转化到人参发根中,实现PgFPS基因在人参发根细胞中过表达,从而引起了人参皂苷含量的增加,其中该转基因人参发根中PgFPS基因相对表达量和皂苷含量与野生型相比分别提高了十倍和三倍以上[26]。另外,将人参FPS在积雪草中过量表达,可提高积雪草中的固醇类和三萜类化合物的积累。在烟草FPS功能研究方面,FPS基因过量表达可以促进烟草叶片中类胡萝素生物合成[27];将薄荷FPS在烟草中过表达,同样可提高烟草及烟草发根中倍半萜植保素的积累量[28];我们的前期研究表明,在三七细胞中同时过表达PnHMGR与PnSS,三七皂苷的生物合成能力可提高约四倍,而且同时过表达两个关键酶基因对皂苷合成的影响确实比仅过表达一个基因要明显[29]。本研究中还发现,由于皂苷代谢流的增加,直接促进了与皂苷合成相关的重要酶基因的表达。同时,除了皂苷合成被促进外,植物甾醇的合成也增加了,其原因在于PjFPS是三萜合成途径中比较上游的关键酶,植物甾醇与三萜皂苷的合成共享路径(图1),因此,PjFPS的表达增加,提高了整条通路的代谢流,于是三萜皂苷合成支路代谢流增加的同时,植物甾醇合成支流的流量也随之增加,最终导致珠子参皂苷和植物甾醇的合成同时获得了促进。
本研究在珠子参细胞中实现了PjFPS的过表达,成功促进了珠子参皂苷的合成,证明PjFPS确实是珠子参皂苷合成的关键酶,能够有效影响三萜皂苷以及植物甾醇的合成。接下来,将重点研究关键酶基因与重要转录因子的相互作用,力图把关键酶调控层面与转录因子调控层面结合起来,构建更为高效、科学、合理的皂苷调控手段,全方位、多角度解析珠子参皂苷的合成机制。
