酶法提取芡实壳多糖的研究
2018-07-23许开聪梁志成
董 基 张 帅 许开聪 梁志成
(肇庆学院食品与制药工程学院,广东肇庆 526061)
芡实,又名鸡头米,为睡莲科植物芡的成熟种子。芡实有收敛、滋养、强壮之功效,还具有抗氧化和修复心肌局部缺血等作用。芡实壳是芡实种仁加工过程中产生的主要副产物,约占种仁质量的40%。芡实壳主要被农民作为薪柴或者丢弃,既造成了资源的巨大浪费,又会产生严重的环境问题。目前,国内外对芡实的研究主要集中在营养成分分析、黄酮类物质和淀粉及蛋白的提取等方面,对芡实壳多糖提取方面的研究却少有报道。芡实壳多糖的利用价值还需进一步开发利用,如作芡实壳多糖抑菌方面的研究等。本试验采用酶法提取芡实壳多糖,并通过单因素和正交试验优化了提取工艺。本研究不仅为芡实壳多糖的提取提供数据参考和工艺示范,而且为芡实壳多糖的应用和开发打下了坚实基础。
1 材料与方法
1.1 原料和试剂
芡实壳,由本地农户提供,去掉表面杂质。
纤维素酶,活力10 000U/g和氏璧生物科技有限公司;盐酸、碳酸钠、石油醚、丙酮、浓硫酸、乙醇、苯酚等,均为国产分析纯。
1.2 仪器设备
数显恒温水浴锅,江苏省金坛市环宇科学仪器厂;数显电热恒温干燥箱,上海圣欣仪器有限公司;D Y F-250A高速粉碎机,上海比朗仪器有限公司;pHS-25(数显)pH计,上海科学仪器有限公司;752紫外可见分光光度计。
1.3 试验方法
1.3.1 工艺流程
芡实壳→筛选→清洗→烘干→粉碎→干燥至恒重→样品→索氏提取法去除脂肪→去离子水浸泡→调节溶液pH值至4.0→纤维素酶水解→水浴浸提→抽滤→多糖滤液→乙醇沉淀→静置后抽滤→洗涤沉淀物→干燥→芡实壳多糖
1.3.2 芡实壳多糖提取
1.3.2.1 样品处理
取一定量的芡实壳,除杂后用水清洗,65℃条件下烘干。将烘干后的芡实壳粉碎,过40目筛,将过筛的粉末置于烘箱中于65℃下干燥至恒重。
1.3.2.2 脱脂
称取适量芡实壳粉末样品放入滤包中,以石油醚(60℃~90℃)作为溶剂,用索氏提取法除去芡实壳粉末中的油脂,将处理好的芡实壳粉末样品放在阴凉干燥的容器中备用。
1.3.2.3 调节溶液pH值
称取适量已去除脂肪的芡实壳粉末样品置于烧杯中,加入一定量去离子水进行搅拌;用胶头滴管向溶液中加入浓度为0.2mol/L的醋酸钠缓冲液,定容至50mL,并使用pH计,调节溶液pH值至4.0。
1.3.2.4 纤维素酶水解
加入质量分数3%的纤维素酶于溶液中,55℃恒温水浴中静置3 h;酶解完成后,加热至沸腾,并保持2min灭酶;抽滤取滤液,用分光光度计测定滤液中多糖的吸光度。
1.3.2.5 多糖聚沉
在酶解的滤液中加入3倍体积95%的乙醇溶液,在室温下静置12 h。芡实壳多糖会以土黄色絮状物沉淀析出。
1.3.2.6 干燥
用抽滤法,将样品过滤出来,取滤渣,分别用无水乙醇、丙酮、乙醚洗涤3次,洗涤后,收集滤渣静置于通风橱通风1 h至有机溶剂完全挥发,然后将样品于60℃下恒温干燥2 h,将滤纸上的物质轻刮取出,即得芡实壳多糖。
1.3.3 芡实壳多糖测定
采用苯酚-硫酸法测定芡实壳多糖的含量。
1.3.3.1 绘制葡萄糖标准曲线
用葡萄糖作标样(1 mg/mL),依次准确吸取0 mL、0.1mL、0.2mL、0.3mL、0.4mL、0.5mL、0.6 mL、0.7 mL、0.8 mL葡萄糖标准溶液于9支25mL的具塞刻度试管,加去离子水至10mL刻度,各加入5%苯酚1.0mL轻轻摇匀后,缓慢加入浓硫酸5mL,再充分摇匀,静置30min完全冷却至室温,将0号具塞试管作为空白对照,用可见分光光度计测波长490 nm处的吸光度,横坐标对应葡萄糖质量浓度,纵坐标对应多糖溶液吸光度,得到葡萄糖标准曲线,回归方程为y=0.75x-0.033 2,R2=0.994 4,葡萄糖标准品浓度的线性范围为0.107mg/mL ~0.865mg/mL。
1.3.3.2 芡实壳中的多糖含量
取粗多糖0.1 g,转移至10mL容量瓶中,加水至刻度,配得粗多糖溶液。取粗多糖溶液1mL,测定其吸光度。依据标准曲线方程,计算出芡实壳粗多糖的质量浓度,按下式计算多糖提取率:

式中:X——多糖提取率,%;
f——回归方程中的相关系数;
c——芡实壳多糖的质量浓度,mg/mL;
V——样品浓度稀释体积,mL;
M——称取芡实壳粉末样品的质量,mg。
1.3.4 芡实壳多糖提取工艺优化
首先通过单因素试验分别考察酶解温度、酶解时间、加酶量及溶液pH值对多糖提取率的影响,然后利用四因素三水平L9(34)正交试验优化芡实壳多糖的提取工艺。
2 结果与分析
2.1 单因素试验结果
2.1.1 酶解温度对多糖提取率的影响
分别称取1.0 g已处理过的芡实壳样品粉末5份,每份加入适量去离子水浸泡摇匀,分别加入质量分数2.0%的纤维素酶,并定容至50mL,酶解时间为2 h,溶液pH为4.0,考察酶解温度为45℃、50℃、55℃、60℃、65℃时对芡实壳多糖提取率的影响,结果见下页图1。
从图1可看出,随着酶解温度的升高,芡实壳多糖的提取率增加,当温度达到55℃时,提取率达最大值,此后多糖提取率呈现下降趋势。
2.1.2 酶解时间对多糖提取率的影响
分别称取1.0 g已处理过的芡实壳样品粉末5份,每份加入适量去离子水浸泡摇匀,分别加入质量分数2%的纤维素酶,并定容至50mL,酶解温度为55℃,溶液pH值为4.0,考察酶解时间为1 h、1.5 h、2 h、2.5 h、3 h对芡实壳多糖提取率的影响,结果见图2。
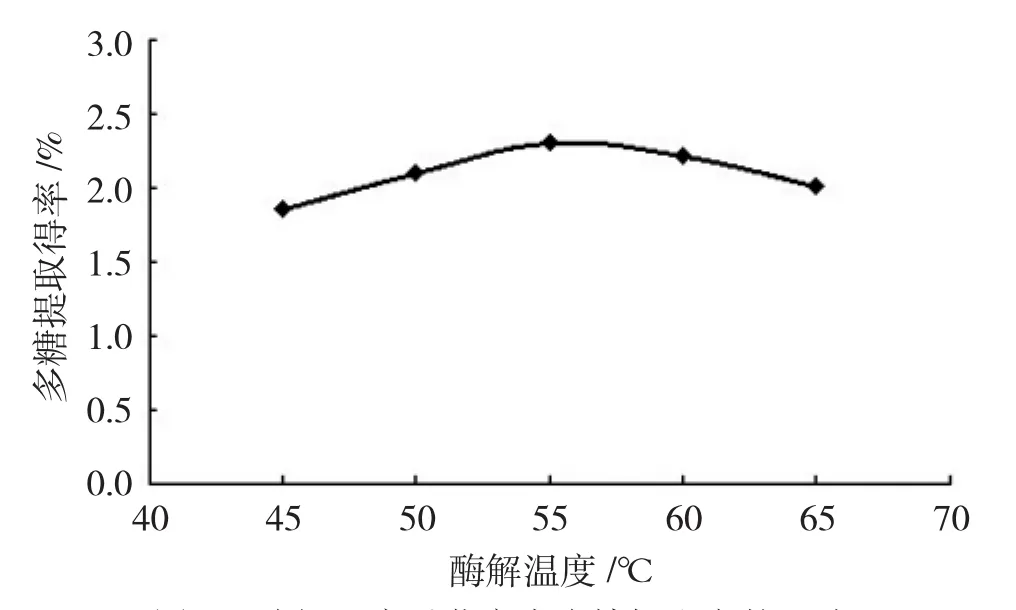
图1 酶解温度对芡实壳多糖提取率的影响

图2 酶解时间对芡实壳多糖提取率的影响
从图2可看出,随着酶解时间的增加,芡实壳多糖的提取率呈上升趋势,在达到2.5 h时,多糖提取率基本稳定。继续增加酶解时间,多糖提取率没有显著变化。
2.1.3 加酶量对多糖提取率的影响
分别称取1.0 g已处理过的芡实壳样品粉末5份,每份加入适量去离子水浸泡摇匀,并定容至50mL,酶解温度为55℃,酶解时间2.5 h,溶液pH值为4.0,考察纤维素酶加酶量为质量分数1.0%、1.5%、2.0%、2.5%、3.0%时对芡实壳多糖提取率的影响。
从图3可看出,随着加入纤维素酶量的增加,芡实壳多糖的提取率也逐渐增加。加酶量为2.5%时,多糖提取率趋于稳定,随着纤维素酶加入量的继续增加,酶解的作用效果并不明显,多糖提取率甚至有降低趋势。
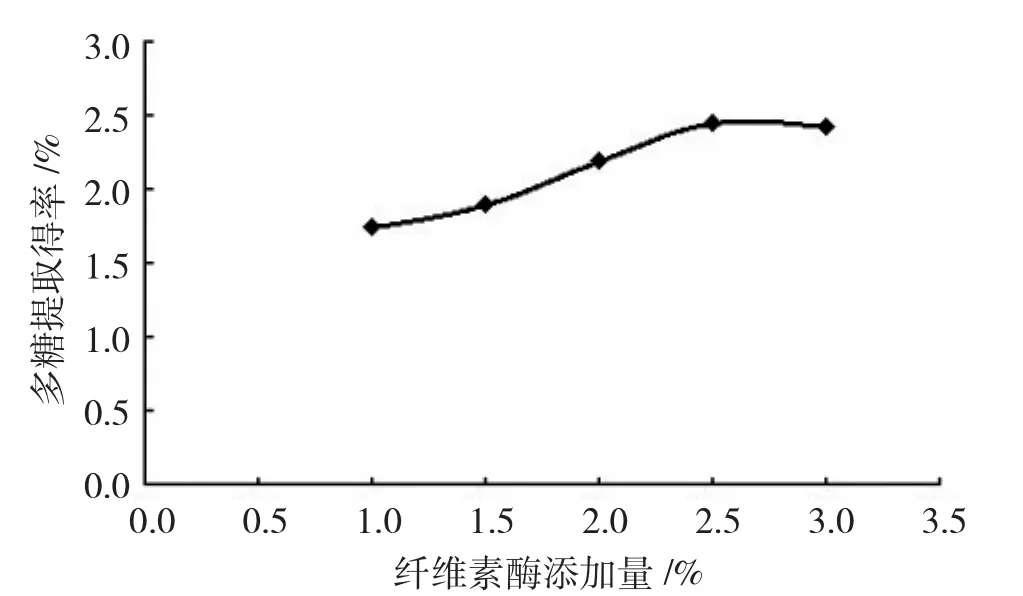
图3 加酶量对芡实壳多糖提取率的影响
2.1.4 溶液pH值对多糖提取率的影响
分别称取1.0 g已处理过的芡实壳样品粉末5份,每份加入适量去离子水浸泡摇匀,并定容至50 mL,酶解温度为55℃,酶解时间为2.5 h,加酶量为2.5%,考察溶液 pH值为3.5、4.0、4.5、5.0、5.5时对多糖提取率的影响。

图4 溶液pH值对芡实壳多糖提取率的影响
从图4可看出,多糖的提取率随着溶液pH值的增加呈先增加后减少的趋势。当溶液pH值达到4.0 h,提取率达到最大值2.41%。当溶液的pH值超过4.0继续增加时,多糖提取率反而降低。
2.2 正交试验结果
在单因素试验结果的基础上,设计L9(34)正交试验优化芡实壳多糖提取工艺条件。因素水平见表1,试验设计及结果见表2。

表1 因素水平表
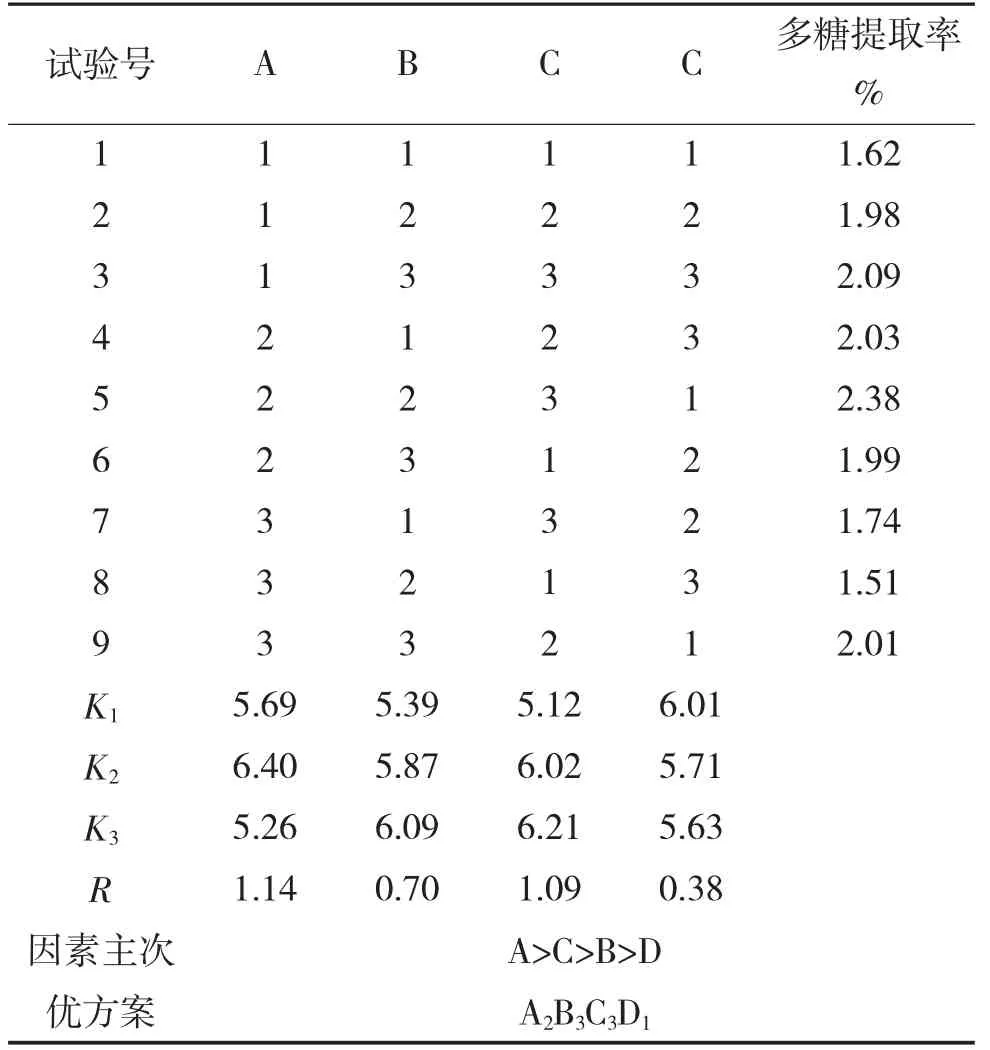
表2 试验设计与结果
从表2可看出,各因素对多糖提取率的影响次序为A>C>B>D,即酶解温度对多糖提取率的影响最大,溶液pH对多糖提取率的影响最小;另外,各因素最优水平为A2B3C3D1,即酶解温度为55℃,酶解时间为3 h,加酶量为3.0%,溶液pH为4.0,在此条件下提取芡实壳多糖,测得多糖提取率为2.45%,高于正交试验所有结果。
3 结论
本试验采用酶法提取芡实壳中的多糖。先用索氏提取法去除芡实壳中的脂肪,再用纤维素酶水解芡实壳中的粗纤维,通过恒温水浴浸提的方法,使芡实壳中的粗纤维沉淀,从而使多糖物质游离出来,再采用苯酚-硫酸法进行芡实壳多糖含量的测定。通过单因素试验和正交试验得到酶法提取芡实壳多糖的最优的工艺条件为:纤维素酶添加量3%,酶解温度55℃,溶液pH值4.0,酶解时间3 h,此工艺条件下芡实壳多糖提取率可达2.45%。
